养殖池形对子二代中华鲟生长、呼吸代谢及血清生理的影响
张海耿,范玉顶,顾川川,江 南,张宇雷,倪 琦
(1 中国水产科学研究院渔业机械仪器研究所,上海 200092; 2 中国水产科学研究院长江水产研究所,湖北 武汉 430223)
中华鲟 (Acipensersinensis)属于溯河洄游性软骨硬鳞鱼类,主要分布于中国长江干流和东南沿海一带[1]。近些年,因葛洲坝水利枢纽的修建以及受航道建设、水体污染等的影响[2-3],中华鲟自然繁殖的规模逐年减少[4],其种群数量急剧下降[5-6]。1988年,中华鲟被列入国家一级重点保护野生动物名录。2007年、2013年等多个年份在长江里未监测到其自然产卵[7-8],说明该物种的自然繁殖能力下降,其种群规模进一步缩小。为保护和增殖中华鲟的自然资源,科研人员对中华鲟人工繁殖技术进行了大量研究,目前已实现在淡水环境下中华鲟的全人工繁殖[9]。
中华鲟人工养殖的历史较短,自1997年中华鲟苗种规模化培育技术取得突破以后,才逐渐开始人工养殖中华鲟[9],对其研究主要集中在繁殖[10-11]、营养[12]和疾病[13]等方面。早期人工养殖中华鲟的模式主要是池塘养殖,随着水产养殖技术的快速发展,高效、可控、环保的工厂化养殖模式的规模正逐步壮大[14-15]。中华鲟在完成生活史的过程中,环境因子对其生长影响较大[16]。水温是中华鲟性腺发育与繁殖的必要条件[17],并影响其体内的自由基水平及抗氧化防御能力[18-19]。养殖池作为中华鲟生长的栖息场所,是至关重要的环境因子,也是循环水养殖系统中重要的设计参数。相关学者对养殖池的研究更多的是聚焦于鱼池的流态[20]及集排污效果[21],鲜有学者从生理学方面去探讨养殖池形对鱼类生长的影响。杨德国等[22-23]曾设计了一套中华鲟苗种的养殖系统,实现了中华鲟苗种的批量生产,但未见关于养殖池形对鱼生长生理影响的相关研究。
本研究从健康养殖角度探讨养殖池形对中华鲟生长及生理的影响,进而摸索出适宜中华鲟健康养殖的养殖池形,为深入理解人工养殖中华鲟所需的养殖空间条件、构建科学合理的中华鲟人工繁育集约化养殖系统提供重要的理论支撑。
1 材料与方法
1.1 试验材料
以子二代中华鲟为试验对象,产自中国水产科学研究院长江水产研究所太湖基地。子二代中华鲟平均体质量(2.82±0.15)kg,平均体长(73.77±2.15)cm,在养殖系统中暂养2周后开始试验。每天投喂2次(7:00,18:00),日投喂量为鱼体质量的0.9%,饲料选用山东升索渔用饲料研究中心生产的鲟鱼颗粒饲料。饲料营养成分为:粗蛋白≥40%、粗脂肪≥10%、赖氨酸≥2%、总磷≥1%、粗灰分≤18%、粗纤维≤6%、钙≤5%。
1.2 试验系统
试验系统采用循环水养殖系统(RAS),构建于中国水产科学研究院渔业机械仪器研究所渔业装备与工程中试基地(江苏如东)。每套RAS主要由养殖池、离心泵、水处理设施及控温系统组成。控温系统采用盘管控温方式,主要由模块式风冷涡旋式热泵机组(开利空调)、储水箱、循环泵及盘管组成。
1.3 试验设计
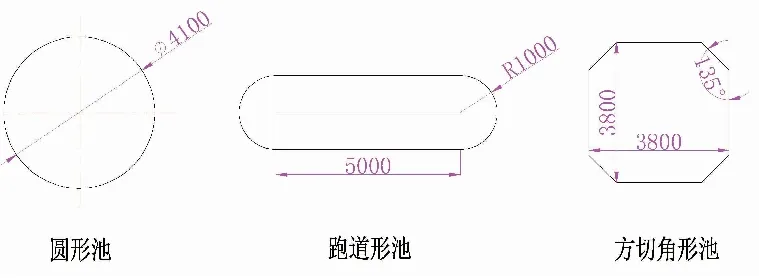
图1 3种试验养殖池的形状尺寸图Fig.1 Shape and dimension of 3 culture ponds for experiment
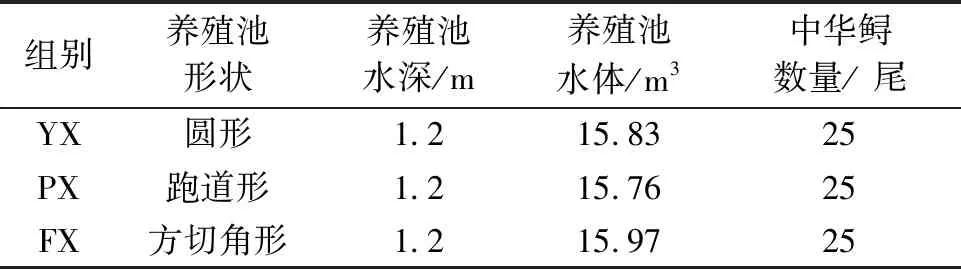
表1 试验分组情况表
1.4 测试指标
1.4.1 生长指标
生长参数所测指标包括特定生长率(SGR),饲料系数(FCR)、增重率(WG)、肥满度(CF)和存活率(SR),其计算公式如下:
SSGR=100%×(lnW2-lnW1) /t
(1)
FFCR=F/ [N2×(W2-W1)]
(2)
WWG= 100%×(W2-W1) /W1
(3)
(4)
SSR= 100%×(N1-N2) /N1
(5)
式中:t为养殖试验时间,d;W1和W2为试验初始和结束时的平均体质量,kg;N1为试验开始时子二代中华鲟尾数,尾;N2为试验结束时子二代中华鲟尾数,尾;F为饲料总投入量,kg;L2为子二代中华鲟试验结束时体长,cm。
1.4.2 生化指标
中华鲟血清指标采集时,先用MS-222将鱼麻醉后,用2 mL的一次性针管在鱼的尾鳍基部处采血,并将血液缓慢推入2 mL的离心管中;置于室温4 h后5 000 r/ min离心10 min,取上层液体至1 mL离心管,放于-80 ℃冰箱中保存待测。
项目县应对工程施工过程进行全方位监督,定期或不定期地对工程建设情况进行现场督察,发现问题立即整改;引进竞争激励机制,在标段之间定期开展观摩评比活动,取长补短,相互促进,对评比质量好的施工企业给予表彰或奖励。切实发挥监理单位的作用,监理人员、设备和措施必须按合同要求落实到位,对形成工程实体质量的原材料、半成品、机具以及施工工艺质量进行有效控制,特别是对关键的施工环节要加强监测,对隐蔽工程要有详细的施工记录。让项目乡村的干部和群众参与工程质量的监督,整个建设过程要公开透明。
血清生化指标主要包括生长因子 (IGF-I)、生长激素(GH)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)和溶菌酶(LZM)。以上指标均采用试剂盒检测,试剂盒购自南京建成生物工程研究所。
1.4.3 呼吸代谢指标
呼吸代谢指标采用静态法[24-25]进行测定,每组随机选取3尾中华鲟,指标测定周期为24 h。将鱼移入密闭水池中,用溶氧探头每隔5 min测定一次密闭水池中DO的变化,每隔0.5 h取一次水池中的水样,测定TAN的变化。当密闭水池中的溶氧饱和度低于70%时,停止DO测定,对密闭水池进行增氧,待溶氧饱和度重新回到100%时再重新进行水池中DO的测定。耗氧率和排氨率的测定公式如下:
MO2=(C2-C1)V/(t2-t1)/W
(6)
RTAN=(CN2-CN1)V/(tN2-tN1)/W
(7)
式中:MO2为子二代中华鲟的耗氧率,mg/(kg·h);t1和t2为溶氧测量时间,d;C1和C2为试验t1和t2期的溶氧质量浓度,mg/L;RTAN为子二代中华鲟的排氨率,mg/(kg·h);tN1和tN2为TAN测量时间,d;tN1和tN2为试验t1和t2期的TAN质量浓度,mg/L;W为试验中华鲟的质量,kg。
1.5 水质指标测试

1.6 数据统计分析
子二代中华鲟生长指标、耗氧率和排氨率的结果用平均值±标准差(Mean ± SD)表示,血清生化指标的结果用平均值±标准误(Mean ± SE)表示。采用SPSS10.0软件对试验数据进行方差分析,分析前对数据进行方差齐性检验,选择单因素方差分析(One-way ANOVA),并采用Duncan多重比较方法,显著性水平设置为P<0.05。
2 结果与分析
2.1 各组水质指标变化情况
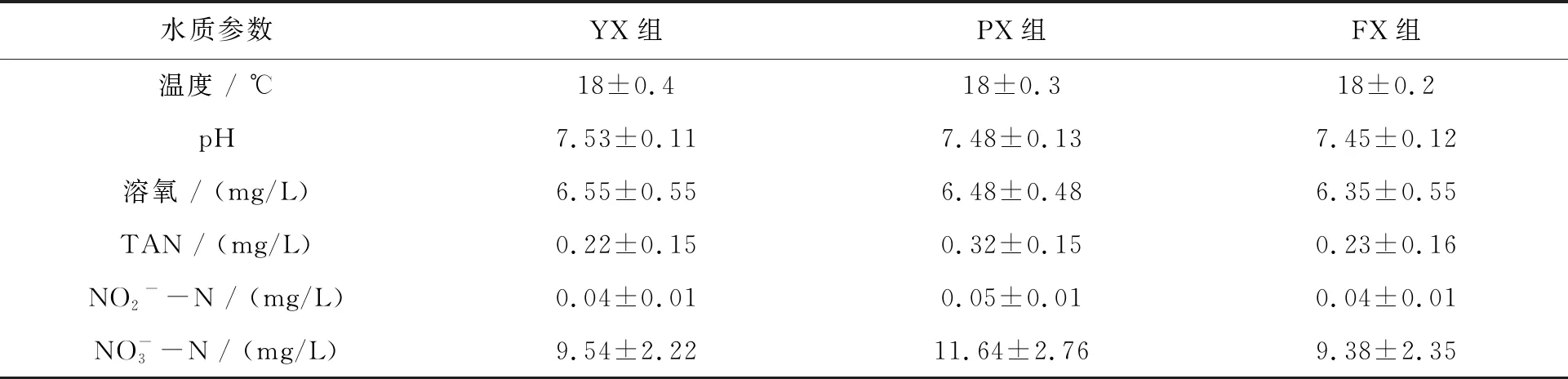
表2 试验期间各组水质指标变化情况
2.2 子二代中华鲟的生长性能变化
表3显示了不同养殖池形对子二代中华鲟生长性能的影响。由表3可知,FX组的特定生长率和增重率显著低于其他组(P<0.05),而饲料系数显著高于YX组和PX组(P<0.05)。肥满度和存活率各组之间无显著差异(P>0.05),YX组和PX组子二代中华鲟的存活率都为100%,而FX组子二代中华鲟的存活率仅为(97.33±2.31)%。
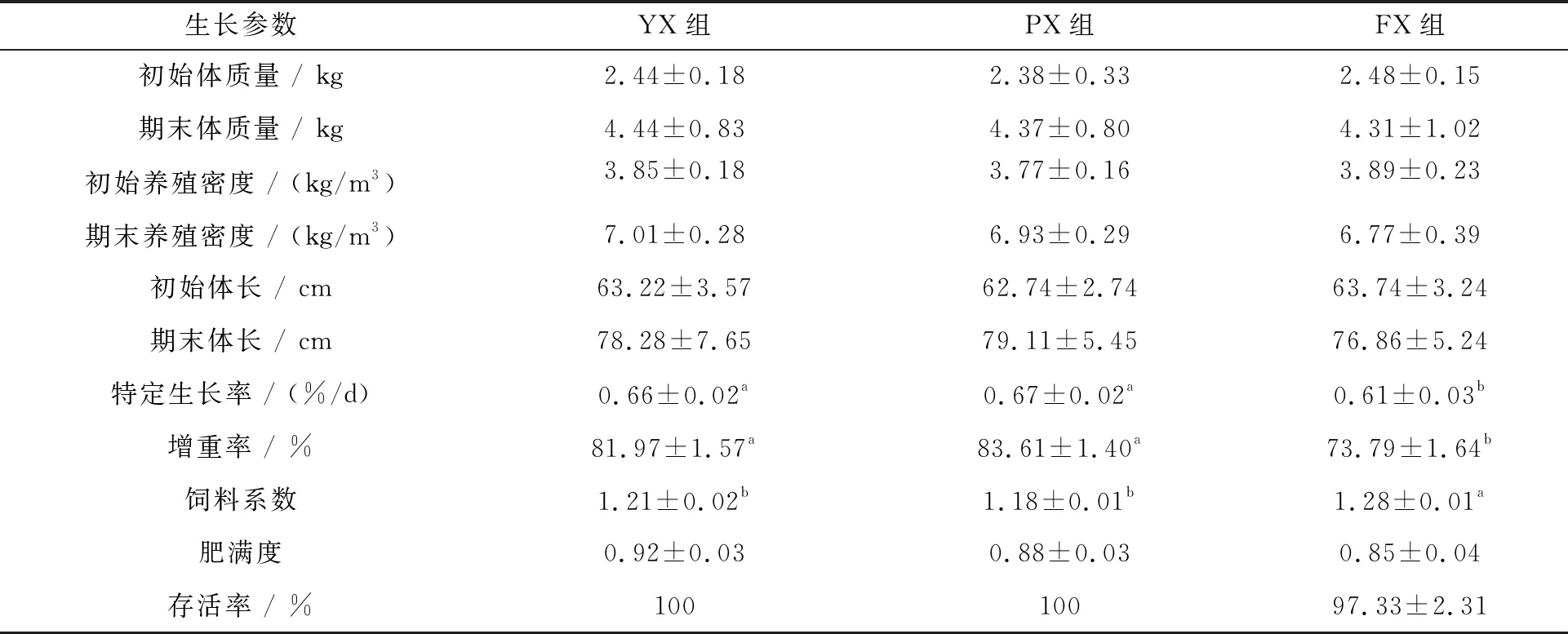
表3 不同养殖池形对子二代中华鲟生长性能指标的影响
2.3 子二代中华鲟排氨率和耗氧率的变化
不同养殖池形下子二代中华鲟耗氧率的变化如图2所示,PX组的耗氧率显著低于FX组(P<0.05),而FX组与YX组之间无显著差异(P>0.05)。图3显示了子二代中华鲟在不同养殖池形下的排氨率变化,各组中华鲟的排氨率无显著变化(P>0.05),其排氨率范围在4.28~5.91 mg/(kg·h)之间。
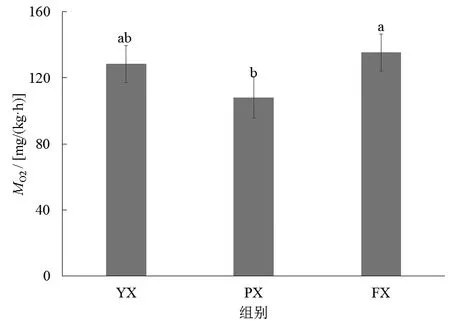
图2 不同养殖池形下中华鲟耗氧率变化Fig.2 Change of oxygen consumption rate of Acipenser sinensis indifferent shapes of culture ponds
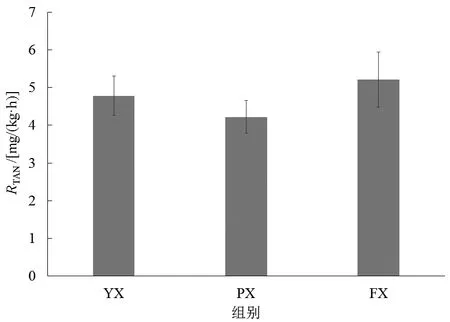
图3 不同养殖池形下中华鲟排氨率变化Fig.3 Change of ammonia excretion rate of Acipenser sinensis in different shapes of culture ponds
2.4 子二代中华鲟血清生理指标的变化
图4显示了不同养殖池形子二代中华鲟的血清生长因子变化。由图4可知,各组中华鲟的血清生长因子差异不显著(P>0.05),但FX组的平均生长因子浓度高于其他两组。各组间子二代中华鲟的血清生长激素质量浓度差异也不显著(P>0.05),而FX组的平均生长激素质量浓度低于YZ组和PX组(图5)。
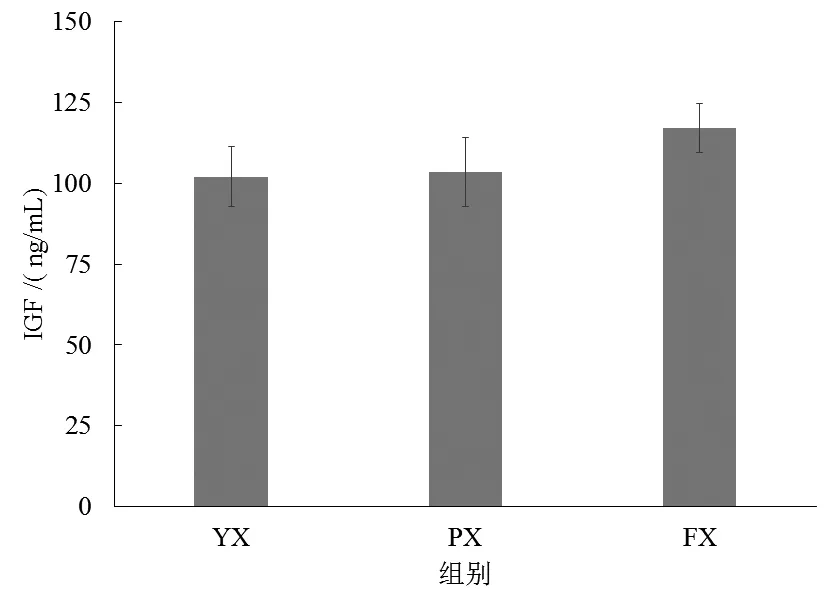
图4 不同养殖池形下中华鲟血清生长因子变化Fig.4 Change of serum growth factor of Acipenser sinensis in different shapes of culture ponds
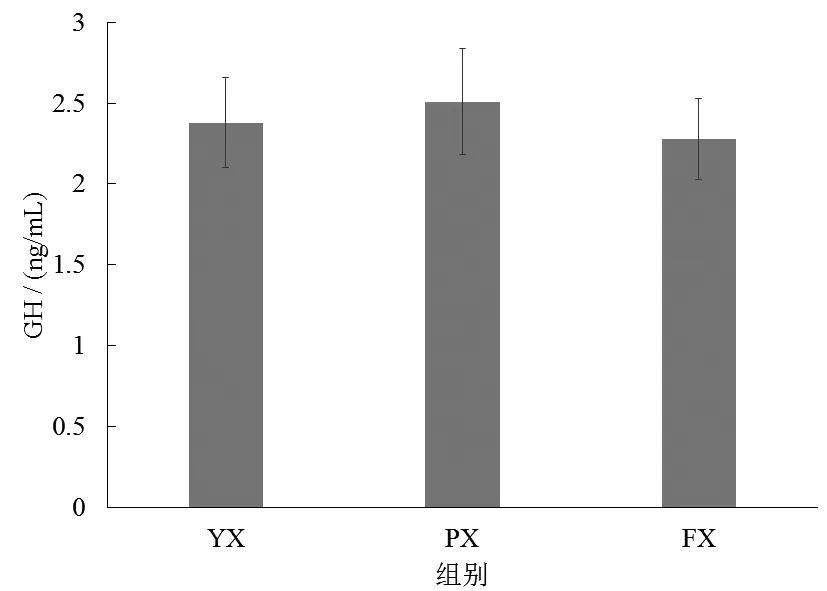
图5 不同养殖池形下中华鲟血清生长激素变化Fig.5 Change of serum growth hormone of Acipenser sinensis in different shapes of culture ponds
表4显示了不同养殖池形对中华鲟抗氧化能力的影响,FX组的GPX活性显著低于其他两组(P<0.05),而子二代中华鲟血清中的SOD、CAT和MDA活性各组之间无显著差异(P>0.05)。
子二代中华鲟血清溶菌酶的变化如图6所示,在不同养殖池工况下,各组间溶菌酶活力无显著差异(P>0.05),其活力范围在(102.23~175.44)U/mL。

表4 不同养殖池形对中华鲟抗氧化指标的影响
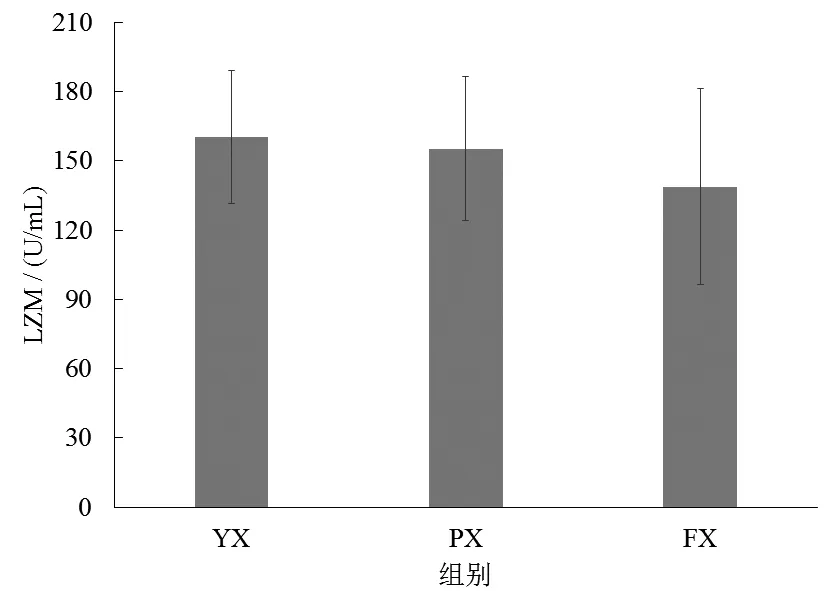
图6 养殖池形对中华鲟血清溶菌酶的影响Fig.6 Effect of culture pond shape on the serum lysozyme ofAcipenser sinensis
3 讨论
3.1 养殖池形对子二代中华鲟生长性能的影响
中华鲟头部呈三角形,吻端较突出,在游泳时易受周围环境的影响。方切角形鱼池四周有4个明显的倾斜面,饲养于方切角形鱼池的中华鲟,其吻端易碰撞于鱼池的切面。而当中华鲟的吻端受伤后,若伤口无法自愈又不及时对其进行治疗,其身体会失去平衡,进而无法进食,严重时导致死亡,故饲养于方切角形鱼池中华鲟的存活率低于其他两组。从生长指标分析可知,方切角池形组的中华鲟特定生长率和增重率都显著低于圆形池组和跑道池组,而血清中的类胰岛素生长因子(IGF-I)高于其他组。中华鲟生长速度的降低,说明其受到了一定的环境胁迫,影响了机体正常的生理代谢调控[26-27]。类胰岛素样生长因子(IGF-I) 是一类具有胰岛素样代谢和促进有丝分裂功能的多肽类激素,是调控鱼类生长和发育的重要内分泌体系[28]。有学者研究发现,IGF-I对鱼类垂体生长激素的分泌和释放存在负反馈作用。用不同质量浓度的IGF-I处理白河鲈(Pomoxisannularis)胚胎细胞,随着IGF-I质量浓度的升高,白河鲈垂体生长激素的释放量逐渐降低[29]。相似研究结果在溪红点鲑(Salvelinusfontialus)也有报道,IGF-I对溪红点鲑不但没有促生长作用,而且还会抑制溪红点鲑的生长甚至引起死亡[30]。本试验与相关学者研究相似,即中华鲟分泌的IGF-I和生长速率呈现一定的负相关关系,原因可能是由于IGF-I和GH分泌通常是过量的,而影响其作用的受体和酶等因素才有可能是养殖空间胁迫阶段生长的关键因子。
3.2 养殖池形对子二代中华鲟生理指标的影响
从呼吸代谢指标分析,饲养于方切角池中的中华鲟MO2显著高于跑道形组,原因可能是中华鲟为避免头部与鱼池的切面发生碰撞,需不断调整前进时的游泳方向,故在一定程度上增加了中华鲟的基础代谢。GPX和SOD以及CAT主要用于去除机体内产生的ROS,有学者研究发现当鱼类处于应激状态时,其机体内会产生大量的ROS,进而诱发脂质过氧化,而抗氧化酶活性也往往会受到不同程度的影响[31]。本研究发现,当子二代中华鲟饲养于方切角鱼池时,其体内的GPX显著低于其他组,并且SOD和CAT值也低于其他组。有学者对中华鲟、虹鳟和大西洋鲑等鱼研究表明,当鱼处于密度胁迫时,其体内的血清SOD和GPX活性出现显著下降的现象[32-33]。抗氧化酶活性的下降被认为是对环境胁迫慢性应激的反应[34],说明当子二代中华鲟长期生长于方切角形时,其体内抗氧化防御系统的平衡已被打乱,进而影响到中华鲟机体的健康生长。从血清溶菌酶指标分析,各组无显著差异,可能与试验设计周期有关。
4 结论
子二代中华鲟的生长受养殖池形状的影响,饲养于方切角形鱼池中的子二代中华鲟,其特定生长率和存活率低于圆形池和跑道形池,而饲料系数和耗氧率显著高于其他两组(P<0.05),基础代谢的增加导致其增重率低于其他两组。圆形池和跑道池形中子二代中华鲟的生长性能指标和生理指标无显著差异(P>0.05)。筛选获得子二代中华鲟对养殖池形敏感的血清指标GPX,该指标的降低说明子二代中华鲟的抗氧化能力受到了一定影响,进而影响其健康生长。从饲养对象健康养殖角度考虑,在设计中华鲟工厂化养殖系统时,建议养殖池形为圆形或跑道形。
□

