脂联素对结肠癌细胞的抑制作用及机制探索
李鑫 张倩云 徐洁 杨邵瑜 潘月龙
脂联素(adiponectin,ADPN)是一种脂肪组织分泌的脂肪因子,具有调节能量稳态、调控胰岛素敏感性和抗炎等多种有益的生物学功能[1]。ADPN主要通过ADPN受体1和ADPN受体2两种受体发挥作用,这两种受体广泛表达于各种组织器官中[2]。在患有代谢性疾病如肥胖、2型糖尿病和代谢综合征的患者中,ADPN水平显著降低[3]。此外,低ADPN血症是代谢综合征的相关癌症危险因素,如乳腺癌、子宫内膜癌和前列腺癌等[4-6]。
结直肠癌是全球最常见的恶性肿瘤之一[7],研究提示肥胖与结直肠癌相关[8],营养相关因素可能在结直肠癌的发生、发展中起重要作用[9]。糖尿病和高胰岛素、C肽血症与结直肠癌的高风险相关[10]。有研究指出ADPN在直接抑制肿瘤细胞增殖、肿瘤新生血管形成以及改善外周胰岛素抵抗方面具有积极的抗肿瘤作用[11]。此外还有研究发现ADPN水平与癌症发生风险呈负相关,而体外研究表明ADPN在调控细胞增殖方面起重要作用,虽然具体机制目前尚不明确[4,12]。因此本研究在上述研究的基础上进一步探讨重组ADPN在高糖高胰岛素环境下对小鼠结肠癌细胞株MCA38增殖和迁移的影响及其可能机制。
1 材料和方法
1.1 材料 小鼠结直肠癌细胞株MCA38由浙江大学肿瘤研究所惠赠。
1.2 主要试剂及仪器 小鼠重组ADPN购自北京康肽生物科技有限公司;噻唑蓝(MTT)试剂购自中国碧云天公司;RPMI1640培养基、FBS均购自美国Gibco公司;SpectraMaxM3型全波长多功能酶标仪购自美国Molecular Devices公司;ChemiDoc XRS+型凝胶成像系统购自美国Bio-Rad公司。
1.3 方法
1.3.1 细胞培养 小鼠结直肠癌细胞株MCA38置于含10%FBS的RPMI1640培养基中,37℃、5%CO2细胞培养箱内培养。当细胞生长覆盖培养瓶底部面积80%时,以0.25%胰蛋白酶消化,待镜下观察收缩至圆形且脱落时,加入培养液终止消化,1 000 r/min离心5 min后,按适当比例(1:3)进行传代,取对数生长期的细胞进行实验。
1.3.2 细胞分组 根据处理药物浓度的不同,将实验细胞分为6组:空白组、对照组(25 mmol/L葡萄糖+125 μIU/ml胰岛素)、A组(25 mmol/L葡萄糖+125 μIU/ml胰岛素+2.5 μg/ml ADPN)、B 组(25 mmol/L 葡萄糖+125 μIU/ml胰岛素+5μg/mlADPN)、C组(25mmol/L葡萄糖+125μIU/ml胰岛素+10 μg/ml ADPN)、D 组(25 mmol/L葡萄糖+125 μIU/ml胰岛素+20 μg/ml ADPN)。
1.3.3 细胞增殖抑制率检测 采用MTT实验。取对数生长期MCA38细胞接种于96孔板,每孔4×103个细胞,培养24 h贴壁后,分别按上述分组给予不同浓度药物处理,每个浓度设置4个复孔,作用72 h后,每孔加入 10 μl MTT,继续培养 4 h,弃去上清液,加入 100 μl二甲基亚砜,震荡使结晶充分溶解,酶标仪测495 nm处的吸光度(OD值),计算细胞增殖抑制率(%)=(1-实验组OD值/对照组OD值)×100%(空白组除外)。
1.3.4 细胞迁移数检测 采用Transwell实验。将Transwell小室置于24孔板中,取对数生长期MCA38细胞制备成10×104/L无血清培养液的细胞悬液,上室中加细胞悬液200 μl,分别按上述分组给予不同浓度药物处理,下室中加入600 μl 20%FBS细胞培养基,37℃孵育24 h,甲醇固定后,结晶紫避光染色30 min,流水清洗,取4个视野,摄像并计数平均细胞迁移数。
1.3.5 细胞增殖与迁移相关蛋白表达水平检测 采用Western blot法。取上述各组对数生长期细胞,提取蛋白,蛋白定量后上样,80 V电泳0.5 h后转120 V凝胶电泳,转膜,5%牛奶4℃封闭1 h,加入一抗4℃摇床孵育过夜,清洗后加入二抗,4℃摇床孵育2 h,条带加显影液后曝光,化学发光成像系统采集图片,ImageJ软件分析灰度值,计算胰岛素样生长因子2受体(IGF-2R)、大鼠肉瘤病毒癌基因蛋白(Ras)、过氧化物酶增殖激活受体 γ(PPARγ)、丝氨酸/苏氨酸蛋白激酶 1(PAK-1)表达水平。
1.4 统计学处理 采用SPSS 22.0统计软件。计量资料用表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 5组细胞增殖抑制率比较 对照组、A、B、C、D组任意两组细胞增殖抑制率比较,差异均有统计学意义(均P<0.05),且ADPN浓度越高,细胞增殖抑制率越高,见表1。
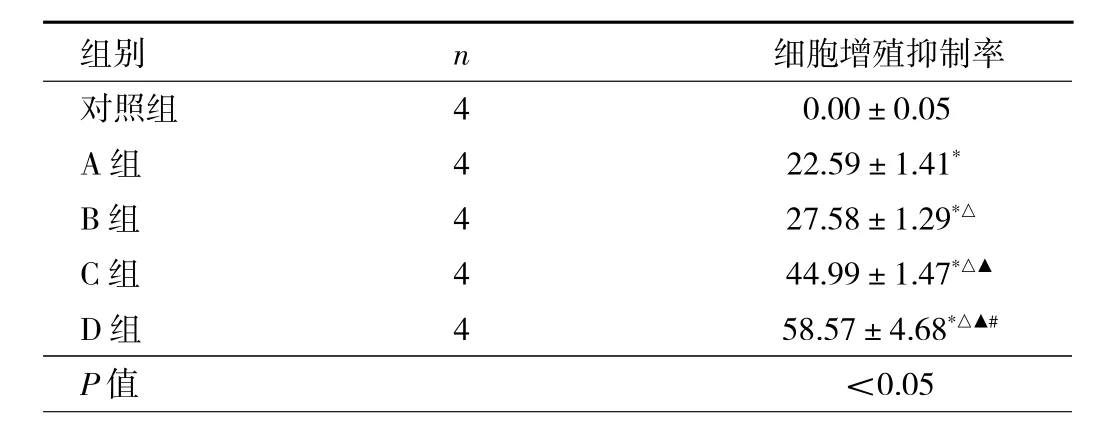
表1 5组细胞增殖抑制率比较(%)
2.2 6组细胞迁移数比较 空白组、对照组、A、B、C、D组任意两组细胞迁移数比较,差异均有统计学意义(均P<0.05),且ADPN浓度越高,细胞迁移数越少。见图1(插页)、表2。

图1 6 组细胞迁移数比较(a:空白组;b:对照组;c:A 组;d:B 组;e:C 组;f:D 组;结晶紫染色,×200)

表2 6组细胞迁移数比较(个)
2.3 6 组细胞 IGF-2R、Ras、PPARγ、PAK-1 表达水平比较 与对照组比较,B、C、D 组 IGF-2R、Ras、PPARγ、PAK-1表达水平差异均有统计学意义(均P<0.05);与A 组比较,C、D 组 IGF-2R、Ras、PPARγ、PAK-1 表达水平差异均有统计学意义(均P<0.05);与B组比较,C、D组IGF-2R、Ras表达水平差异均有统计学意义(均P<0.05);与C组比较,D组IGF-2R、PAK-1表达水平差异均有统计学意义(均P<0.05)。见图2、表3。

图2 IGF-2R、Ras、PPARγ、PAK-1蛋白电泳图(IGF-2R 为胰岛素样生长因子2受体;Ras为大鼠肉瘤病毒癌基因蛋白;PPARγ为过氧化物酶增殖激活受体γ;PAK-1为丝氨酸/苏氨酸蛋白激酶1;a:空白组;b:对照组;c:A 组;d:B 组;e:C 组;f:D 组)
3 讨论
结直肠癌是全世界最常见的癌症之一[7],肥胖与结肠腺瘤、结肠癌的发病率呈正相关[13],而结直肠癌合并糖尿病患者的病死率高于单纯肠癌患者[14]。慢性高胰岛素血症可能会刺激胰岛素受体(IR)信号途径,从而诱导乳腺癌和胰腺癌的肿瘤生长[15],还有研究表明随着胰岛素水平增高会增加患结肠癌的风险[16]。Lu等[17]发现胰岛素可以通过IR信号、磷脂酰肌醇-3-激酶/蛋白激酶B/糖原合成酶激酶-3(PI3K/AKT/GSK3β)通路以及基质金属蛋白酶-2的调节来促进结直肠癌HCT116细胞和诱导转移。
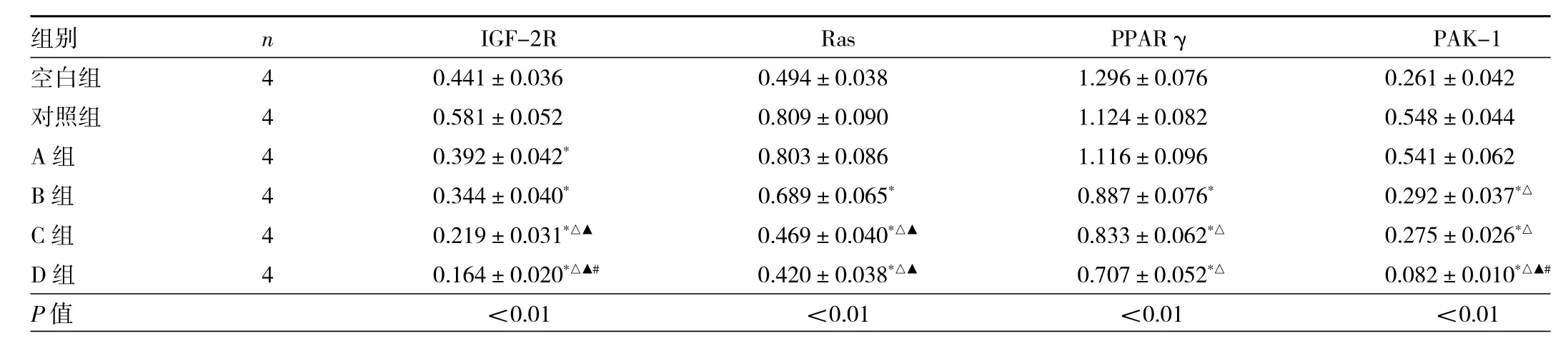
表3 6组细胞 IGF-2R、Ras、PPARγ、PAK-1表达水平比较
有荟萃分析提示大肠癌和腺瘤患者的ADPN水平明显低于对照组[18];同时有学者对17项相关研究作了荟萃分析,发现ADPN水平与结直肠癌的风险之间存在显著的负相关[7]。ADPN是一种重要的脂肪因子,最初发现其具有为胰岛素增敏和调控代谢功能[19],后来发现在炎症和细胞增殖等多种细胞周期中其均有所作用[4-6]。目前研究发现ADPN可通过多种途径发挥其抑癌作用,其中单磷酸腺苷活化蛋白激酶(AMPK)的激活起着核心作用。ADPN激活AMPK并抑制PI3K/AKT、哺乳动物雷帕霉素靶标(MTOR)、丝裂原活化激酶(MAPK)、Wnt-GSK3β以及 Janus激酶/信号转导和转录激活因子(JAK/STAT)通路,从而抑制肿瘤的生长[20-21]。
虽然已经有了一些相关的基础研究,但ADPN对结直肠癌细胞的作用仍然存在争议。Ogunwobi等[22]报道了全长和球形ADPN对HT-29结肠癌细胞增殖和细胞因子分泌的促进作用,认为ADPN对结肠癌细胞具有促增殖和促炎作用。2009年,Sugiyama等[23]揭示了ADPN受体在三种大肠癌细胞系HT29、LoVo和HCT116上的表达,还发现ADPN可通过激活AMPK下调mTOR通路,从而抑制肠癌细胞的生长。Kim等[24]研究显示ADPN在细胞周期的G1/S期抑制结肠癌细胞的增殖。Fenton等[25]报道ADPN处理MC-38小鼠结肠癌细胞不抑制胰岛素诱导的细胞增殖,但可通过降低STAT-3的磷酸化和活化来抑制IL-6诱导的细胞增殖。Habeeb等[26]发现ADPN在含糖培养基中抑制结肠癌细胞株的生长,而在无糖培养基中ADPN支持细胞存活,并增加ADPN受体的表达。此外,他们还发现ADPN通过增强自噬机制来支持细胞在缺糖状态下的存活。还有研究发现ADPN不参与肠癌细胞EMT转化,而是促进炎症性IL-6和IL-8细胞因子mRNA的水平增加,研究者认为ADPN可能会通过诱导结直肠细胞中的氧化应激和调节细胞因子的表达,负向调节细胞的存活和迁移。
笔者研究了重组ADPN在高糖高胰岛素环境下对小鼠结肠癌细胞株MCA38的抑制作用,发现在高糖高胰岛素条件下,ADPN可以显著抑制MCA38细胞的增殖,且浓度越高抑制作用越显著。笔者进一步分析加入ADPN后对胰岛素促增殖相关的IR信号、下游RASRaf-MAPK通路、细胞周期调节和迁移中关键蛋白的表达。IGF-2R属于I型跨膜糖蛋白,具有多种功能,其既参与IGF-2降解,又参与新合成的甘露糖-6-磷酸基化的溶酶体酶和活化生长抑制物TGFB1等,从而促进凋亡,抑制细胞生长,发挥抑癌作用[27]。在高糖高胰岛素条件下,加入ADPN后IGF-2R蛋白表达受到抑制,表明ADPN可通过IGF-2R发挥抑癌作用,它的作用机制可能在下游胞内信号通路传递,所以笔者进一步分析了下游RAS-Raf-MAPK通路中关键的Ras蛋白表达。Ras蛋白为膜结合型的GTP/GDP结合蛋白,它们是H-ras、K-ras、N-ras的编辑产物,Ras蛋白的活性状态对细胞的生长、分化、细胞骨架、蛋白质运输和分泌等都具有影响。抑制Ras蛋白活性能抑制依赖Ras蛋白的肿瘤细胞增殖,也能干扰血管生成[28]。在高糖高胰岛素条件下,加入ADPN后Ras蛋白表达受到抑制,可能通过影响RASRaf-MAPK通路抑制肿瘤生长。
此外笔者发现在高糖高胰岛素条件下,ADPN可以显著抑制MCA38细胞的迁移,笔者分析了与细胞迁徙显著相关的PAK-1和PPARγ蛋白。PAK-1激酶参与整合素和受体类型激酶下游的细胞内信号通路,在细胞骨架动态、细胞黏附、迁移、增殖中发挥重要作用[29]。肿瘤发生上皮-间质转化(EMT)后细胞表现为极性的丧失、黏附性降低、迁移能力增强,PPARγ是EMT的重要调节因子。研究提示PPARγ激活后,能通过调节E-钙黏蛋白、Smad复合体和肿瘤微环境等影响肿瘤EMT的发生和发展[30]。本研究发现高糖高胰岛素条件下,加入ADPN可以抑制PAK-1和PPARγ的表达。
综上所述,笔者发现在高糖高胰岛素环境中,ADPN作用于小鼠结肠癌细胞株MCA38,可能通过抑制RASRaf-MAPK信号通路和PAK-1和PPARγ迁移相关蛋白来抑制细胞增殖和迁移。虽然ADPN在癌症中作为分子介质的作用尚未完全确定,但本研究提示ADPN在胰岛素通路和结肠肿瘤迁徙中发挥了关键的作用,但仍需要进一步的研究来阐明ADPN与结直肠癌相关的潜在分子机制。

