心肌声学造影对急性心肌梗死急诊介入术后心肌灌注及预后评估*
陈亚南, 郭秋红, 冯雁△, 秦雷
开封市中心医院 1心内科, 2超声室(河南开封 475000)
急性心肌梗死(AMI)是威胁人类健康的头号杀手,高发病率、高病死率及发病逐渐年轻化趋势使其在心血管领域一直备受关注。近年来随着全国胸痛中心雨后春笋般的涌现,及时开通梗死相关血管使得冠脉血流恢复成为标配,可是即便如此仍有少数患者心肌细胞未得到有效的再灌注,这就是所谓的“无复流”或者“慢血流”现象,所以冠脉血流并不能准确反映心肌水平灌注。“无复流”或者“慢血流”可能导致左心功能受损,引发各种并发症甚至危及患者生命。这就急切需要新的、方便、快捷的检查技术来评估患者心肌灌注水平,此时心肌声学造影(MCE)应运而生。当前国内关于应用MCE评估AMI急诊介入术后心肌灌注水平以及预后风险评估的报道几乎没有,而此文就是通过新技术MCE来评估AMI患者急诊介入术后微循环灌注水平并且其对AMI术后不良心血管事件(MACE)的预测价值。
1 资料与方法
1.1 一般资料 选取2017年6月至2019年3月经我院胸痛中心诊断为AMI,并且行急诊冠脉介入手术患者108例。(1)纳入标准:AMI诊断标准依据2018 年AMI第四次通用定义[1]。急诊介入手术包括以下方面:冠脉支架植入,球囊扩张以及冠脉痉挛,术后梗死相关血管血流均为TIMI 3级。多支血管病变定义:除了罪犯血管之外,至少1支冠脉血管狭窄程度>50%。梗死相关血管判断依据心电图及冠脉造影结果。应用TIMI分级(0~3级)来判断梗死相关血管介入前、后冠脉血流情况。(2)排除标准:心源性休克、心力衰竭、心脏瓣膜病、妊娠、哺乳期妇女、恶性肿瘤、血液疾病、经胸声窗模糊的患者。
108例AMI患者中植入支架95例(87.9%),13例未植入支架,住院期间均接受AMI标准化治疗[2]。标准化治疗包括:阿斯匹林肠溶片(300 mg嚼服后100 mg 1次/d;拜耳医药)、P2Y12受体拮抗剂[氯吡格雷(600 mg负荷量,后75 mg 1次/d;赛诺菲药业)/替格瑞洛片(180 mg负荷量后90 mg 2次/d;阿斯利康)]、美托洛尔缓释片(无禁忌证情况下:23.75~95 mg 1次/d,根据心率调整用量使心率维持在60~80次/min左右;阿斯利康)、他汀[瑞舒伐他汀10~20 mg 1次/d(阿斯利康),阿托伐他汀 20~40 mg 1次/d(辉瑞制药)使低密度脂蛋白(LDL)<1.8 mmol/L,或者至少使LDL降低基线50%左右],所有患者术后均给予替罗非班(武汉远大制药)0.15 μg/(kg·min)至24 h停用。
1.2 患者资料收集 (1)收集研究对象一般资料:年龄、性别、是否吸烟、既往是否合并高血压、糖尿病、高脂血症、心肌梗死病史,≥3个电话号码。(2)记录患者心电图ST段是否抬高、CK-MB峰值、发病至再灌注时间、梗死部位(前壁、非前壁)、是否为多支血管病变、PCI术前TIMI血流分级。(3)随访服药情况:出院后1年随访患者是否规律服用拜阿司匹林、替格瑞洛或者氯吡格雷、他汀等药物。
1.3 超声仪器及参数调整 应用荷兰PHILIPS IE33彩色超声诊断仪,选择S 5-1超声探头,频率1.0~3.0 MHZ,设置深度为15~17 cm,帧频调整至70~80帧/s。
1.4 心脏超声图像收集 108例AMI患者入院后3~5 d行心脏超声检查。检查时取左侧卧位并连接同步心电监护。首先采集常规超声切面图像存储,后嘱其屏住呼吸,依次采集左室长轴四腔、三腔、两腔心动态图像储存。一定保证采集图像清晰。
传统超声图像收集完毕后进行心肌声学造影。造影剂选用上海博莱六氟化硫微泡粉针,使其溶于5 mL生理盐水,通过外周静脉弹丸式注射2~3 mL后静推5 mL生理盐水。发放高能量脉冲[机械指数(MI=0.57)]破坏微泡,随之超声仪器自动转为极低机械指数(MI=0.07)造影状态,此时观察各个节段心肌造影剂充盈情况,心肌细胞造影剂再充盈的整个过程以原始动态图像形式储存[3-4]。图像采集完毕,上传至Xcelera 图像处理系统(内置QLAB 6.0系统)进行脱机数据处理。
1.5 超声指标处理和分析 应用Q-Lab 6.0软件脱机分析图像,测量以下指标:左室舒张期内径(LVIDd)、左室收缩末期容量(LVESV)、左室舒张末期容量(LVEDV)、二尖瓣E峰速度(MVE)、二尖瓣A峰速度(MVA)、左室质量指数(Lvmassi)、室壁运动评分指数(WMSI)。应用Simpson法计算左室射血分数(LVEF)。依据美国超声心动图协会规定[5],把左室长轴四腔,三腔,二腔心切面图像共分为16段心肌。根据室壁运动情况对每个节段心肌进行评分。标准如下:1分:正常室壁运动;2分:室壁运动减弱;3分:室壁运动消失;4分:出现室壁矛盾运动,WMSI=各节段分数之和/总段数[4-5]。造影后依据每段心肌造影剂充盈程度进行评分:1分:心肌组织均匀、明显灌注;2分:心肌组织轻度或者不均匀灌注;3分心肌组织灌注缺损。造影剂评分指数(CSI)=每段分数之和/总段数[6]。
1.6 出院随访 所有患者出院后1年电话随访,根据随访结果判断是否发生MACE。MACE主要包括:全因性死亡,心肌再梗死,心力衰竭,恶性心律失常,反复心绞痛或者因心脏症状而住院。根据随访结果分为MACE组和非MACE组。
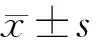
2 结果
对108例患者1年后电话随访,26例患者发生MACE(1例院内死亡,3例院外死亡,4例再梗死,5例心力衰竭,3例心律失常,10例反复心绞痛),82例未发生MACE。108例患者共1 728个心肌节段,其中可利用心肌节段为1 690个(97.8%)。具体结果如下。
2.1 患者基本情况 两组患者在性别、既往病史(高血压、糖尿病、高脂血症、心肌梗死史)、是否吸烟、ST段抬高型心肌梗死(STEMI)、疼痛至球囊开通时间、术前TIMI分级以及随访药物应用方面比较差异无统计学意义;而在年龄、是否存在多支血管病变、肌酸激酶同工酶(CK-MB)峰值、是否为前壁心肌梗死等方面差异有统计学意义。见表1。

表1 两组患者一般资料 例(%)
2.2 心脏超声指标结果 两组患者各指标比较:LVESV(P=0.021)、LVEF (P=0.034)、WMSI(P=0.018)、CSI (P=0.010)等均差异有统计学意义;而在LVEDV、LVIDd、MVE、MVA、Lvmassi等方面差异无统计学意义(P>0.05)。见表2。

表2 两组患者超声学指标
2.3 多因素logistic回归分析结果 对年龄、CK-MB峰值、是否前壁心肌梗死、多支血管病变、LVEF、LVESV、WMSI、CSI等变量行多因素logistic回归,结果显示CSI是AMI急诊介入术后MACE的独立危险因素HR:2.5(1.33~2.7),P=0.021。见表3。

表3 Logistic回归分析各个变量和终点事件的关系
2.4 对AMI急诊介入术后MACE的预测价值 ROC曲线显示CSI、WMSI对AMI急诊介入术后MACE的预测价值AUC分别为0.841、0.705(P=0.041)。对CSI的ROC曲线分析显示:cutoff值为1.58,此cutoff值敏感度为88%,特异度为74%。见图1。

注:CSI、WMSI曲线下面积(AUC)分别为:0.841、0.705(P=0.041)图1 ROC曲线
2.5 对CSI≥1.58及<1.58的两组患者行Kaplan-Meier分析 结果显示CSI≥1.58的患者1年后MACE发生率为45%,而CSI<1.58的患者1年后MACE事件发生率为9%,差异有统计学意义(P=0.001)。见图2。

图2 cutoff值对MACE的预测价值比较Kaplan-Meier分析
2.6 CSI和梗死部位的关系 前壁心肌梗死患者患者更容易出现MACE:2.7(0.54~4.90)P=0.034,相关研究显示前壁心肌梗死CSI较非前壁高[(1.61±0.28)vs. (1.12±0.14),P=0.024]。
2.7 两组患者CSI值 STEMI和NSTEMI两组患者CSI值分别为1.67±0.29, 1.60±0.23,差异无统计学意义(P=0.57)。见图3。

图3 STEMI、NSTEMI患者CSI比较
2.8 安全性评估 108例患者应用六氟化硫微泡粉针静脉注射,在检查过程中无一例患者出现不良反应而终止检查。
3 讨论
再灌注治疗虽然及时开通梗死相关血管,尽管TIMI血流达到3级,但是心肌水平灌注异常,这种无复流现象可归因于心肌微循环异常所致,无复流导致心肌细胞严重受损,并且和左心功能低下、高病死率有直接关系。所以在临床上迫切需要一个可以用来评估心肌水平灌注的标志物。当前临床上常用TIMI心肌灌注分级(TMPG)、心肌灌注呈色分级(MBG)、校正的TIMI帧频计数(CTFC)心脏PET-CT等指标反映心肌灌注水平[7-9],但是上述检查大部分为侵入性检查,亦或价格异常昂贵,不能普遍应用于所有患者。本研究采用MCE评估心肌微循环灌注,该方法简单便捷,价格适中,非侵入性、床旁即可操作。
2015年Abdelmoneim等[10]报道了37例STEMI患者在急诊术后24 h内行MCE检查,结果提出定性、定量指标能预测STEMI不良的心血管事件,但是研究入组患者偏少,且在急诊术后24 h内对患者行MCE检查,研究表明24 h内心肌充血、血流动力学因素如冠脉痉挛、心肌细胞水肿及顿抑等因素均影响心肌灌注的结果,进一步会低估研究结果的准确性, 故Ito[11]建议AMI 48 h后行MCE检查,而我们研究MCE检查时间一般为入院后3~5 d。
早期应用MCE检查评估心肌灌注对象多为STEMI,对NSTEMI研究偏少,原因有二:首先,初期急诊PCI对象多为STEMI,NSTEMI早期极少行急诊PCI治疗。其次,考虑到NSTEMI患者仅少部分为单支闭塞病变,而大部分患者为多支血管病变(非闭塞病变)。综上所述,故对NSTEMI患者关于心肌灌注研究偏少。然而随着2014、2015年ESC/ACC/AHA等指南的不断更新[12-13],NSTEMI“缺血指导介入治疗策略”实施,中国胸痛中心NSTEMI急诊PCI术不断开展,研究对象日渐增多。Korosoglou等[14]的研究表明:MCE检查下NSTEMI患者微血管完整性破坏,同样导致PCI术后心肌灌注明显受损。本研究结果显示:STEMI和NSTEMI两组患者CSI值分别为1.67±0.29、1.60±0.23,差异无统计学意义(P=0.57),故纳入NSTEMI患者并不影响研究结果,本研究对象并未区分STEMI或是NSTEMI,为所有AMI介入后患者,研究人群进一步扩大。
Tomaszuk-Kazberuk 等[15]2010年报道初次ST段抬高型心梗患者100例行MCE检查,根据MCE结果分为两组,灌注良好组以及灌注缺失组,随访6个月后观察两组患者的预后情况,研究结果同样指出灌注良好组不良事件较灌注缺失组发生率低,且差异有统计学意义。但是关于心肌灌注指标处理较为宽泛,不能很准确反映患者MCE结果。而本研究对所有AMI患者而非初次ST段抬高型心梗患者,同时采用较为准确的定性评分法,随访时间较之延长,研究结果有更高的准确性。
该研究发现WMSI对MACE同样有较高的预测价值,心肌灌注结果和室壁运动指数对MACE发生有较高一致性,但是极少数结果显示不一致性(WMSI高却有正常心肌灌注),究其原因可能是正常心肌灌注节段由于临近异常收缩节段所致的牵拉作用导致WMSI受影响,另外一种解释就是坏死心肌细胞非均质性分布,残存心肌细胞灌注可能性[10]。
ROC曲线显示CSI较WMSI对AMI急诊介入术后MACE事件的预测价值高,P=0.041。并且对CSI ROC曲线分析显示cutoff值为1.58,此cutoff值有较高的敏感度(88%)和特异度(74%);利用该cutoff行Kaplan-Meier 曲线分析,发现CSI≥1.58较CSI<1.58的AMI患者1年随访MACE发生率高(45%vs. 9%,P=0.001),从而得出CSI可以对AMI急诊介入术后患者进行早期危险分层,及早识别高危患者,然而国内并无此方面的报道。
研究显示前壁心肌梗死患者患者更容易出现MACE,同时较非前壁心肌梗死CSI高[(1.61±0.28)vs. (1.12±0.14)(P=0.024)],提示前壁心肌梗死有较高的心肌灌注缺损,和临床事件发生更吻合,由于前壁心肌梗死往往伴有较大面积的心肌坏死以及坏死延展,故更容易出现心脏室壁瘤、附壁血栓、恶性心律失常、心脏破裂、心力衰竭等并发症。
近年来国内关于MCE研究较少,大多为动物实验[16-17],样本量偏小,且多数为定性评价;当然国内亦有少量临床研究如:MCE对X综合征的定量评价[18];MCE对冠心病心肌缺血的定性评价、对NSTEMI患者PCI患者术后心功能的评估[19-20]。但是截止目前国内并未报道MCE对AMI患者微循环以及预后价值的研究。
本研究表明,(1)MCE可以评估AMI急诊介入术后心肌灌注水平;(2)前壁心肌梗死不良的MACE事件和更多的心肌灌注缺损有关系;(3)CSI可以做为AMI患者发生MACE的独立危险因素;(4)CSI≥1.58的AMI患者随访1年后发生MACE事件概率更高。
本研究存在的局限性:(1)本研究样本量偏小,单中心研究,对患者随访时间较短。(2)本研究MCE结果为定性研究,未开展精确的定量研究。(3)患者出院前及1年随访未行MCE动态评估。(4)本研究对象仅为AMI急诊介入术后,最终研究结果能否扩展到AMI所有患者甚至整个冠心病群体,有待于进一步研究。(5)本研究未联合血液学指标,如B型钠尿肽等;且未纳入新的超声技术指标:如二维超声斑点追踪技术:应变以及应变率等,多个指标的联合可能对AMI的预后价值更高。
综上所述,MCE能评估AMI急诊介入术后患者微循环灌注水平; CSI可以预测AMI患者急诊介入术后MACE,并对该类人群进行危险分层,尽早识别高危患者,指导临床,规避不良事件出现。

