AGEs-RAGE/NF-κB途径对慢性间歇低氧小鼠脏器的影响及大株红景天对其脏器的保护作用*
成俊芬, 戴彩同, 吴格怡, 黎雄斌, 林永联, 梁一波, 陈鸣娣
湛江市第二人民医院 1呼吸内科, 3科教科, 4重症监护室(广东湛江 524000); 2广东医科大学研究生院(广东湛江 524000)
阻塞性睡眠呼吸暂停综合征(OSAS)是临床上常见的一种睡眠呼吸障碍性疾病,男性成人患病率为3%~7%,女性为2%~5%[1]。其主要特点是夜间睡眠时频繁的呼吸暂停和通气不足,导致频发血氧饱和度下降,突出的临床表现是睡眠打鼾伴反复憋醒,白天精神不振伴嗜睡等,是一种发病率高并可严重影响生活并危及生命的疾病。中华医学会睡眠呼吸障碍学组已在2011版中的阻塞性睡眠呼吸暂停综合征的诊治指南[2]中提出:OSAS 或可引起或加重多脏器、多系统疾病的发展,如高血压、冠心病、心律失常、2型糖尿病、脑血栓、脑出血、痴呆症、精神异常、遗尿、肾功能损害等。晚期糖基化终末产物(advanced glycation end products, AGEs) 是近年研究的一个热点,它是蛋白质和脂类与还原糖在非酶糖基化后生成的多种不同物质的统称。研究[3]发现,衰老、高血糖、肾功能衰竭、氧化应激及炎性反应等因素可促进AGEs的形成。近年来陆续有研究发现,在OSAS患者体内亦存在有AGEs水平升高的现象[4],但在OSAS患者中血清AGEs的增加是否与OSAS的高心血管风险有关仍有待研究。红景天是多年生草本植物,常生长在高原地区,其全草均可入药,在其基础上提取的大株红景天注射液现已在临床上被广泛应用,具有活血化瘀、清热解毒等功效。梁光彬等[5]在研究观察60例应用红景天胶囊治疗OSAS患者,发现患者心功能指标、睡眠呼吸暂停低通气指数以及肥胖指数等均有不同程度的改善,提示红景天胶囊可以改善OSAS患者的心功能,但通过何种机制改善症状则国内外均未见报道。2015年7月至2017年12月本研究将通过建立慢性间歇低氧小鼠模型模拟人体OSAS疾病,探讨AGEs-糖基化终末产物受体(advanced glycosylation end product-specific receptor,RAGE)/ 核因子-κB(NF-κB)信号通路与OSAS多脏器损害的关系,为OSAS及其并发症的防治提供更多的方向。在上述研究的同时,进一步了解大株红景天对OSAS脏器的作用并探讨其中的机制,为其在临床上用于治疗OSAS多脏器损害提供更多可靠的依据,亦能为我国中医药在临床上的应用提供更多的经验及循证依据,对进一步开发大株红景天的临床应用前景及弘扬我国优秀的中医药文化有着重要的意义。
1 材料与方法
1.1 实验动物与材料 清洁级BALB/c小鼠53只,雄性,体重(18±2)g,购买于广东省医学实验动物中心[许可证号SCXK(粤)2013-0002]。小鼠IL-6 ELISA 试剂盒、小鼠AGEs ELISA 试剂盒和小鼠TNF-α ELISA试剂盒购于北京诚林生物科技有限公司;兔抗小鼠 RAGE 抗体购于美国 SANTACRUZ 公司;兔抗小鼠 NF-κB 抗体购于美国 SIGMA 公司;兔抗小鼠β-actin 抗体购于美国SANTACRUZ 公司。
1.2 动物建模与分组 将53只雄性BALB/c小鼠随机分为正常对照组(对照组)15只和间歇低氧模型组(模型组)38只。对照组小鼠在普通环境下常规喂养,模型组小鼠放置于间歇低氧舱内(图1),每天间歇低氧 8 h,共 6 周,建立慢性间歇性低氧小鼠模型以模拟人体OSAS。

图1 间歇低氧舱示意图
增加N2使O2含量降低,以低氧-再氧合为一个循环,循环总时间为8 min,首先向低氧舱内输入浓度为99%的氮气(约60 s),舱内氧浓度逐渐降至8.5%,在此浓度维持240 s后,通过排除N2和输入空气(约60 s)使动物舱内O2浓度逐渐升至21%,并持续120 s。实验周期为6周,每周7 d,每天间歇低氧时间为8 h(09:00~17:00)。
第6周时随机选取模型组及对照组小鼠各5只,抽取心脏动脉血行血气分析检测造模是否成功。造模成功后,将模型组随机分A、B、C三组各11只,B组终止间歇低氧条件,恢复普通环境喂养,模拟改善通气治疗4周,A及C组继续予每天8 h间歇低氧,在上述条件下,C组小鼠每天予腹腔注射治疗量大株红景天注射液[剂量:52 mg/(kg·d) ]4周,B、C组及对照组同时予同体积的生理盐水腹腔注射4周。即造模成功后,将模型组随机分为3组:A组(间歇低氧+生理盐水)、B组(复氧+生理盐水)、C组(间歇低氧+大株红景天)。对照组及A、B、C各组在各自不同条件下继续喂养4周。
1.3 取材与检测方法
1.3.1 取材 各组均于10周后处死,麻醉小鼠后抽取血液置于EP管内,4℃冰箱内静置4 h后离心10 min,提取上清液于-80℃保存,待用ELISA方法检测白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)及AGEs水平。同时,心脏采血后立即予断头处死,解剖小鼠大脑、心脏组织,将部分小鼠心脏组织及左侧大脑置于液氮中迅速冻存,待用Western Blot检测RAGE、NF-κB蛋白的表达;取小鼠右侧大脑及剩余心脏组织浸泡于10%中性甲醛溶液固定,待行病理组织HE染色。
1.3.2 ELISA 稀释标准品,在待测样品孔中加入样品稀释液40 μL,再加待测样品10 μL,用封板膜封板后置于恒温箱内反应1 h,洗板,加入辣根过氧化物酶标记的检测抗体,封膜后再温育1 h,反应,显色后加入终止液,450 nm波长测量吸光度(OD值),以标准品浓度绘制标准曲线,计算样品IL-6、TNF-α、AGEs的含量。
1.3.3 Western blot 将-80℃取出的组织解冻、去除残余血液,用液氮将其研磨成粉末,加入适量含PMSF的细胞裂解液,离心后提取出组织蛋白。用BCA法蛋白测定,计算出各样品蛋白的实际浓度。 配置10%分离胶及5%浓缩胶,插上梳子,制成SDS-PDGE凝胶,加入1×电泳缓冲液,将处理好的蛋白和MARK依序加样,恒压80 V电泳30 min,将样品压成窄带后调整为120 V电泳90 min,转膜,洗膜、封闭,剪下目的蛋白及内参条带置于稀释后的一抗中(RAGE抗体:1∶500;NF-κB抗体:1∶500;β-actin抗体:1∶1 000)4℃摇床孵育过夜,复温,洗膜,将膜放置于辣根过氧化物酶标记的羊抗兔IgG 二抗中(1∶1 000)室温下慢摇孵育1 h,洗膜,配置ECL发光液,用凝胶成像系统曝光并分析结果。
1.3.4 HE病理学检查 将浸泡在10%中性甲醛溶液中的组织制成石蜡切片,厚度为4 μm。经脱蜡、水化、苏木精染色、分化水液、氨水返蓝、伊红复染、脱水、透明、封皮后,置于光学显微镜中观察各组心脏组织及大脑组织的病理变化。
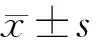
2 结果
2.1 慢性间歇低氧小鼠造模情况 因抽取小鼠左心室动脉血操作较精细,小鼠耐受性亦较低,容易在操作过程中死亡,在随机抽取的对照组及模型组各5只小鼠中,有2只对照组小鼠及1只模型组小鼠在操作过程中死亡,未能抽及动脉血,而在剩余的小鼠中,其动脉血气分析提示,模型组小鼠动脉血氧饱和度较对照组小鼠明显降低,说明慢性间歇低氧小鼠的模型是成功的。见表1。

表1 对照组与模型组小鼠血气分析结果
2.2 各组小鼠中血清AGEs水平的表达情况 对照组小鼠血清AGEs水平为(432.7±92.99) ng/L,而A组为(527.5±97.53) ng/L,可见与对照组相比,A组小鼠血清AGEs水平明显升高,差异有统计学意义(P=0.031 7);而C组及B组的小鼠血清AGEs水平分别为(524.4±69.73)ng/L和(481.7±63.43)ng/L,与A组的相比,均有下降的趋势,但差异无统计学意义(P>0.05);与对照组相比,C组仍明显升高,且差异有统计学意义(P=0.044 8)。见图2。
注:*与对照组比较P<0.05图2 各组小鼠血清AGEs水平的比较
2.3 各组小鼠中血清IL-6水平的表达情况 A组小鼠血清IL-6水平为(110.3±15.10)pg/mL,较对照组小鼠的(84.85±17.41)pg/mL比较明显升高,差异有统计学意义(P=0.006 7);B组及C组小鼠的血清IL-6水平分别为(101.8±17.35) pg/mL和(92.43±19.04) pg/mL,均较对照组升高,但仅B组小鼠与对照组相比差异有统计学意义(P=0.037 8);而与A组相比,C组血清IL-6水平有所降低,且差异有统计学意义(P=0.032 8)。见图3。

注:与对照组比较,*P<0.05,**P<0.01;△与A组相比P<0.05图3 各组小鼠血清IL-6水平的比较
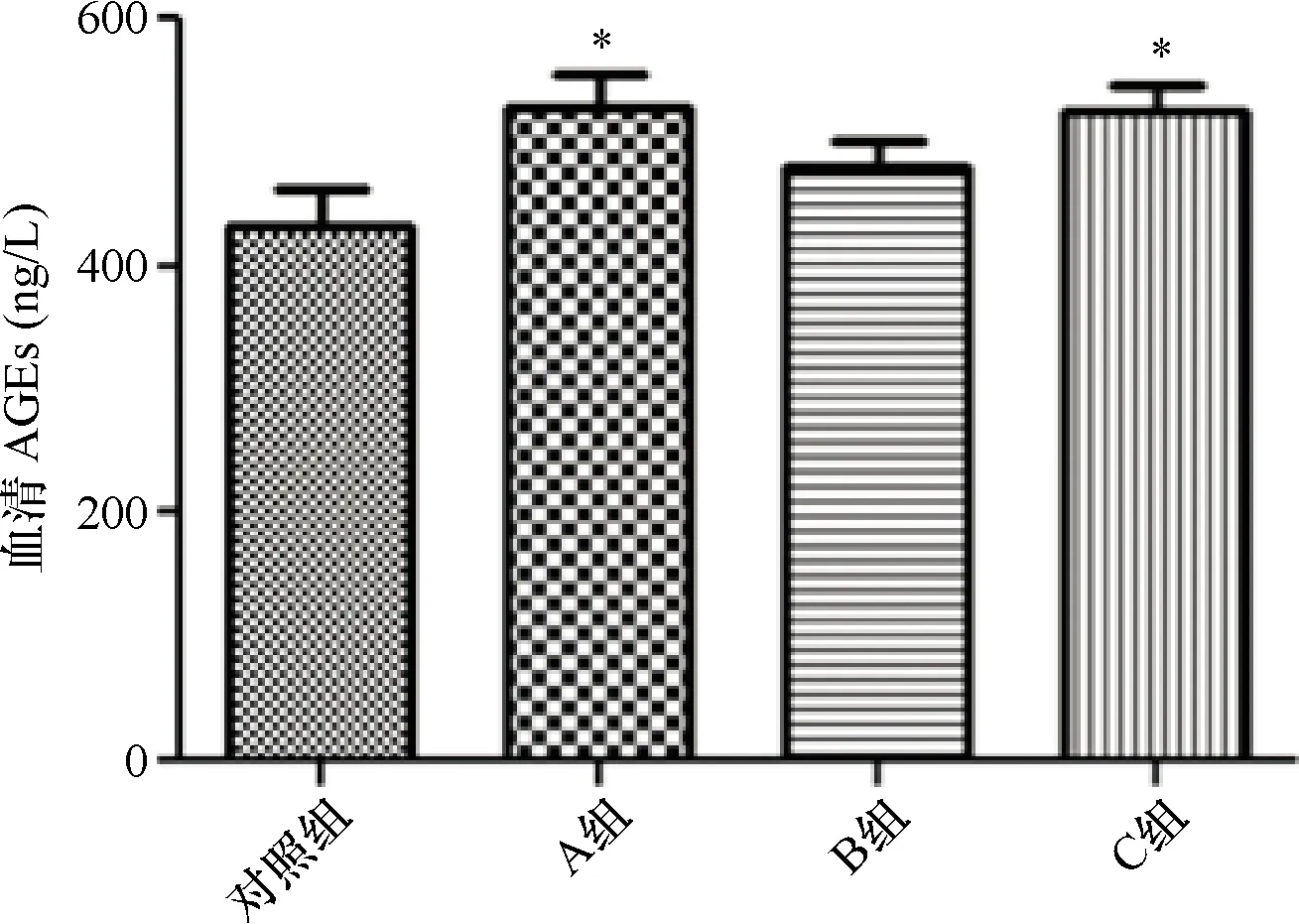
2.4 小鼠血清TNF-α水平的表达 对照组小鼠血清TNF-α水平为(445.8±89.50) ng/L,A组小鼠为(584.5±76.36) ng/L,A组较对照组小鼠明显升高,差异有统计学意义(P=0.002 8);B组及C组小鼠血清TNF-α水平分别为(484.1±118.4)ng/L和(502.8±100.0)ng/L,均较A组明显下降,且差异均有统计学意义(P=0.041 7、0.048 8)。见图4。
注:*与对照组比较P<0.01;△与A组比较P<0.05图4 各组小鼠血清TNF-α水平的比较
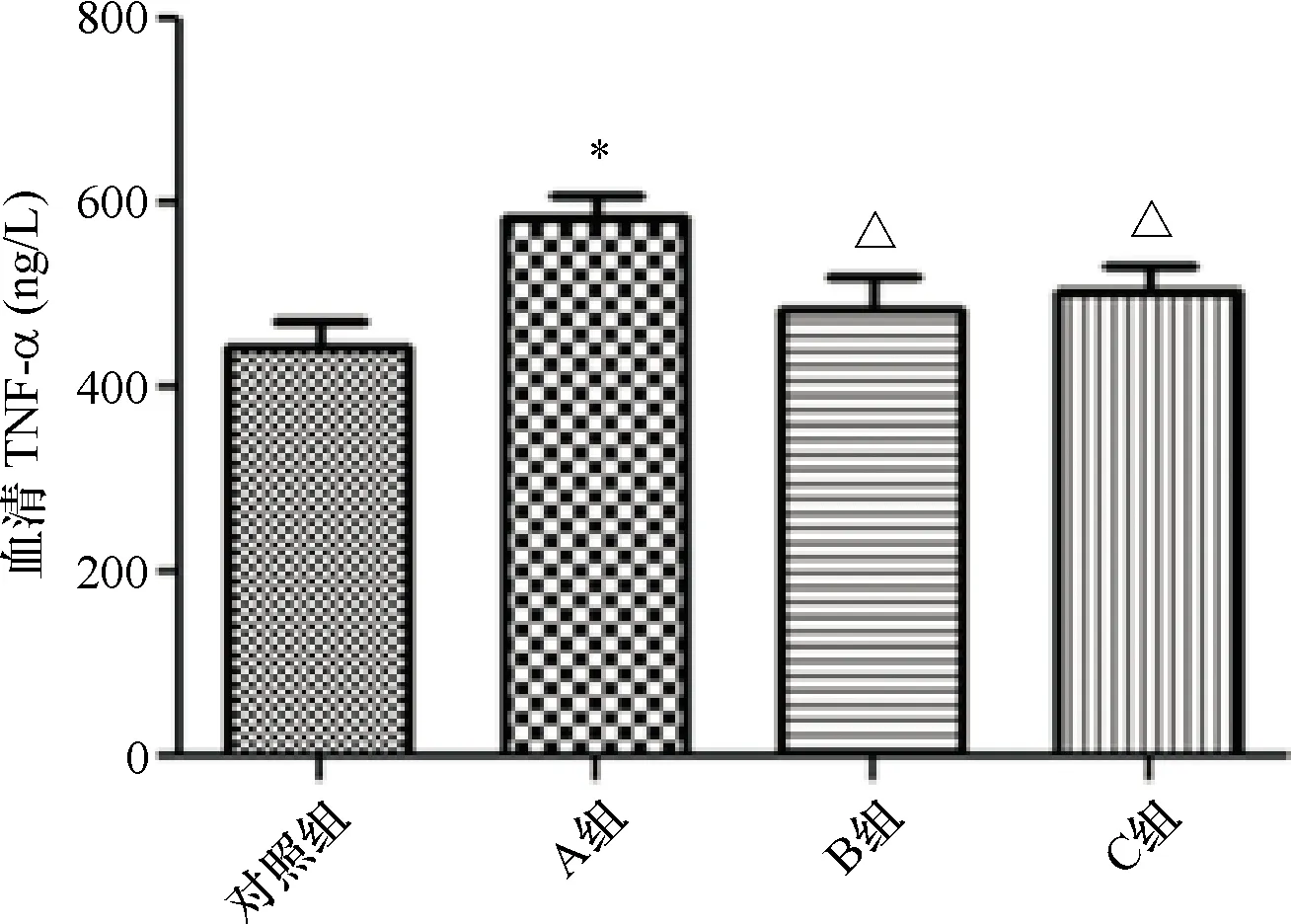
2.5 心脏组织HE染色 对照组小鼠心肌组织结构清晰完整、界限清楚、排列紧密;而A组小鼠心肌组织排列紊乱,结构、纹理不清,部分肌细胞核固缩深染。B组小鼠心肌结构较A组清晰,核固缩深染现象较A组减少,而C组小鼠心肌结构较清楚,排列亦较紧密。见图5。

注:A:对照组;B:A组;C:B组;D:C组图5 心脏组织HE染色图片(400×)
2.6 大脑组织HE染色 正常对照组小鼠脑组织细胞数量较多,胞质均质红染,核大且圆,核仁清晰,血管较多且粗大,神经纤维纵横交错致密;A组脑组织细胞数量减少较明显,排列紊乱、稀疏,部分细胞核固缩深染,呈紫蓝色梭形,绝大多数细胞有核仁碎裂现象,血管较少且细,神经纤维较对照组稀疏。B组及C组脑组织细胞较A组有所增多,排列较A组紧密,核固缩深染现象较A组有所减轻。而与B组相比,C组的神经纤维排列更紧密,余形态变化差别不明显。 见图6。
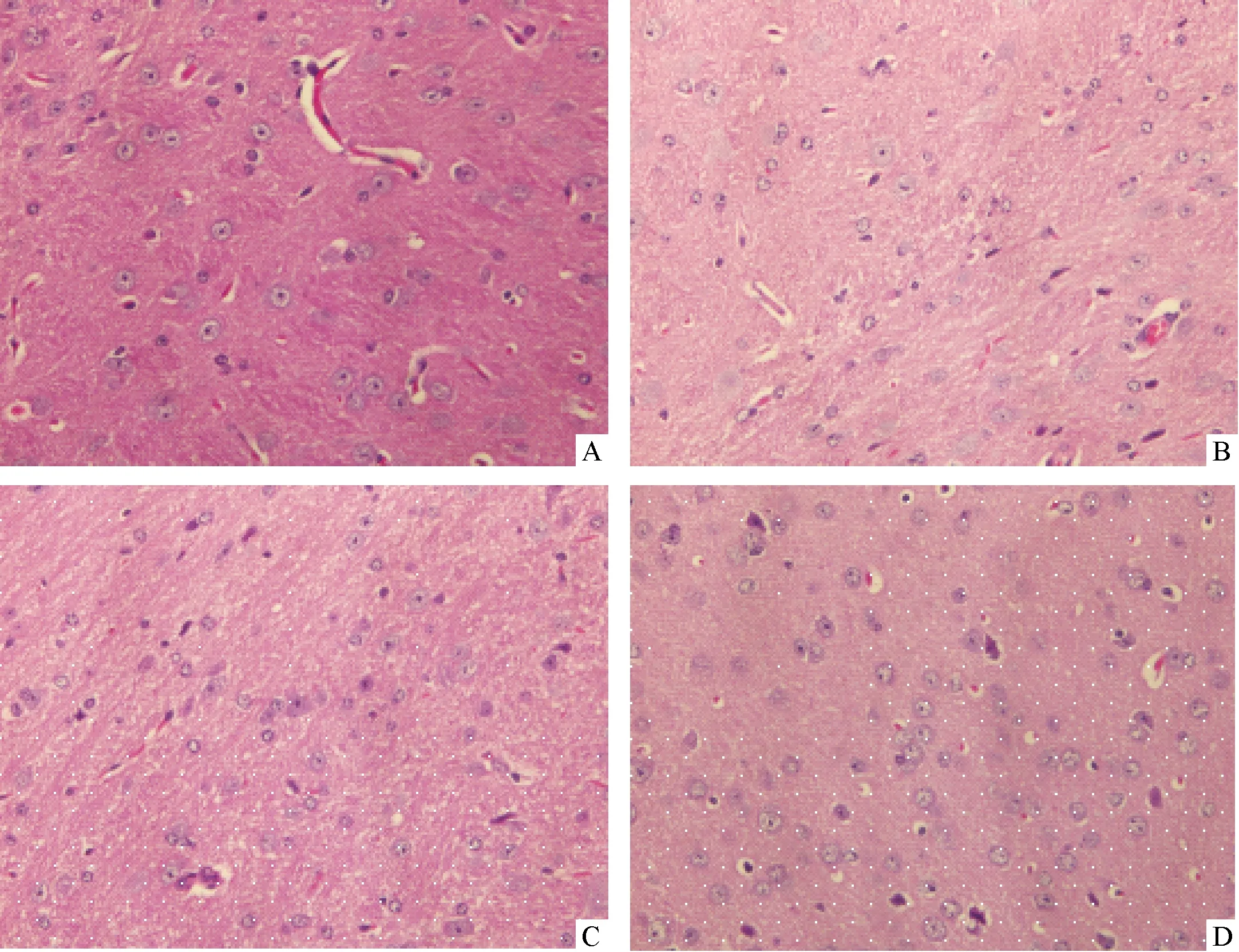
注:A:对照组;B:A组;C:B组;D:C组图6 大脑组织HE染色图片(400×)
2.7 RAGE及NF-κB蛋白在小鼠心脏组织中的表达 对照组小鼠心脏组织中RAGE及NF-κB的表达最弱,A组小鼠的NF-κB的表达在各组中表达最强,其RAGE蛋白表达比对照组及B组强,而与C组相仿;C组小鼠RAGE及NF-κB均较对照组及B组表达增多。见表2和图7、8。
对照组中小鼠心脏组织中RAGE及NF-κB在各组的表达中是最弱的,A组小鼠心脏组织中的RAGE及NF-κB蛋白均表达最强,比对照组明显增多,且差异均有统计学意义(P<0.05),而A组与B组、C组相比,其表达则差异无统计学意义(P>0.05);C组的RAGE及NF-κB的表达均较B组有所增多,但差异无统计学意义(P>0.05)。见表2和图7、8。

表2 归一化处理后的各组小鼠心脏组织RAGE及NF-κB蛋白灰度值
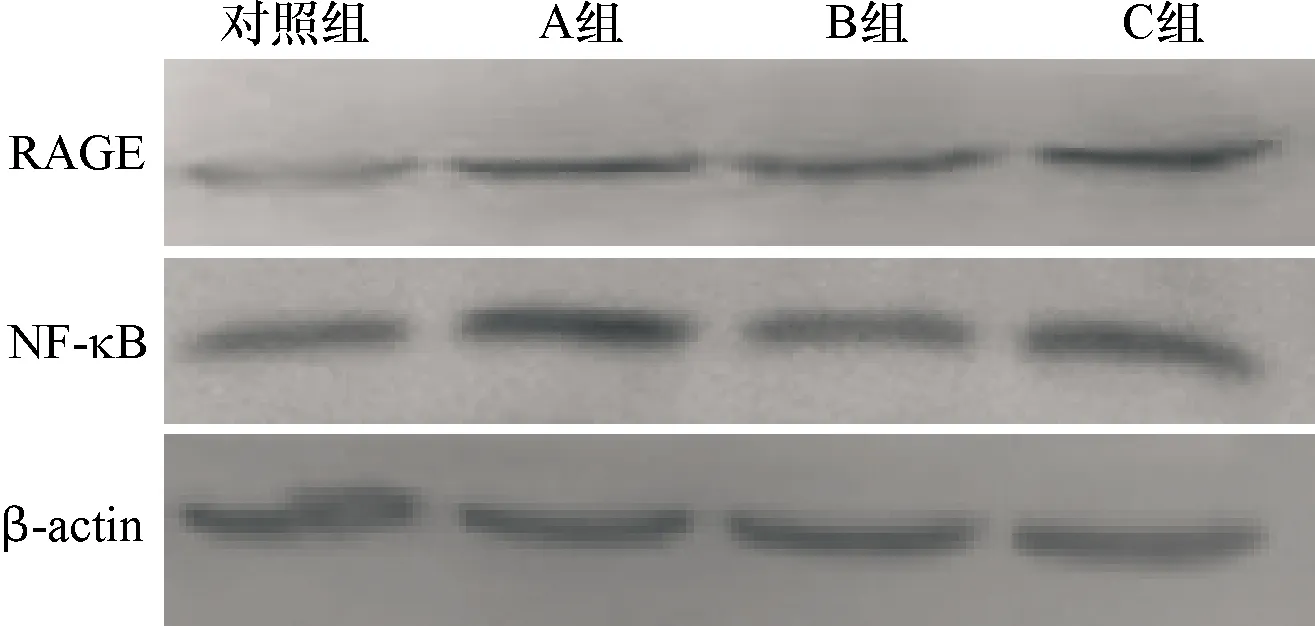
图7 RAGE及NF-κB在各组小鼠心脏组织的表达情况
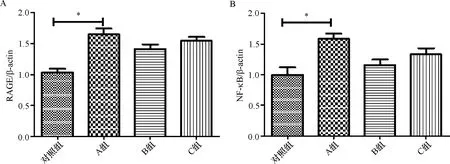
注:A:RAGE;B:NF-κB;*P<0.05图8 RAGE及NF-κB蛋白在各组小鼠心脏组织中表达的统计结果
2.8 RAGE及NF-κB蛋白在小鼠大脑组织中的表达 在各组小鼠的大脑组织中,对照组小鼠RAGE及NF-κB的表达均较少,而A组的RAGE及NF-κB蛋白的表达则最强,与对照组相比差异均有统计学意义(PRAGE<0.05,PNF-κB<0.01);与A组相比,C组的RAGE表达稍有减少,而NF-κB的表达则较其有更为明显的下降(P<0.05)。C组与B组相比,两种蛋白的表达差异无统计学意义(P>0.05)。见表3和图9、10。

表3 归一化处理后的各组小鼠大脑组织中RAGE及NF-κB蛋白灰度值
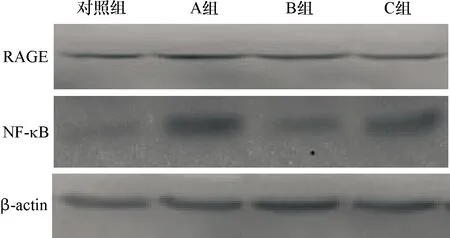
图9 RAGE及NF-κB在各组小鼠大脑组织中的表达情况
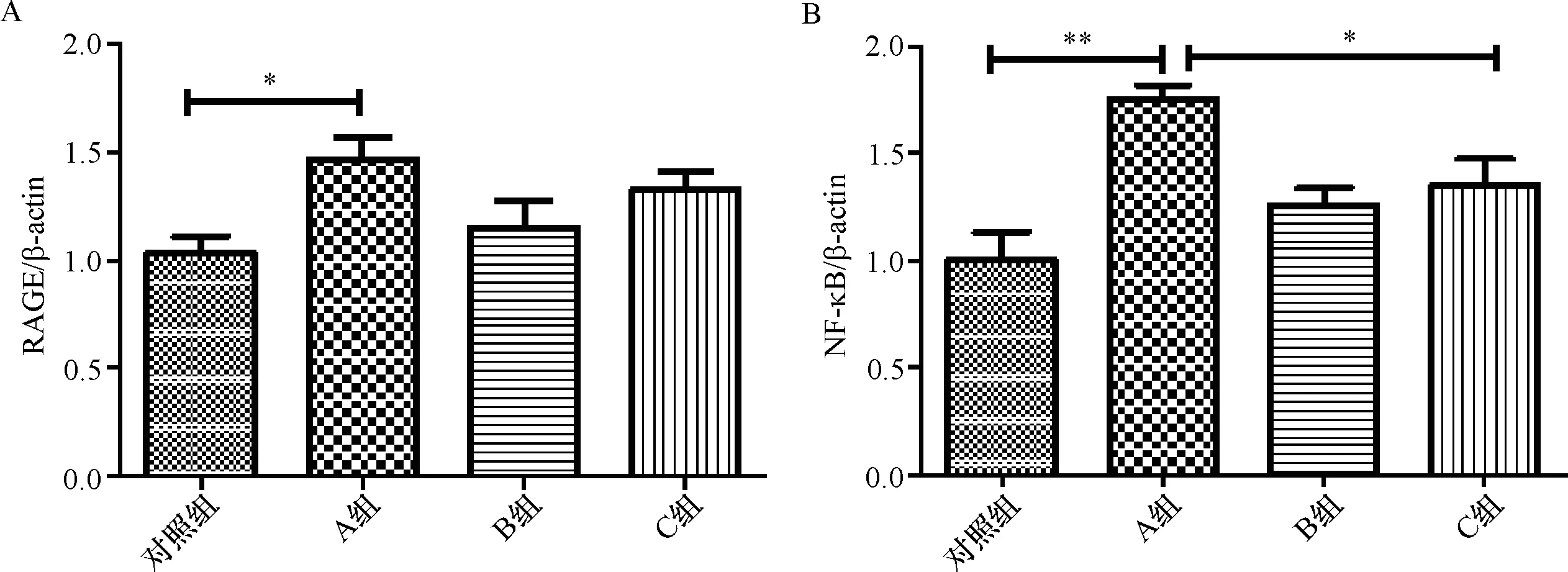
注:A:RAGE;B:NF-κB;*P<0.05;**P<0.01图10 各组小鼠大脑组织中RAGE及NF-κB蛋白表达的统计结果
3 讨论
3.1 小鼠间歇缺氧模型的建立 OSAS动物模型的构建中,主要以啮齿类动物为实验对象[6],如大鼠、小鼠等小动物常用于构建低氧模型,犬、猪、兔、猫、猴等较大型动物亦常被用于OSAS的造模,但主要是通过一定程度地阻塞上气道来模拟OSAS患者形态学上的改变,但因这些动物体型较大,费用较昂贵,难以形成规模性的研究。OSAS最根本的病理生理特点是长期的慢性间歇性低氧,因此,在以往的研究中,有国内外学者[7]通过往复运动式低氧舱、低压低氧舱、低O2高CO2箱等方法建立OSAS动物模型,但都因实验设备要求高、操作复杂、重复性差、不能排除干扰因素及准确反映常压下缺氧的情况而逐渐被摒弃。目前建立OSAS动物模型应用最广泛的方法是通过常压混合气体箱[8],在常压的状态下,通过改变箱内气体各成分的浓度、比例来建立低氧环境。根据不同的实验要求及目的,可调节箱内低氧的程度及持续时间,现认为最低氧浓度多控制为5%~10%[9-10]为佳,低氧-再氧合周期可从30 s~8 min不等。这种方法操作方便简捷,可控性强,重复性高,虽不能完全复制人体OSAS气道狭窄的形态学改变,但能较好地复制OSAS患者缺氧-再氧合的病理生理变化。
3.2 慢性间歇缺氧小鼠心脏及大脑组织的病理变化 本实验通过对比A组及对照组小鼠的心脏及大脑组织的形态变化,发现在心肌组织中,对照组小鼠的心肌组织结构完整清晰、界限清楚、排列紧密;而A组小鼠心肌组织排列紊乱,结构、纹理不清,部分肌细胞核固缩深染。同样地,在脑组织中,A组脑组织细胞数量较对照组小鼠明显减少,且排列紊乱、稀疏,部分细胞核固缩深染,呈紫蓝色梭形,绝大多数细胞有核仁碎裂现象,血管较少且细,神经纤维较对照组稀疏。说明了慢性间歇低氧可对大脑及心脏组织造成形态上的损害,这也进一步验证了OSAS患者可引起多脏器损伤及易并发多种慢性疾病的这一观点,而这与OSAS的慢性间歇低氧导致的氧化应激及炎症改变等一系列的病理生理变化密切相关。
3.3 AGEs-RAGE/NF-κB途径与慢性间歇低氧小鼠的关系
3.3.1 血清AGEs在慢性间歇低氧小鼠中的变化 AGEs是蛋白质和脂类非酶糖基化反应启动后的一系列化学反应后所形成的一类化合物的总称,本身不具有反应活性,其主要包括有羧甲基赖氨酸(CML)、蛋白质交联后产物等。它在体内中多从氧化应激过程中产生,亦可通过外源性途径(主要为饮食)获得,其常积聚在组织中,并可随着年龄的增长而增加[11]。AGEs在多种疾病的发生发展过程中有着非常重要的作用,并且已有研究[12]发现,在OSAS患者体内同样有AGEs水平的升高,并且提出OASA本身可能是影响血清AGEs水平高低的因素之一。虽与糖尿病患者相比其增高水平不明显,但OSAS患者血清中AGEs水平确实较正常增高,并且在使用CAPA治疗后的患者AGEs较未治疗前有所下降。国外研究证明AGEs的血清水平增高与睡眠呼吸障碍的严重程度有关[13]。在本实验中,予间歇低氧10周后的A组小鼠血清AGEs水平(527.5±97.53) ng/L,而正常对照组小鼠仅为(432.7±92.99) ng/L,可见A组的小鼠较对照组是明显升高的,且差异有统计学意义(P<0.05)。这也证实了OSAS这种疾病是可促进AGEs的产生的,与上述相关研究结果相符。原因可能是OSAS本质是一种慢性间歇低氧性疾病,类似缺血/再灌注的损伤机制,产生一系列的氧化应激及炎症反应,而氧化应激及炎性反应等因素是可促进AGEs形成的,因此可在OSAS患者体内发现血清AGEs水平病理性的升高。
3.3.2 AGEs-RAGE/NF-κB途径对慢性间歇低氧小鼠的影响 AGEs在不同的器官组织有不同的的致病机制,它的许多效应大多是通过结合相关受体而实现,而晚期糖基化终末产物受体(RAGE)则是研究最多且与其亲和性较高的一个受体,在AGEs介导的病变中起主要作用。RAGE是一种跨膜受体,亦是免疫球蛋白超家族的多配体受体中的一员,在体内分布非常广泛,在成年人体内,RAGE主要分布在免疫细胞、神经元细胞、星形胶质细胞、心肌细胞、内皮细胞、血管平滑肌细胞和癌细胞中,但在正常人中,RAGE是低水平表达的,当细胞或组织局部出现RAGE-配体或炎症因子聚集时,可RAGE的表达将大大增加[14]。许多研究[15]表明,NF-κB的激活在RAGE-配体的致病机制中起着非常重要的作用。NF-κB是一种核转录因子,在机体内广泛存在,在感染、炎症反应和DNA损伤等刺激下可对相关的基因进行转录调控。NF-κB以异源性或同源性二聚体形式存在于胞浆中,最常见的二聚体形式为P65和P50组成的异源性二聚体。一般情况下,NF-κB与抑制性蛋白IкB 结合而失去活性,而在受到毒素、氧自由基、缺氧、缺血、脂多糖以及白细胞介素等因素的刺激后,可与IкB 分离而重新获得转录调节的能力,最终导致一系列炎症因子及趋化因子如IL-6、TNF-α、GM-CSF等的表达上调及细胞坏死和细胞凋亡。AGEs与血管内皮细胞表面的RAGE结合后,在体内外均可引起NF-κB p65 mRNA和抗原表达增加,NF-κB持续活化,而NF-κB的活化,可引起大量促炎细胞因子(IL-6、TNF-α等)、生长因子和黏附因子等的表达和释放,从而引起复杂的生物学效应。RAGE作为AGEs在细胞表面的信号转导受体,可激活细胞内部各种信号转导机制,如磷酸肌醇-3激酶(PI3K)、P38 MAPK、MAPK/Erk1,2、JNK/SAPK、rho-GTP酶及JAK/STAT等信号途径,大多通过活化NF-κB这个具多项调节功能的枢纽放大或级联一系列炎症反应,对机体造成损害。因此,AGEs-RAGE/NF-κB通路是RAGE与AGEs相互作用后具有代表性的一种信号转导途径[16]。近年来已在OSAS患者的体内发现AGEs水平较正常健康人是升高的,相关研究[17]发现,间歇缺氧可导致核转录因子的显著上调。OSAS患者的慢性间断性低氧血症可引起血清中IL-6、CRP等水平增高,刺激循环中可溶性黏附分子如ICAM-1、VCAM-1表达增加[18]。因此可推测AGEs-RAGE/NF-κB信号通路在OSAS患者体内是存在的,且对其起着一定的损害作用。
本实验取各组小鼠心脏及大脑组织检测其RAGE及NF-κB蛋白的表达情况,结果显示:在小鼠心脏组织中,对照组小鼠RAGE及NF-κB的表达最弱,而A组的RAGE及NF-κB的表达在各组中表达最强;在小鼠的大脑组织中,A组的RAGE及NF-κB蛋白的表达在各组小鼠的仍是最强。由此可见,RAGE及NF-κB蛋白在OSAS疾病中表达是上调的。此外,通过检测由NF-κB转录调控的相关炎症因子IL-6及TNF-α的表达情况,发现A组小鼠血清IL-6、TNF-α及水平均较正常对照组小鼠明显升高,两组间差异有统计学意义(P<0.01),说明了在OSAS患者体内IL-6、TNF-α表达亦是上调的。
因此,AGEs-RAGE/NF-κB信号通路在OSAS患者体内是存在的:OSAS由于其慢性间歇缺氧的本质,可上调AGEs及RAGE蛋白的表达,两者结合后可激活氧化应激,使活性氧簇生成增多,活性氧簇可通过PI3K、P38 MAPK、MAPK/Erk1,2等途径活化NF-κB,NF-κB将信号传导入细胞核内,进而调控及转录下游的相关炎症信号,导致炎症反应的持续活化及放大,对各组织器官造成持续的损害。
3.4 大株红景天及改善通气对慢性间歇低氧小鼠的影响 红景天是一种多年生草本植物,生长在高原无污染地带,能够补气清肺、益智养心,是一味作用广泛的中药,而大株红景天注射液则是在红景天基础上提炼而成的注射液,其主要活性部分为红景天苷,有着众多的药理作用。谢亮等[19]通过实验研究认为,红景天的脑保护作用机制可能与其改善缺血脑组织能量代谢,清除自由基和抗氧化作用有关。经过提炼而成的大株红景天可通过减轻心肌的氧化应激反应程度、降低脂质过氧化物的形成及减少一氧化氮的合成,对缺血再灌注的心肌起一定的保护作用[19]。因此,我们猜测大株红景天可用于防治OSAS的多脏器损害。本实验在慢性间歇缺氧6周后的小鼠身上腹腔注射治疗剂量的大株红景天注射液4周,结果显示,在大脑组织中,C组小鼠神经元较A组有所增多,神经纤维排列较紧密,核固缩深染现象亦较其减少。而在心脏组织中,A组小鼠心肌组织排列紊乱,结构、纹理不清,部分肌细胞核固缩深染;C组小鼠心肌结构较清楚,排列亦较紧密。而纠正缺氧后的慢性间歇低氧小鼠(B组)在心脏及大脑组织中亦有类似的病理改变,均较A组有所改善。因此,纠正缺氧状态及给予大株红景天注射液均可减轻慢性间歇低氧小鼠心脏、大脑组织的损害,而大株红景天给药方便,疗效基本与CAPA相仿,或可在临床上用于OSAS多脏器损害的防治。
有研究[20]表明,红景天可降低血液中C反应蛋白等炎症介质的水平,说明了其具有一定的抗炎作用。而在本研究中,C组小鼠血清IL-6、TNF-α的水平较A组小鼠低,且差异有统计学意义,说明了大株红景天注射液在慢性间歇低氧小鼠中是有一定的抗炎作用的,这与上述研究结果相符。而在RAGE及NF-κB蛋白表达方面,小鼠心脏组织中,C组RAGE的表达与A组相仿,但NF-κB表达较其减少,而在大脑组织中,大株红景天组的RAGE表达较A组稍有减少,而NF-κB表达则较其有更为明显的下降。另外,各组小鼠血清AGEs结果显示,虽C组小鼠有较A组降低的趋势,但组间的差异却无统计学意义。提示大株红景天并不能通过下调AGEs及RAGE的表达来对慢性间歇低氧小鼠起保护作用。
综上所述,OSAS可引起多器官、组织如心脏、大脑组织的损害。OSAS可激活AGEs-RAGE/NF-κB通路,调节炎症细胞释放IL-6、TNF-α等炎症因子,或是OSAS易合并多脏器损害的原因之一。而大株红景天注射液有一定程度的抗炎作用,可用于防治OSAS多脏器的损害,但其作用机制与AGEs-RAGE/NF-κB信号通路的激活无明显关系。

