肠内饲管给药对心力衰竭合并痛风患者预后的影响
陈君燕,吕春秋,舒龙梅
(丽水市人民医院 药学部,浙江 丽水 323000)
痛风是尿酸排出受阻、嘌呤代谢失衡使血尿酸异常升高造成的一种关节局部炎症,具有发病率高、病程长、致残率高等特点[1]。该病的病理特征为关节滑膜的慢性炎症、滑膜翳形成、细胞浸润等,可导致关节结构的破坏,严重的可导致关节畸形[2-3]。当前痛风也常见于心力衰竭(以下简称心衰)患者。主要在于心衰时机体摄氧障碍,导致无氧代谢增加,尿酸排出减少,糖原酵解增加,抑制肾小管分泌尿酸;同时腺嘌呤降解为次黄嘌呤和尿酸,使机体出现血尿酸升高、反复发作性急性关节炎、痛风石,从而诱发痛风的产生[4]。血清尿酸也是心衰患者心功能分级、代谢、血流动力学的有效预测指标,可作为心衰患者死亡的独立预测指标。当前治疗心衰合并痛风的方法比较多,但目前尚无特效疗法[5-6]。特别是部分患者的病情比较危重,除了常规口服药物治疗外,也需要加强肠内、肠外支持治疗[7-8]。肠外支持治疗虽然有一定的效果,但是持续效果不佳,且对机体有一定的负面作用[9],特别是当机体营养储备不足时,药物与营养物质的不良结合可产生不良反应,从而有可能影响治疗结果。肠内饲管给药能降低整个机体蛋白质分解代谢和脂肪氧化,间接提高药效[10-11]。本文探讨肠内饲管给药对心衰合并痛风患者预后的影响,以明确不同方法给药的效果,为指导临床治疗提供参考,现报道如下。
1 资料与方法
1.1 研究对象
选取2013年6月—2018年12月丽水市人民医院诊治的心衰合并痛风患者72 例。按照随机数字表法分为对照组与观察组,每组36 例。纳入标准:①符合心衰合并痛风的诊断标准;②NYHA 心功能分级Ⅱ、Ⅲ级;③左室射血分数(LVEF)<50%;④医院医学伦理委员会批准本研究;⑤年龄18 ~60 岁,具有肠外肠内支持治疗指征;⑥入组前2 周未使用降尿酸药物。排除标准:①妊娠或哺乳期妇女;②无法合作者,如精神病患者;③需要长期大量使用利尿剂的肝、肾疾病患者;④重度肥胖、恶性肿瘤放、化疗及严重肝肾功能不全患者;⑤临床资料不全者;⑥正在参加另外一项临床药物实验者。研究经本院医学伦理委员批准,患者知情并签署同意书。两组患者的性别构成比、年龄、体重指数等一般资料比较,差异无统计学意义(P<0.05),具有可比性。见表1。
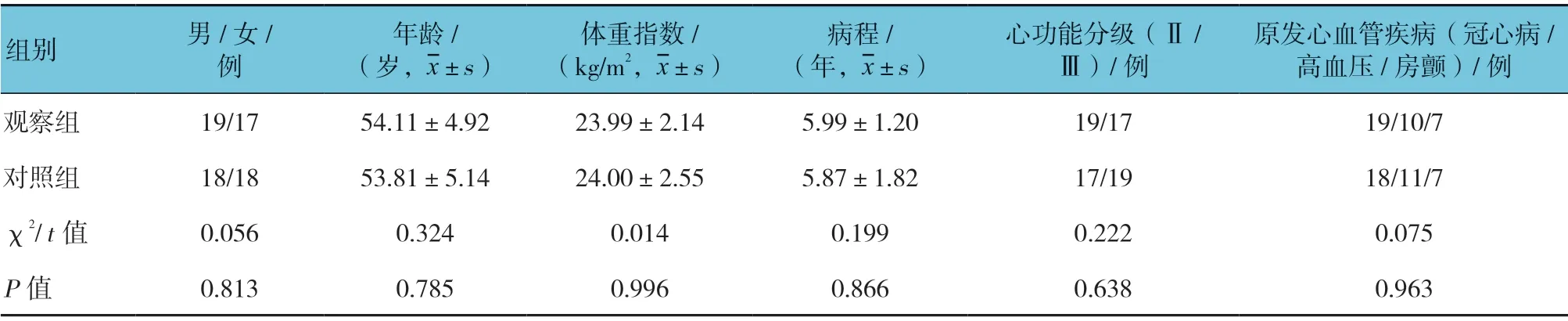
表1 两组一般资料比较 (n =36)
1.2 治疗方法
常规治疗:两组都给予血管紧张素转化酶抑制剂或血管紧张素Ⅱ受体拮抗剂、螺内酯、β 受体抑制剂、硝酸酯制剂、地高辛等;同时服用苯溴马隆50 mg,1 次/d。对照组:给予肠外支持治疗,通过锁骨下静脉导管输入三合一全营养混合液,按105 ~126 kJ/kg计算每天所需的热量(60%糖分、20%氨基酸、20%脂类物质),另外根据患者每日所需补充Na+、K+、微量元素、维生素等物质。观察组:给予肠内饲管给药治疗,治疗第1 天予100 ml 生理盐水自鼻饲管注入,第2 ~14 天予肠内支持(支持物质能量同对照组),以鼻饲管滴入肠内营养液,滴速由30 ~50 ml/h 增加到100 ~150 ml/h。两组均治疗观察14 d。
1.3 观察指标
①疗效评定:总有效率=(痊愈+显效)/组内例数×100%。痊愈为关节活动自如,血尿酸降至正常,心功能达到Ⅰ级,临床症状消失;显效为心功能提高Ⅰ级,但未达到Ⅰ级心功能,临床症状好转,关节活动灵活,血尿酸较治疗前降低10%以上;无效为无达到上述标准甚或恶化。②治疗前后患者的血清尿酸浓度。③治疗前后急性生理和慢性健康(APACHE Ⅱ)评分及格拉斯哥昏迷指数(GCS)评分。④治疗前后白细胞介素-6(IL-6)与C 反应蛋白(CRP)质量浓度。
1.4 统计学方法
数据分析采用SPSS 22.00 统计软件。计量资料以均数±标准差(±s)表示,比较用t检验;计数资料以例(%)表示,比较用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者治疗总有效率比较
所有患者都顺利完成治疗,观察组的总有效率为100.0%,与对照组的88.9%比较,差异有统计学意义(χ2=4.235,P=0.040),观察组高于对照组。见表2。
2.2 两组患者血清尿酸浓度的变化
两组患者治疗后血清尿酸浓度变化比较,差异有统计学意义(P<0.05),观察组低于对照组;两组患者治疗后血清尿酸浓度低于治疗前(P<0.05)。见表3。
2.3 两组患者GCS 与APACHE Ⅱ评分的变化
两组患者治疗后GCS 和APACHE Ⅱ评分比较,差异有统计学意义(P<0.05),观察组GCS 评分低于对照组,APACHE Ⅱ评分高于对照组。两组患者治疗后的GCS 评分低于治疗前(P<0.05),APACHE Ⅱ评分高于治疗前(P<0.05)。见表4。
2.4 两组患者CRP 与IL-6 质量浓度的变化
两组患者治疗后血清CRP 与IL-6 质量浓度比较,差异有统计学意义(P<0.05),观察组低于对照组;两组患者治疗后的血清CRP 与IL-6 质量浓度均低于治疗前(P<0.05)。见表5。
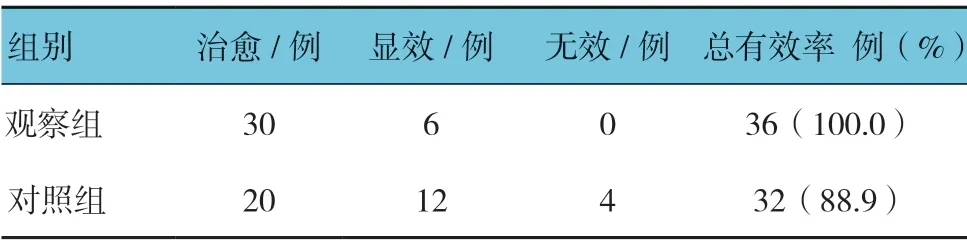
表2 两组治疗总有效率比较 (n =36)
表3 两组治疗前后血清尿酸浓度比较(n =36,μmol/L,±s)

表3 两组治疗前后血清尿酸浓度比较(n =36,μmol/L,±s)
组别 治疗前 治疗后 t 值 P 值观察组 498.19±50.29 345.11±45.20 33.184 0.000对照组 489.11±40.22 402.11±50.39 20.742 0.000 t 值 0.872 12.334 P 值 0.198 0.000
表4 两组治疗前后GCS 评分与APACHE Ⅱ评分比较 (n =36,±s)
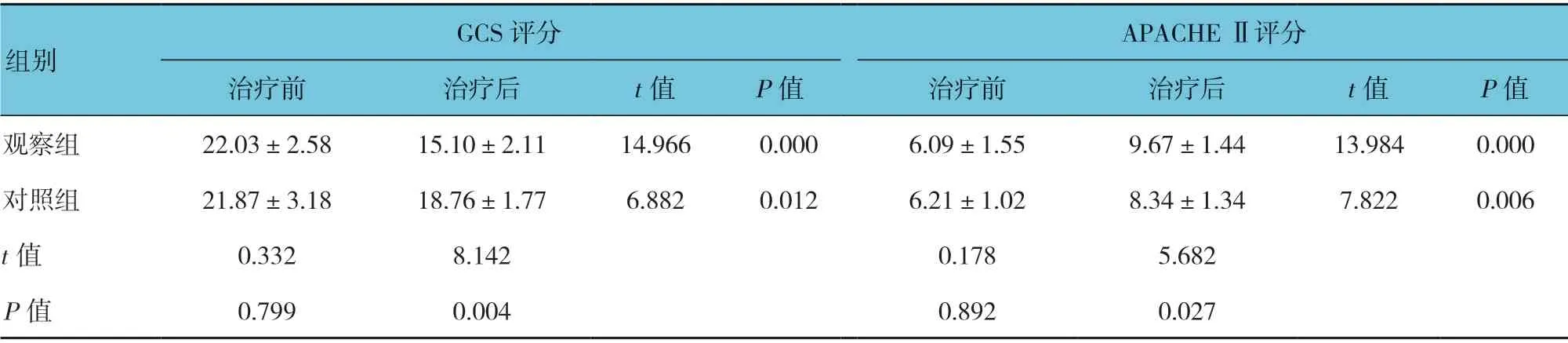
表4 两组治疗前后GCS 评分与APACHE Ⅱ评分比较 (n =36,±s)
GCS 评分 APACHE Ⅱ评分治疗前 治疗后 t 值 P 值 治疗前 治疗后 t 值 P 值观察组 22.03±2.58 15.10±2.11 14.966 0.000 6.09±1.55 9.67±1.44 13.984 0.000对照组 21.87±3.18 18.76±1.77 6.882 0.012 6.21±1.02 8.34±1.34 7.822 0.006 t 值 0.332 8.142 0.178 5.682 P 值 0.799 0.004 0.892 0.027组别
表5 两组治疗前后CRP 与IL-6 质量浓度比较 (n =36,±s)
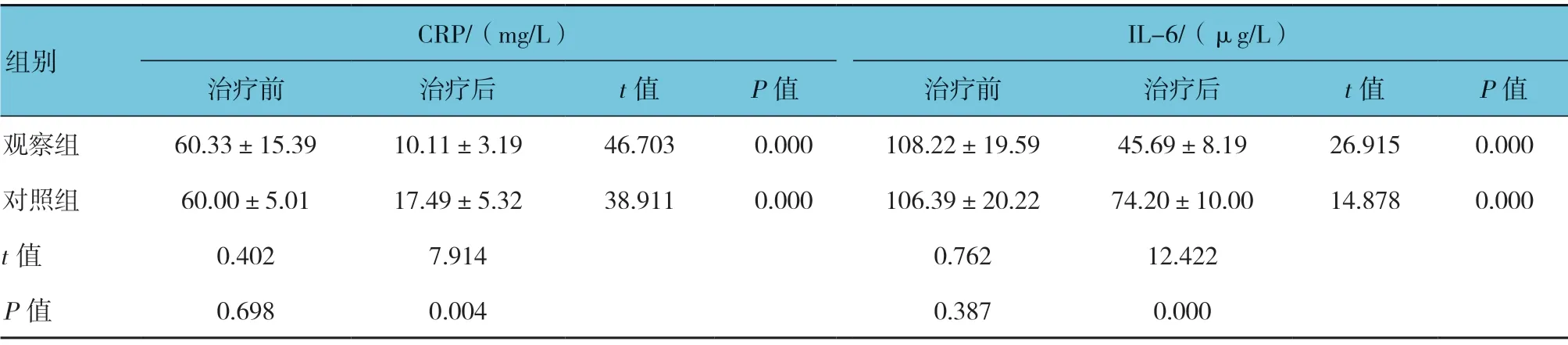
表5 两组治疗前后CRP 与IL-6 质量浓度比较 (n =36,±s)
CRP/(mg/L) IL-6/(μg/L)治疗前 治疗后 t 值 P 值 治疗前 治疗后 t 值 P 值观察组 60.33±15.39 10.11±3.19 46.703 0.000 108.22±19.59 45.69±8.19 26.915 0.000对照组 60.00±5.01 17.49±5.32 38.911 0.000 106.39±20.22 74.20±10.00 14.878 0.000 t 值 0.402 7.914 0.762 12.422 P 值 0.698 0.004 0.387 0.000组别
3 讨论
痛风多见于男性,是由于尿酸钠晶体沉积在人体组织而导致的一种主要为关节表现的非特异性炎症反应[12]。而心衰时可兴奋交感神经,激活RAAS系统激活,从而影响尿酸浓度;并且心衰时心排血量减少,肾小管对尿酸盐的再吸收增加,肾脏灌注不足,肾小球率过滤减少,也会使尿酸浓度升高,从而使心衰合并痛风的发生概率显著增加[13]。
药物口服治疗该病虽然有一定的效果,尤其是苯溴马隆,可促使血尿酸更好地溶解,提高尿酸排泄量,从而实现血尿代谢改善的目的,但是药效持续效果不佳[14]。肠外支持治疗常出现堵塞、药物毒副作用增加、药效降低等问题。肠内饲管给药指的是直接将肠内营养液、水分等输入到患者的胃肠道,从而实现药物治疗目的的一种给药方式[15]。其可保障肠道黏膜的完整性,降低病原体黏附于肠管上皮细胞,促进局部血流增加,有利于肠蠕动,增加对药物的吸收,避免细菌易位及菌群失调的现象[16]。本研究显示,所有患者都顺利完成治疗,观察组的总有效率为100.0%,高于对照组的88.9%;两组治疗后的血清尿酸水平都低于治疗前,观察组也低于对照组,表明肠内饲管给药能促进降低患者血清尿酸水平,提高治疗效果。
现代研究表明,心衰可导致在关节组织脏器中局部堆积尿酸盐结晶,造成肾功能不全与破坏骨质和软骨结构,导致功能障碍,诱发痛风的发生[17]。研究表明,由中性粒细胞介导的炎症是心衰合并痛风的核心所在,在此过程中白细胞介素类细胞因子发挥非常重要的作用[18]。炎症介质的释放能够生成更多的血管舒张因子,扩张血管,增强血管通透性,导致局部水肿。干预黄嘌呤氧化酶代谢也是延缓心衰进展的重要途径,有研究显示苯溴马隆能降低收缩压,改善心衰伴高尿酸血症患者心功能,也能改善机体心肌能量代谢,从而提高心肌收缩力、改善左心功能[19]。本研究显示,治疗后两组的血清CRP 与IL-6 质量浓度低于治疗前,观察组低于对照组,表明肠内饲管给药能更有效地降低机体炎症介质的含量。该方法能确保患者得到充足的营养,促进心室重构,抑制心肌细胞凋亡,促使平滑肌细胞增殖,从而抑制炎症因子的表达。
在衰竭的心肌组织中,高水平表达的黄嘌呤氧化酶可增进内皮功能障碍,引起氧化应激,诱发高尿酸血症[20]。两者共同发病时,会抑制蠕动功能与胃肠道排空能力;特别是胃动力恢复的快慢与GCS 评分呈正相关。肠内饲管给药可促进局部血流增加,免去药物遭受感染的可能性,从而改善患者预后[21]。本研究显示,两组治疗后的GCS 评分低于治疗前,APACHE Ⅱ评分高于治疗前。肠内饲管给药需要进一步标准化与规范化,要建立口服给药数据库并嵌入合理用药监测系统中,若只能通过饲管给药时,操作过程中需要给予患者足够的保护,在尽可能规律给药的情况下监测其血药浓度,从而保障安全用药[22-24]。
总之,肠内饲管给药能抑制心衰合并痛风患者炎症因子与尿酸的释放,从而提高治疗效果,改善患者的预后。

