粪便菌群移植在慢性乙肝治疗中的作用及机制*
魏 琦, 杨静楠▲, 何学良, 何巧灵, 司会方,胡 鸿, 白春洋, 王慧超, 林旭红△
(河南大学 1淮河医院检验科,转化医学中心,2淮河医院消化内科,3第一附属医院肾内科,河南开封475000)
慢性乙型肝炎(chronic hepatitis B,CHB)是乙型肝炎病毒(hepatitis B virus,HBV)持续感染而致的肝脏慢性疾病。据报道,全球大约有2.4 亿慢性HBV感染者,其中大多数患者死于CHB 导致的并发症[1]。CHB 患者中有15%~40%会发展成肝硬化、肝衰竭和肝细胞癌(hepatocellular carcinoma,HCC)[2]。持续的HBV 感染及其带来的并发症,给大量家庭带来了沉重的经济负担和健康威胁。常见的抗病毒药物主要为干扰素和核苷(酸)类似物,虽可阻滞病情进展,预防肝硬化、肝癌、死亡等风险,但难以根治乙肝,彻底清除HBV[3]。因此,寻求有效的治疗方法是这一领域目前亟待解决的问题。
人体肠道菌群是一个非常复杂的微生态系统,随着肠-肝轴的研究深入,越来越多的证据表明肠道微生态紊乱参与了多种肝脏疾病的病理生理过程。肝脏与肠道之间联系密切。来自肠道的血液汇入门静脉激活肝脏功能,肝脏又通过胆汁分泌进入肠腔来影响肠道功能[4]。肝脏发生疾病,使代谢失衡、胆汁产生排泄受阻、免疫机制障碍,影响细菌分布,导致肠道微生态失衡。而肠道微生态失衡可破坏肠道黏膜屏障,激发肝脏炎性反应,加重肝脏疾病病情。因此,CHB 和肠道微生态间存在密切的联系。
粪便菌群移植(faecal microbiota transplantation,FMT)是将健康人的粪便上清液通过一定途径(如鼻胃管或鼻十二指肠管、胃镜或结肠镜、直肠导管灌肠等)输入到患者肠道内,以恢复或补充正常肠道菌群,从而达到治疗疾病的目的。目前FMT 已被用于治疗艰难梭菌感染、炎症性肠病(inflammatory bowel disease,IBD)、肠易激综合征(irritable bowel syndrome,IBS)和各种肝脏疾病。2017 年厦门大学附属中山医院率先发表了FMT 治疗CHB 的文章,报道显示在长期抗病毒治疗后乙型肝炎e 抗原(hepatitis B e-antigen,HBeAg)仍持续阳性的大部分病例中,FMT 可诱导HBeAg 清除。虽然只有5 名患者参加了FMT 组,但统计数据差异显著(P=0.000 1),这一结果特别令HBeAg 阳性CHB 患者鼓舞,否则他们无法停止口服抗病毒药物治疗[5]。研究说明,FMT 可能作为一种潜在的免疫调节剂,在改善肠道微环境和清除HBV 方面有着积极的治疗作用。但是,有关FMT 用于治疗CHB 的实验数据、临床数据及其机制研究均仍有限。
本研究通过动物实验,利用先进的高通量测序技术观察CHB 发病过程中肠道内菌群的改变,分析CHB 患者的肠道菌群结构,并以此为基础,利用FMT技术,探讨肠道菌群在治疗CHB中的作用,研究白细胞介素 18(interleukin-18,IL-18)及 Toll 样受体 4(Toll-like receptor 4,TLR4)信号通路的作用及可能机制,从而为CHB的治疗和预防开辟新途径,也为辅助CHB的诊断和治疗提供新的实验依据。
材料和方法
1 实验材料
1.1 实验动物 6~8 周龄雌雄各半C57BL/6J 小鼠共50 只购自河南省实验动物中心[许可证号:SCXK(豫)2017-0001],体重18~22 g,所有动物购回后适应性喂养10 d,所有操作程序符合国际实验室动物护理和使用指南,并获得河南大学医学伦理委员会批准。
1.2 主要试剂与器材 pAAV-HBV1.2 质粒由台湾大学陈培哲教授惠赠;乙型肝炎表面抗原(hepatitis B surface antigen,HBsAg)诊断试剂盒(上海科华生物工程股份有限公司);IL-18 试剂盒(Elixir,I098FC);恩替卡韦(entecavir,ETV)片(博路定,中美上海施贵宝制药有限公司);TAK-242(MedChemExpress,HY-11109);抗 TLR4 抗体(eBioscience,14-9917-82);粪便 DNA 提取试剂盒(Qubit dsDNA HS Assay Kit,Thermo Fisher Scientific)。安图全自动酶标仪PHOMO(安图生物工程股份有限公司);光学显微镜(OLYMPUS);流式细胞仪(BD FACSCanto);测序仪(Illumina)。
2 实验方法
2.1 分组及相应的处理 取6~8 周C57BL/6J 小鼠随机分为 5 组:对照组、CHB 组、ETV 组、综合治疗(ETV+FMT,EFMT)组和阻断剂(TAK-242+ETV+FMT,EFMT-TAK)组,每组10 只。对照组小鼠给予正常饲喂,不进行任何处理;CHB 组小鼠给予正常饲喂;ETV 组小鼠进行常规ETV 抗病毒治疗(75 μg/kg,约每只0.375 mL,每天 1 次灌胃);EFMT 组在ETV抗病毒治疗同时给予粪菌悬液每天灌胃1次,每只约0.5 mL;EFMT-TAK 组腹腔注射TAK-242 溶液(3 mg/kg),每天 1 次,连续 3 d[6],然后给予ETV 及粪菌悬液每天灌胃1 次处理。每隔10 d 留取5 组小鼠粪便标本,放于-80℃保存。12 周后处死小鼠,取小鼠肝脏组织及血液标本。所有操作程序获得我校医学伦理委员会批准。
2.2 造模方法 准备10 μg 的pAAV-HBV1.2 质粒溶于一定体积PBS,使之相当于小鼠体重的8%,在5~7 s 内将溶液快速注射到小鼠尾静脉内[7],复制CHB小鼠模型。
2.3 药物制备 (1)ETV 溶液制备:将 ETV 片按0.5 mg∶100 mL 的比例溶于生理盐水。(2)粪菌液的制备[8-9]:收集正常C57BL/6J 小鼠2~4 h 新鲜大便,并移至搅拌器;粪便称重后,加入约5 倍的无菌生理盐水,置于搅拌器中进行搅拌,混匀后过滤掉残渣,取混悬液;用自制滤网过滤掉混悬液残渣,收集悬液;将混悬液转移到10 mL离心管中,以1 200 r/min离心3 min;弃掉上清液,添加无菌生理盐水至原混悬液的量,上下颠倒混匀,再次以上述方法离心,重复洗涤离心3~5 次;弃去多数的上清液,最后的沉淀即为提取的量;最后沉淀加入3 倍的生理盐水,轻轻上下混匀即得到最终粪菌悬液。(3)TAK-242 溶液的制备:将5 mg TAK-242粉末溶于50 μL DMSO中制成贮存液,使用时从中取30 μL 补加无菌双蒸水至3 mL体积。
2.4 标本采集及处理
2.4.1 粪便收集及处理 自制粪便收集笼,自实验开始之日每隔10 d 收取小鼠粪便,清理干净混入的食物残渣,标记日期,放于-80℃保存,用于后续高通量测序检测。
2.4.2 血液和组织的收集及处理 于实验总进程第12 周处死小鼠。将小鼠放置于有乙醚的密封容器内麻醉,摘除眼球取眼底静脉血约1.0~1.5 mL,置于无菌干燥EP 管中,4℃冰箱保存,用于ELISA 及流式细胞术检测。采血完成后将小鼠固定于手术台上,迅速沿腹中线打开腹腔,取出肝脏,4%多聚甲醛固定,用于制作病理切片。
2.5 观察指标
2.5.1 一般情况 实验开始后,每天观察小鼠精神状态、活动、进食、饮水量、体重、毛发光泽、大便性状改变及有无死亡。
2.5.2 肝组织病理学评分 肝脏炎症程度根据Ishak 系统[10]进行评分:从门管区炎症、界面炎症、小叶内炎症和融合性坏死4 个维度进行评价,以连续的整数(0~4 或0~6)表示不同严重程度的炎症和损伤情况,见表1。

表1 Ishak评分Table 1.The Ishak evaluation system
2.5.3 ELISA 法检测HBsAg 和IL-18 按照ELISA试剂盒说明书检测小鼠血清HBsAg和IL-18水平。
2.5.4 流式细胞术检测TLR4 取50 μL抗凝血,每管各加2 μL 抗TLR4 抗体,避光放置15 min。加入3倍体积的红细胞裂解液,轻轻混匀,冰上放置15 min,至溶液清亮透明。450×g离心 10 min,弃去上清。PBS洗1次,加入200 μL PBS混匀后上机。
2.5.5 高通量测序进行肠道菌群多样性分析 分别收集5 组粪便样本,使用Qubit dsDNA HS Assay Kit提取 DNA 并检测 DNA 浓度。以 20~30 ng DNA 为模板,通过一系列PCR 引物扩增原核生物16S rDNA上包括V3 及V4 的2 个高度可变区。采用包含“5'-CCTACGGRRBGCASCAGKVRVGAAT-3'”序列的上游引物和包含“5'-GGACTACNVGGGTWTCTAATCC-3'”序列的下游引物扩增V3和V4区。通过酶标仪检测文库浓度。将文库定量到10 nmol/L,按MiSeq/NovaSeq(Illumina)仪器使用说明书进行双端测序,由仪器自带的相关软件读取序列信息。双端测序得到的正反向reads 首先进行两两拼接,过滤拼接结果中含有N 的序列,保留序列长度大于200 bp 的序列。经过质量过滤,去除嵌合体序列,最终得到的序列用于 OTU(operational taxonomic unit)聚 类 ,使 用VSEARCH 1.9.6 进行序列聚类(序列相似性设为97%),比对的16S rRNA 参考数据库为Silva 132。然后利用RDP(Ribosomal Database Program)classifier贝叶斯算法对OTU的代表性序列进行物种分类学分析,并在不同物种分类水平下统计每个样本的群落组成。基于OTU 得到分析结果,采用对样本序列进行随机抽样的方法,分别计算Shannon 和Chao1 等α多样性指数反映群落的物种丰度和多样性,通过weighted unifrac 分析比较样本间是否有显著的微生物群落差异。基于Brary-Curtis样本间距离矩阵用于主坐标分析(principal coordinate analysis,PCoA),以可视化图显示β多样性。
3 统计学处理
采用SPSS 20.0 统计软件进行数据分析。所有数据均以均数±标准误(mean±SEM)形式表示。多组间均数比较采用单因素方差分析(one way ANOVA),之后的两两比较,方差齐则采用SNK-q检验,方差不齐则采用Dunnett's 检验。以P<0.05 为差异有统计学意义。高通量测序观察肠道菌群多样性的统计分析方法见2.5.5和相关图注。
结 果
1 小鼠一般情况
因实验周期较长,造模与灌胃手法问题,操作过程中出现小鼠死亡,因此最终每组小鼠例数为6 只。与对照组相比,其余组小鼠均出现不同程度的精神倦怠、身体蜷缩、活动迟钝、进食减少、大便性状改变等情况。CHB 组小鼠以上情况更明显,且有2 只小鼠分别于第3 周和第6 周出现自然死亡。与对照组相比,CHB 组小鼠体重显著减轻(P<0.05);ETV 组、EFMT 组及EFMT-TAK 组小鼠体重与CHB 组比较有不同程度的回升(P<0.05);相较于ETV 组,EFMT 组及EFMT-TAK 组小鼠体重回升更为显著(P<0.05);EFMT-TAK 组与EFMT 组间的差异无统计学显著性,见图1。
2 各组小鼠组织学损伤的观察及评分
如图2 所示,对照组小鼠肝细胞形态正常,核圆居中,肝细胞排列规则、致密,以中央静脉为中心向四周呈索状排列;肝细胞索间界限清晰,仅散在有少量淋巴细胞。CHB 组小鼠肝细胞肿胀,肝索排列紊乱,大量炎症细胞浸润,出现片状坏死,组织学评分较对照组显著升高(P<0.05)。ETV 组小鼠肝细胞肿胀,散在炎症细胞浸润,多为点状坏死,组织学评分较CHB 组减低(P<0.05)。EFMT 组多为汇管区轻度炎症,散在少量淋巴细胞,EFMT-TAK 组肝细胞及肝索排列较为规则,仅有少量淋巴细胞浸润,这2 组的组织学评分均较ETV 组降低更为显著(P<0.05),其中EFMT-TAK组比EFMT组有进一步降低的趋势,差异具有统计学意义(P<0.05)。

Figure 1.Weight loss of the mice in each group.Mean±SEM.n=6.*P<0.05 vs control group;#P<0.05 vs CHB group;&P<0.05 vs ETV group.图1 各组小鼠体重下降情况的比较

Figure 2.HE staining of the liver tissues of the mice in each group(×10)and comparison of the histopathological scores.Mean±SEM. n=6.*P<0.05 vs control group;#P<0.05 vs CHB group;&P<0.05 vs ETV group;$P<0.05 vs EFMT group.图2 各组小鼠肝组织HE染色和组织学积分的比较
3 血清HBsAg水平的变化
血清HBsAg 的水平根据S/COV 值判定,S/COV值≥1 为阳性。正常组小鼠血清HBsAg 均为阴性,S/COV 值 为 0.32±0.12;CHB 组 S/COV 值 为 26.23±4.22,较control组显著升高(P<0.05);经过ETV治疗后,S/COV值下降至17.38±4.22,较control组显著降低(P<0.05);EFMT 组S/COV 值下降至6.92±2.22,EFMT-TAK 组 S/COV 值下降至 4.62±1.56,均较 CHB组显著降低(P<0.05),均比ETV 组降低更显著(P<0.05),EFMT-TAK 组相较于 EFMT 组有进一步降低的趋势,但差异无统计学显著性,见图3。
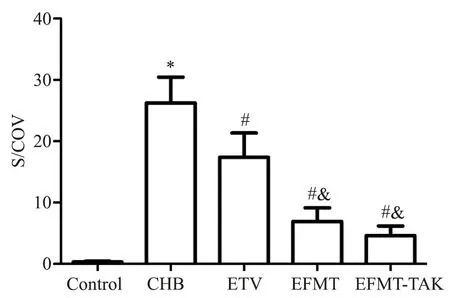
Figure 3.The change of serum HBsAg levels in the mice of each group.Mean±SEM. n=6.*P<0.05 vs control group;#P<0.05 vs CHB group;&P<0.05 vs ETV group.图3 各组小鼠血清HBsAg水平的变化
4 血清IL-18水平的变化
正常组小鼠血清IL-18 水平为(215.09±36.29)μg/L;CHB组小鼠血清IL-18水平为(504.12±36.29)μg/L,较对照组显著升高(P<0.05);经过ETV 治疗后,血清 IL-18 水平降至(365.63±49.97)μg/L(P<0.05);EFMT组小鼠血清IL-18水平显著降低至(250.45±38.05)μg/L(P<0.05),EFMT-TAK组进一步下降至(138.00±14.55)μg/L(P<0.05),均较ETV 组下降更为显著(P<0.05),EFMT-TAK 组较EFMT组呈进一步下降的趋势,但差异无统计学显著性,见图4。
5 各组小鼠全血细胞TLR4表达的变化
如图5 所示,对照组TLR4 阳性细胞比例为(0.73±0.28)%;CHB 组升高至(19.63±4.36)%(P<0.05);ETV 组降低至(9.87±2.43)%,EFMT 组进一步下降至(5.10±2.98)%,均较CHB 组显著降低(P<0.05),EFMT 组与ETV 组比较呈下降趋势,但差异无统计学显著性,见图5。
6 肠道菌群结构的变化
根据PCoA的可视化图显示,对照组与CHB组分为明显不同的两群,即表明两组间菌群的差异度较大;经过ETV 治疗后,ETV 组与CHB 组相比呈现出菌群结构的高度变异,而EFMT 组则与ETV 组具有一定的相似性,见图6。

Figure 4.The change of serum IL-18 levels in the mice of each group.Mean±SEM. n=6.*P<0.05 vs control group;#P<0.05 vs CHB group;&P<0.05 vs ETV group.图4 各组小鼠血清IL-18水平的变化
如图7 所示,在不同水平下各组中一些关键菌群的组成有所不同。以颜色深浅表示此种菌群含量在样本中的丰度。通过纲水平的热图(图7A)分析可看到,CHB 组Gammaproteobacteria(γ-变形菌)、Deltaproteobacteria(δ-变形菌)和Negativicutes的丰度显著高于对照组,而Deferribacteres(脱铁杆菌)和Saccharimonadia的丰度均较对照组降低;给予ETV治疗后上述菌群逐渐趋于正常;而在EFMT 组,Del⁃taproteobacteria和Negativicutes的丰度与对照组更为接近。如图7B 所示,通过科水平的热图分析可以看出,CHB 组Burkholderiaceae(伯克氏菌科)、Desulfovi⁃brionaceae(脱硫弧菌科)和Veillonellaceae(韦荣氏菌科)的丰度显著高于对照组;而在ETV 组及EFMT组,上述菌群均逐渐接近于正常。
进一步分析比较各组的主要菌群含量差异结果见图8。与正常组相比,CHB 组中Acetatifactor、Can⁃didatus-Saccharimonas、Streptococcus(链球菌)和Ru⁃minococcaceae-UCG-014 的含量显著减少,而Quinella的含量显著增多,见图8A。如图8B 所示,EFMT 组小鼠粪便中Anaeroplasma、Anaerostipes和Prevotellace⁃ae-UCG-001 的含量较CHB 组显著增多,而Quinella和Ruminiclostridium-9 含量显著减少。而对比ETV组和EFMT 组,主要菌群的含量也呈现出一定的差异,与 ETV 组相比,EFMT 组中Anaerostipes、Lactoba⁃cillus(乳杆菌)和Streptococcus(链球菌)的含量较ETV组增多,而[Eubacterium]-ruminantiumgroup 和Rumi⁃niclostridium-9的含量较少,见图8C。
通过α 多样性指数直观地比较组间多样性的差异程度,可以看出,相较于对照组,CHB 组的多样性指数显著下降;经过ETV 治疗,多样性得到回升;EFMT 组的多样性进一步增高,而EFMT-TAK 组的α多样性则最高,见图9。
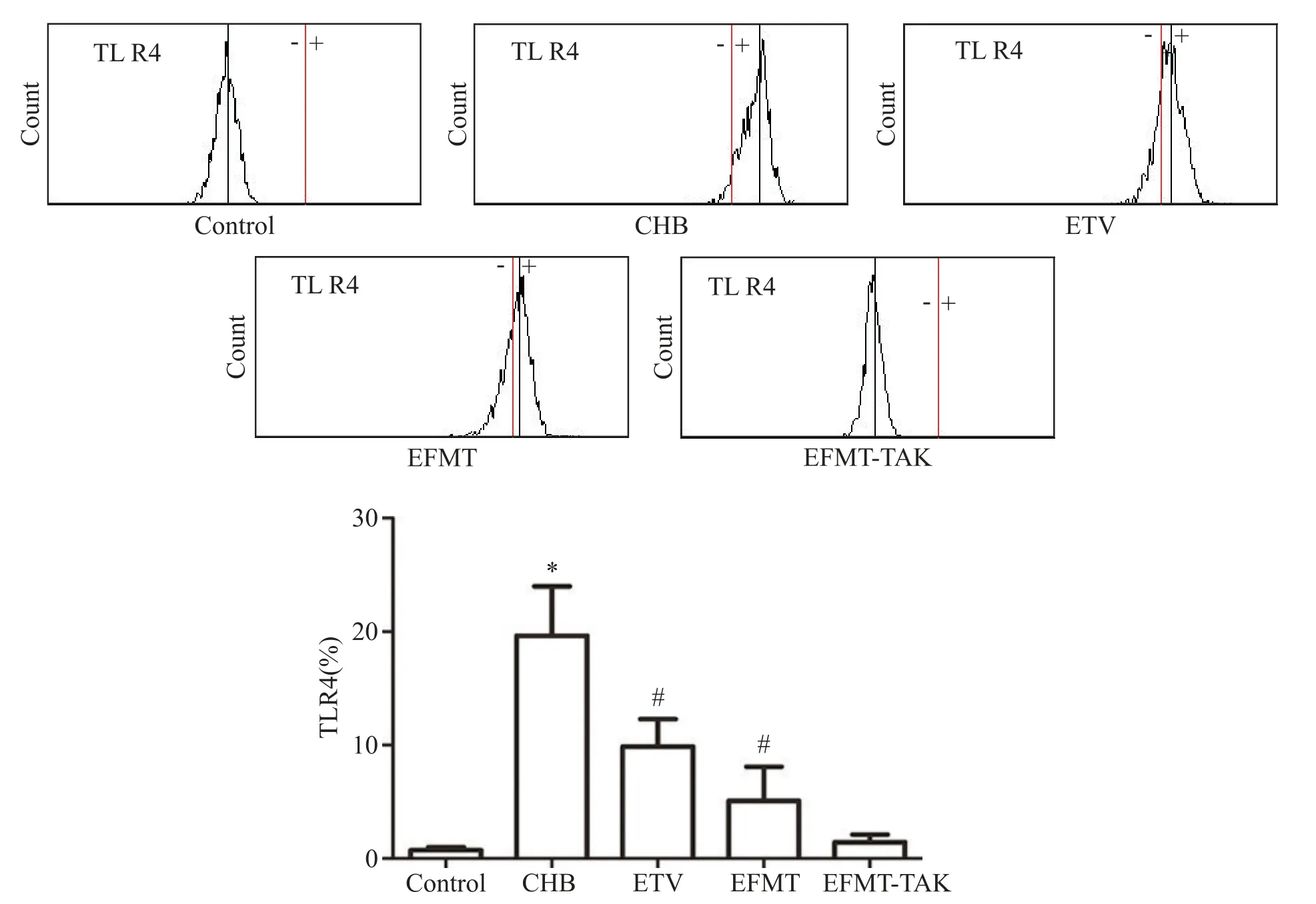
Figure 5.The change of TLR4 positive cell count in the blood of the mice in each group.Mean±SEM. n=6.*P<0.05 vs control group;#P<0.05 vs CHB group.图5 各组小鼠全血细胞TLR4表达的变化

Figure 6.Comparison of beta diversity index in each group.Principal coordinate analysis(PCoA)was performed using the beta diversity metrics of weighted UniFrac in control, CHB, ETV, EFMT and EFMT-TAK groups.There were apparent differences in the composition of the microbial population in control,CHB and ETV groups.图6 主坐标分析结果
讨 论
HBV 感染已经成为全球亟待解决的重要公共卫生问题,目前最常见的治疗CHB 的措施是抗病毒治疗。当前的抗病毒药物主要包括核苷/核苷酸类似物和聚乙二醇化干扰素,可抑制HBV 复制并延缓CHB 的进展,从而改善 CHB 患者的长期结局[11-12]。有效的抗病毒药物虽然能抑制病毒复制并减少CHB并发症的风险,但无法根除共价闭合环状DNA,且HBV 基因组的变异性导致大量患者在长期使用抗HBV 药物时产生耐药性,停药后易复发[13-14]。因此,亟需为慢性乙肝寻找新的治疗靶点。
近年来的研究表明,肠道菌群与CHB 的发生发展联系密切。人体肠道菌群是一个复杂且庞大的微生态系统,肠道黏膜是一道天然屏障,维持肠道菌群的稳态。当肠黏膜受损、肠道屏障通透性增加时,使肠道菌群失衡,大量毒素经门静脉进入肝脏,超过肝脏排毒代谢能力,过度激活机体的免疫系统导致异常免疫反应,肝细胞凋亡、坏死及其它脏器功能发生改变,会引发或加重慢性肝脏疾病;肝损伤又导致胆汁酸分泌降低,肠道pH 升高从而对肠道定植微生物内环境造成一定的冲击,导致肠道菌群结构及数量改变,即肠道菌群失调[15]。因此,肠道菌群的改变贯穿了慢性肝脏疾病的病理过程。已有大量研究表明,CHB 患者与正常人的肠道菌群存在显著差异[16-17]。Lu 等[18]比较了健康人群和 CHB 患者的肠道微生态,发现与健康对照组相比,CHB 患者肠道微生态中Faecalibacteriumprausnitzii、Enterococcus faeca⁃lis和Enterobacteriaceae有显著升高。与上述结果相一致,本研究表明,CHB 组小鼠肠道菌群结构与对照组明显不同,且经恩替卡韦及FMT治疗后,在降低HBsAg的同时,菌群逐渐恢复正常,说明FMT在改善菌群结构方面发挥重要作用。Xu 等[19]的相关研究发现CHB患者与健康对照间某些菌种物种相对丰度确有显著差异,而肠道菌群多样性没有显著差异。本研究结果显示,CHB 组小鼠较对照组肠道菌群物种丰度改变的同时,多样性也有显著下降,且经综合治疗后显著恢复,表明CHB时,肠道菌群多样性遭到破坏,经FMT 治疗后菌群多样性得到恢复。上述结果表明,FMT 在CHB 的治疗中发挥积极作用,可能与改善肠道菌群结构和多样性有关。

Figure 7.The heatmaps of some crucial flora of each sample.A:the heatmap of class level;B:the heatmap of family level.图7 肠道菌群的热图分析
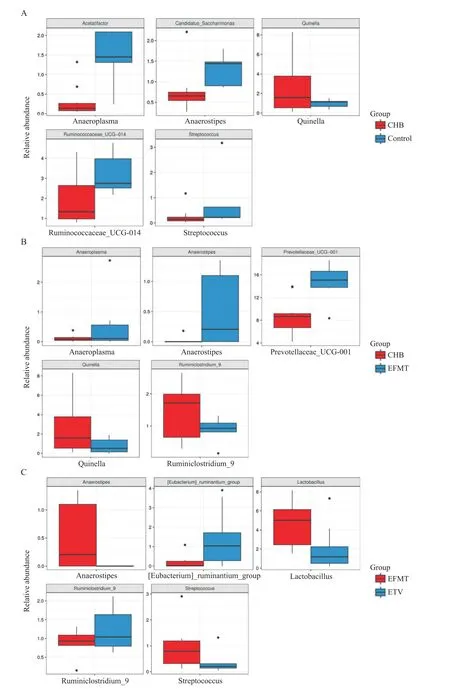
Figure 8.Analysis of the difference in the content of flora in various groups.A:CHB group vs normal group;B:CHB group vs EFMT group;C:EFMT group vs ETV group.图8 各组间菌群差异分析
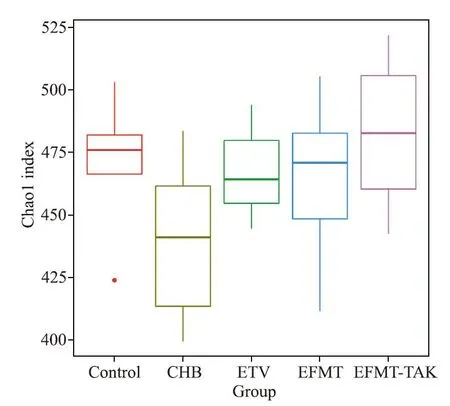
Figure 9.The box plot of alpha diversity index in various groups.The abscissa indicates the group name,and the ordinate indicates the value of Chao1 index.Each box in the figure shows the minimum,the first quartile,the median,the third quartile and the maximum of Chao1 index in the sample.图9 组间多样性差异箱线图
目前关于FMT 治疗乙肝的作用及机制并无定论。有研究表明,IL-18 参与了CHB 的发病机制。IL-18 是一种由单核细胞合成和分泌的促炎细胞因子,可促进T 细胞增殖及Th1 细胞发育和增殖,增强细胞毒性T细胞、自然杀伤细胞及Th1细胞的细胞毒性,增强粒细胞-巨噬细胞集落刺激因子的产生,在多种感染性疾病、免疫性疾病及炎症中均发挥重要作用[20]。目前研究表明,CHB与Th1/Th2比例失衡有关。CHB 患者表现出特征性的Th1 型细胞因子分泌减少及Th2 型细胞因子分泌增多,Th1/Th2 细胞因子的分泌紊乱,尤其是Th1 型细胞因子,如IL-12 和IL-18 等的产生缺陷,将会导致HBV 感染者的细胞免疫功能及辅助B 细胞功能低下,使病毒不易清除。在HBV 感染期间,乙肝病毒X 蛋白诱导IL-18 在肝脏中的表达,同时IL-18可诱导CHB患者外周血单个核细胞产生高水平的IFN-γ,并增强其杀死感染细胞的能力[21-23]。在本实验中,CHB组IL-18水平显著升高,这与此前研究相一致。相较于单独抗病毒治疗,FMT+ETV 治疗使IL-18 水平显著降低,表明综合治疗作用显著,FMT 治疗CHB 可能与降低IL-18 水平有关。此外,TLR4 在CHB 的发生发展中起重要作用。TLRs 作为Ⅰ型跨膜模式识别受体,可特异性地识别病原相关分子模式(pathogen-associated molecular pattems,PAMPs)或损伤相关分子模式(damage-associated molecular pattems,DAMPs),并在天然免疫中起着免疫监视的作用,也可通过其他抗原呈递细胞(antigen-presenting cell,APC)启动获得性免疫,从而在人体天然免疫和获得性免疫中起着桥梁作用[24-25]。已有研究表明,TLR4 在HBV 感染患者单核细胞中表达水平增加[26-27]。本研究也发现 CHB 组 TLR4 水平显著高于对照组,推测HBV 感染后可能通过上调TLR4 的表达来调节机体免疫应答,导致慢性感染的持续存在。但同时也有研究表明,TLR4 在HBV 感染患者单核细胞中的表达水平显著减少,这可能与HBV 感染时机体的免疫状态、病毒复制水平和肝脏的受损情况不同有关,因此仍需进一步验证。本研究结果表明,阻断小鼠TLR4后,再给予FMT+ETV 综合治疗,效果显著。这也表明,TLR4 在CHB 的进程中发挥重要作用。
本研究也存在不足之处,如造模的技术要求较高、每组的小鼠例数较少、小鼠模型和临床疾病存在差距等。这些问题有待后续改进。
综上所述,FMT 在CHB 的治疗中发挥积极作用,其机制可能与降低IL-18 水平、改善肠道菌群结构和多样性有关,TLR4信号通路参与其中。FMT可作为CHB 新的治疗手段,相关研究结果仍需进一步证实。

