太湖(苏州辖区)出入湖水体着生硅藻群落分布特点
陈 瑜, 景 明, 高 昕, 李继影
(江苏省苏州环境监测中心, 江苏 苏州 215004)
0 引言
太湖(北纬30°55′40" ~31°32′58"和东经119°52′32" ~120°36′10")横跨江、浙2 省,位于长江三角洲的南缘,是中国第三大淡水湖。太湖的主要进出河流有50 余条[1],环太湖出入湖水量是对太湖水量变化影响最大的一个因子[2]。 所处的太湖流域为典型的平原河网地区,河道总长约12 万km, 密度达3.3 km/km2,0.5 km2以上的大小湖泊189 个,多年平均水资源量176 亿m3,人均本地水资源量仅为全国平均水平的1/5[3]。 太湖在给人们带来物质文化财富的同时,也承受着人类活动带来的污染,其中太湖的主要外源污染是由河流输入[4-5]。 水利部太湖流域管理局自2002年起实施引江济太调水工程,通过望虞河将长江水引入太湖,“引江济太” 工程使得太湖换水周期缩短,水质改善,但也为太湖环境治理带来了新挑战[6]。 “引江济太”一定程度上抬高了太湖TP 浓度;入湖河流TP 与考核目标有较大差距,入湖负荷仍处于高位[7]。 毛新伟[8]的研究表明引水期长江及入湖的TN 和TP 浓度基本高于贡湖湾。
硅藻( Diatoms) 是一种真核单细胞微藻类。作为水体中重要的初级生产者[9],硅藻在水生生态系统和全球碳循环中具有举足轻重的地位[10]。 研究发现,硅藻对环境变化尤其是有机污染和富营养化反应很快,对水环境因子变化非常敏感[11],温度、营养盐、浮游动物捕食等环境的变化都会使硅藻的种类及数量发生相应的改变[12-13]。硅藻广泛存在于不同营养类型水体中,硅藻与环境因子相互影响,多项研究表明,二者之间的相互作用在水生生态系统中产生了重要影响。 2000年欧盟水框架指导委员会(Water Framework Directive of the European Union) 将硅藻推荐为当前水环境整治决策中可以用来确定营养水平的一个有效的生物指标[14]。 因其对环境的指示作用比蓝藻、绿藻更灵敏[15-17],作为良好的水生态环境指示生物[18],硅藻已被国内外广泛应用于监测湖泊和河流水质的变化[19-21]。
本研究拟通过对太湖主要出入湖河道及太湖湖体(苏州辖区)15 个点位的着生硅藻和水环境因子进行调查研究,探究硅藻与环境的关系,期望能够为太湖环境监测和治理以及水源地保护提供技术支持。
1 材料与方法
1.1 采样点位
太湖的主要进出河流众多, 其中望虞河是太湖最大入湖河道之一, 望虞河是引江济太调水的重要工程。 太湖在苏州辖区的出湖河道有木光河、胥江、太浦河和苏东河等。 本研究在出入湖河道及太湖水域共设置15 个采样点,见图1。
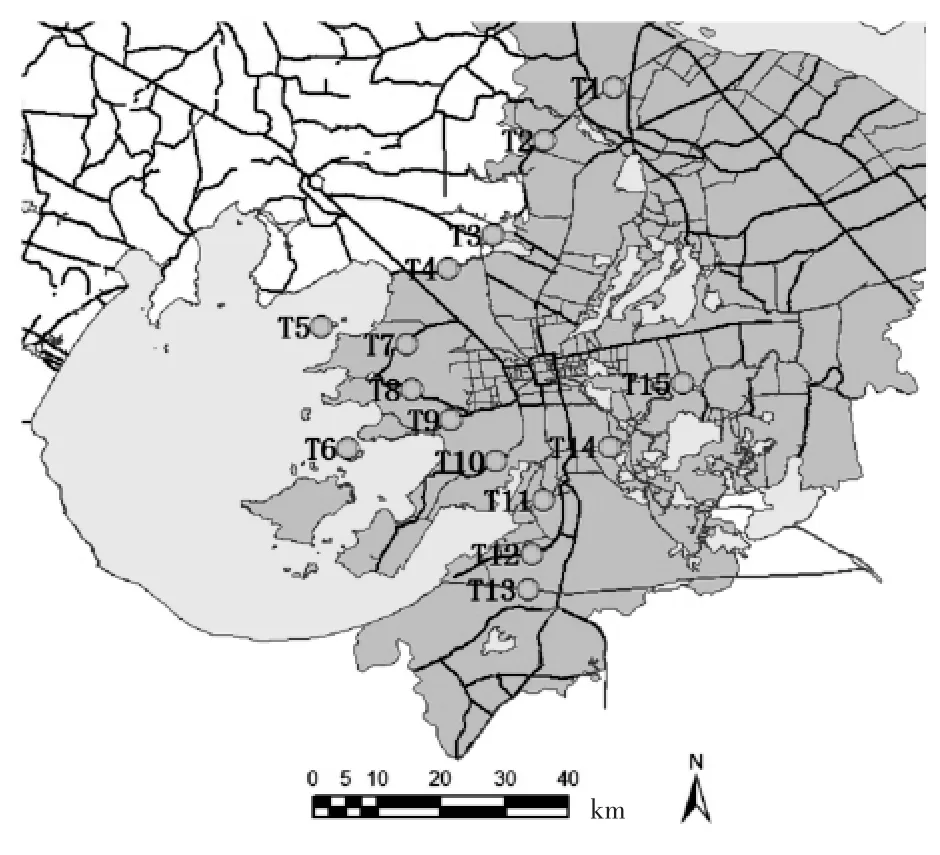
图1 太湖东部水域采样点分布
1.2 样品采集
1.2.1 水质检测
现场使用便携式水质分析仪 (YSI Professional Plus,Yellow Springs,OH,USA)测定pH 值、水温(T)、溶解氧(DO)、浊度(NTU)和电导率(Cond)等;透明度(SD)用塞式透明度盘测定。 实验室测定水样用采水器采集水下50 cm 及湖底以上50 cm 处水样,混匀取1 L,密封立即运回实验室分析测定总氮(TN)、总磷(TP)、氨氮(NH3-N)、五日生化需氧量(BOD5)、高锰酸盐指数(CODMn)、化学需氧量(CODCr)以及叶绿素a(Chla)等指标,样品保存及测定方法均参考《水和废水监测分析方法(第4 版)》(国家环境保护总局,2002)[22]。
1.2.2 着生硅藻采样
将硅藻计(菲迪环境GZJ1-10)放置于采样点1个月后取样, 用毛刷或硬胶皮将基质上所着生的藻类及其他生物,全部刮到盛有蒸馏水的玻璃瓶中,并用蒸馏水将基质冲洗多次,用鲁哥氏液固定,定容至30 mL 备用。 采样方法及样品保存方法均参考《水和废水监测分析方法(第4 版)》。
1.2.3 数据分析
根据着浮游硅藻多度数据计算各采样点Shannon-Wiener 多样性指数H′, 采用Mcnaughton优势度指数来判定优势种的组成,选取Mcnaughton优势度指数(Y >0.02)的藻类为优势种[23]。
Shannon-Wiener 生物多样性指数按下式计算:

式中:s 为样品中的种类数;ni为样品中第i 种生物的个体数;n 为样品中生物总个体数;ni/n 为第i 种藻类的细胞数占所有藻类总细胞数的比值;fi为第i种藻类在样点中出现的频率。
根据PETR 等[24-26]对Canoco5 软件使用方法的说明,将藻类数据和水质数据导入Canoco 5 进行初步分析, 保留可以进一步分析的水质数据(forward selection results)进行约束(constrained)分析。根据项目效应(term effects)结果,综合简单效应结果(simple effects)和附条件的效应结果(conditional effects)选取水质因子进入RDA 分析。 进行冗余分析(Redundancy Analysis,RDA)分析时,除pH 值外的所有水体理化数据和着生藻类相对多度数据均进行数据对数转换[lg(x+1)]。以上分析在Canoco5 上进行,浮游藻类群落结构图ArcMap 10.2.2 上完成.
2 着生硅藻群落结构分析
太湖东部水体出入湖河道及太湖水体中共鉴定出着生藻类4 门63 属, 其中硅藻门32 属80 种,蓝藻门9 属,裸藻门1 属,绿藻门21 属。硅藻群落中分类单元最多的种属为舟形藻属(Navicula)10 种、异极藻属(Gomphonema)12 种、菱形藻属(Nitzschia)13种。 优势种为两栖菱形藻(Nitzschia amphibia)、具球异极藻(Gomphonema sphaerophorum)、线形舟形藻(Navicula graciloides)、谷皮菱形藻(Nitzschia palea)、奇异菱形藻(Nitzschia paradoxa)、 胡斯特桥弯藻(Cymbella hustedtii)、窄异极藻(Gomphonema angustatum)、颗粒直链藻(Melosira granulata)、丝叶菱形藻(Nitzschia filiformis)、钝脆杆藻(Fragilaria brevistriata)、梅尼小环藻(Cyclotella meneghiniana)。
河道水体中的物种丰富度比湖体高, 物种数最多的点位为T13,T15 和T4, 分别为35 种、27 种和26 种;丰富度最少的点位为T6 和T11,均为11 种。着生硅藻密度没有明显的规律可循, 藻类密度平均值为6.35×105个/cm2, 大于107个/cm2有3 个,T5,T13 和T15; 小 于104个/cm2有2 个,T9 和T11。Shannon-Wiener 指数均值为2.87,入湖河道及湖体的Shannon-Wiener 指数值普遍大于3,而出湖河道的Shannon-Wiener 指数普遍在2 左右。 见表1。
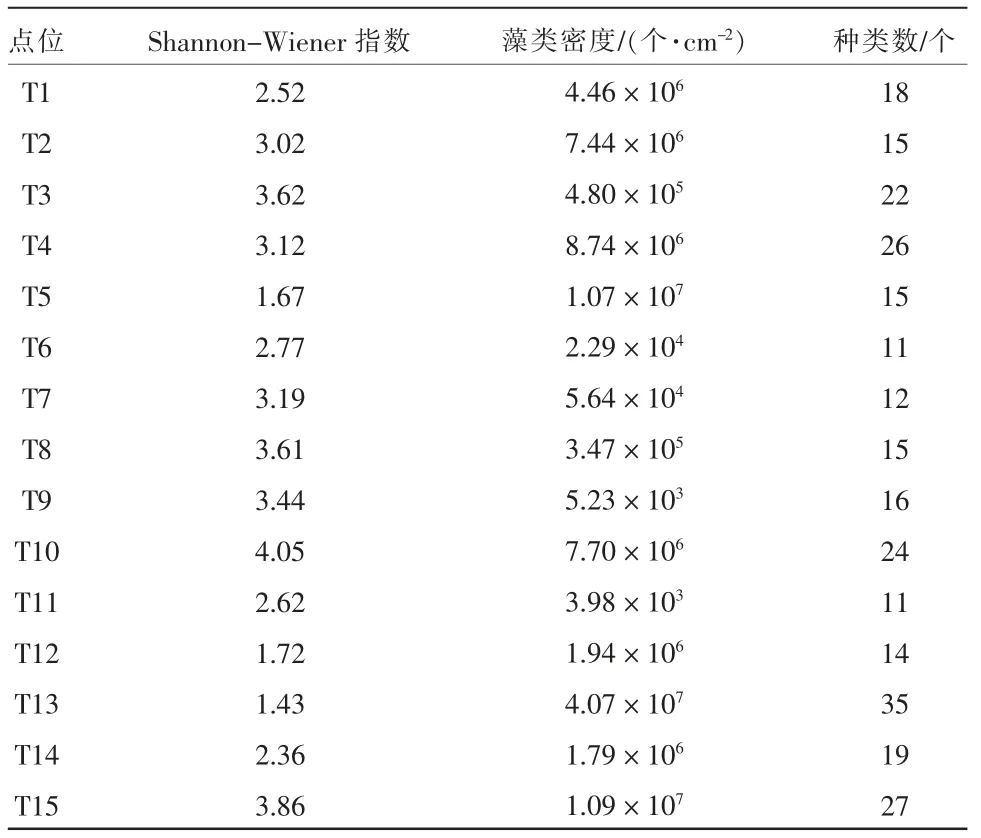
表1 各采样点位的Shannon-Wiener 指数、藻类密度和物种丰富度
3 着生藻类聚类分析
将处理后的藻密度数据采用Ward 方法,以Euclidean 距离对采样点位进行聚类分析[27],分析结果见图2。 组1 包含6 个点位,组2 包含9 个点位。组1 的点位多为湖体点位和距离湖体较近的出湖河道点位,优势种为胡斯特桥弯藻(Cymbella hustedtii)、颗粒直链藻(Melosira granulata)、肘状针杆藻(Synedra ulna)、具球异极藻(Gomphonema sphaerophorum)、钝脆杆藻(Fragilaria brevistriata)、尖针杆藻(Synedra acus)、新月形桥弯藻(Cymbella cymbiformis); 组2 的点位多为入湖河道点位和距离湖体较远的出湖河道点位,优势种为两栖菱形藻(Nitzschia amphibia)、具球 异极藻(Gomphonema sphaerophorum)、线形舟形藻(Navicula graciloides)、谷皮菱形藻(Nitzschia palea)、奇异菱形藻(Nitzschia paradoxa)、胡斯特桥弯藻 (Cymbella hustedtii)、 窄异极藻(Gomphonema angustatum)、 颗粒直链藻(Melosira granulata)、丝叶菱形藻(Nitzschia filifor-mis)、梅尼小环藻(Cyclotella meneghiniana)。 组1 的丰富度均值为13, 比组2 小9;2 组的Shannon-Wiener 指数均值差别不大分别为2.88 和2.86;组2 的藻密度均值约为组1 的5 倍。
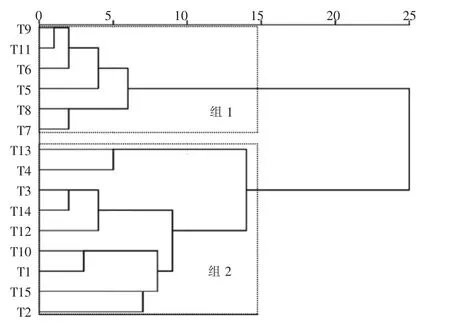
图2 根据藻类种类和密度进行采样点聚类分析
4 着生硅藻生态指示型分析
VAN D 等[28]通过分析硅藻生存环境中的pH 值、氧含量、盐度、水生环境腐殖度和营养状况建立了淡水硅藻生态指示值清单。按照指示清单,将2 组硅藻所对应的需氧量、 水生环境腐殖度和营养状况这3个生态指示类型进行统计, 计算了2 个分组不同生态类型物种的占比情况。 见表2(硅藻生态型分类及数据计算由OMNIDIA 6 完成)。 由表2 可知,从组1的硅藻类型主要为极度需氧型和需氧型, 组2 中的硅藻主要为中度需氧型和需氧型; 水生环境腐殖度指示结果表明,组1 硅藻主要是寡污型,其次是α-中度腐生型和β-中度腐生型, 组2 主要是α-中度腐生型和β-中度腐生型;组1 硅藻所指示的营养状况从寡营养型至富营养型均有分布, 富营养型相对较多,组2 所指示的营养状况则主要为富营养型。
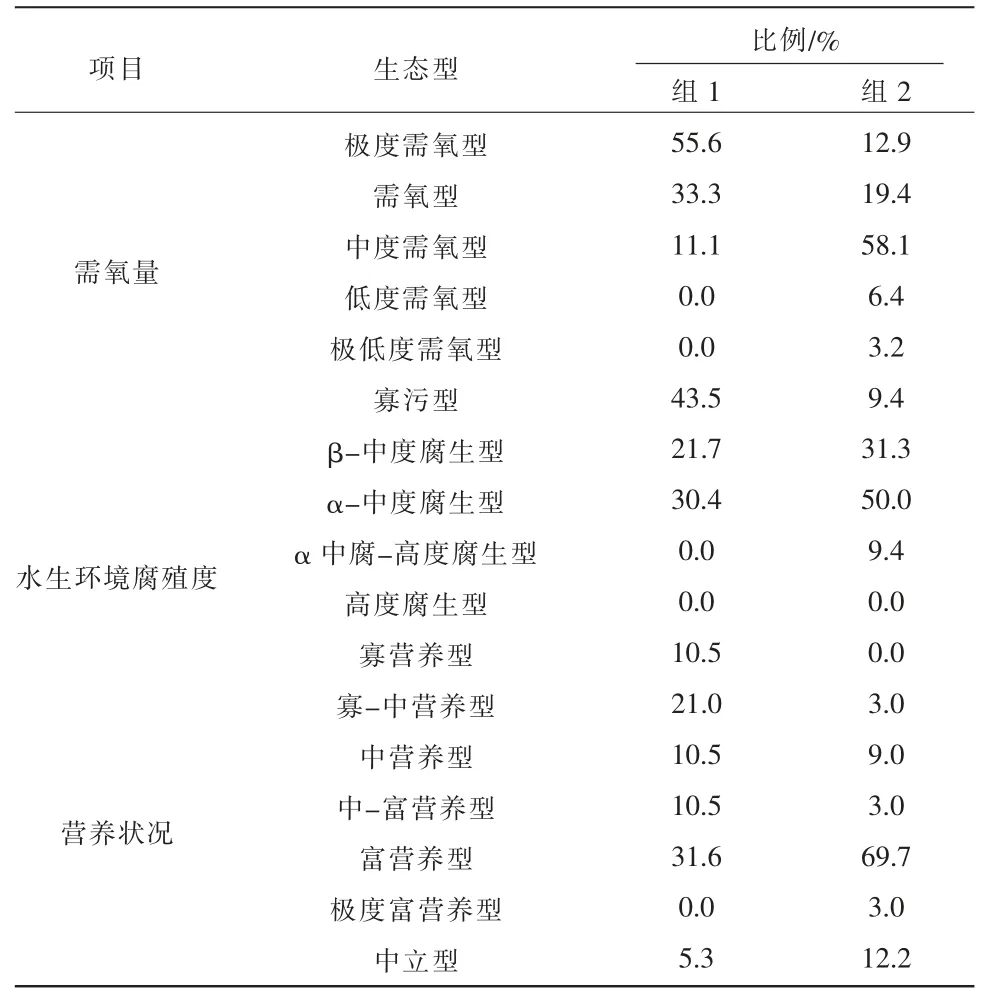
表2 各分组藻类生态型
5 环境因子分析
RDA 分析结果表明,影响藻类群落的主要环境因子为水温,TN,DO,CODCr,TP 和pH 值。 以上因子在个点位的分布见图3。 横坐标为点位信息,纵坐标为水质数据值,其中TP 值为实验测得结果乘以20。 将水质数据和着生藻类聚类结果进行综合分析,组1 和组2 的水温,pH 值和CODCr均值差别不大;组1 的DO 均值比组2 高1.56;组2 的TN 均值是组1 的2 倍,TP 是组1 的3 倍。
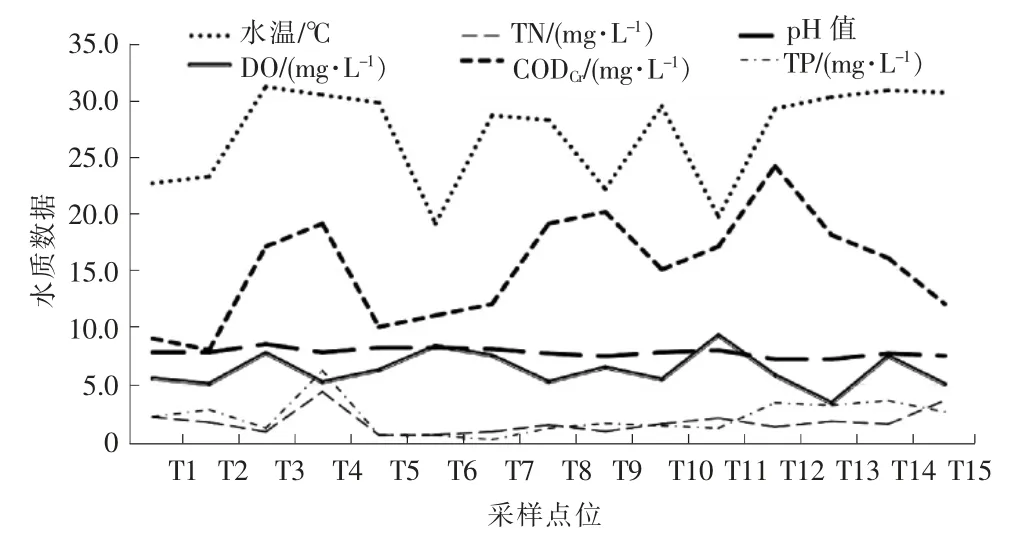
图3 各采样点位重要水质因子状况
6 环境因子与硅藻群落RDA 分析
根据Term Effects 筛选出影响15 个采样点位着生藻类分布的环境因子为DO,TP,TN,CDOCr, 见图4。 它们的解释度和P 值依次为DO(18.0%,0.004),TP(16.7%,0.016),TN(16.2%,0.01),CODCr(9.0%,0.184);影响组1 着生藻类分布的环境因子为水温,pH 值 和DO, 见 图5。 解释度和P值依次为T(38.5%,0.012),pH 值(19.2%,0.256),DO (17.9%,0.32);影响组2 着生藻类分布的环境因子为CODCr,TN,TP,见图6。解释度和P 值依次为CODCr(20.2%,0.042),TN(19.8%,0.027),TP(11.0%,0.348)。 结合环境因子分析和图4 可知全流域的TP,TN 及CODCr处于较高水平,组1 中的点位T5,T6,T7 和T11 与DO 相关性较大,组2 中的点位和TP,TN 及CODCr的相关性较大(本文RDA 分析根据Term Effects 筛选,首先将所有的环境因子和每个点位的藻类进行分析,再从中选取解释度和P 值高的即为影响藻类分布的主要环境因子)。
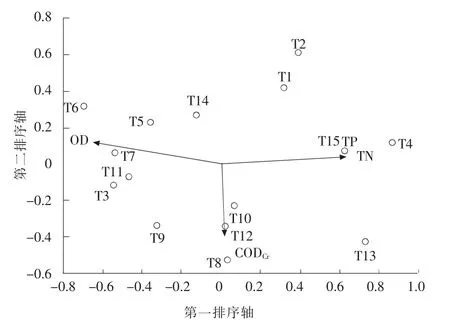
图4 15 个采样点位藻类与环境因子RDA 分析
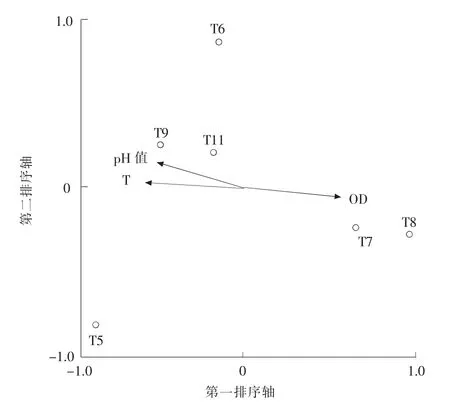
图5 组1(远离湖体点位)藻类与环境因子RDA 分析
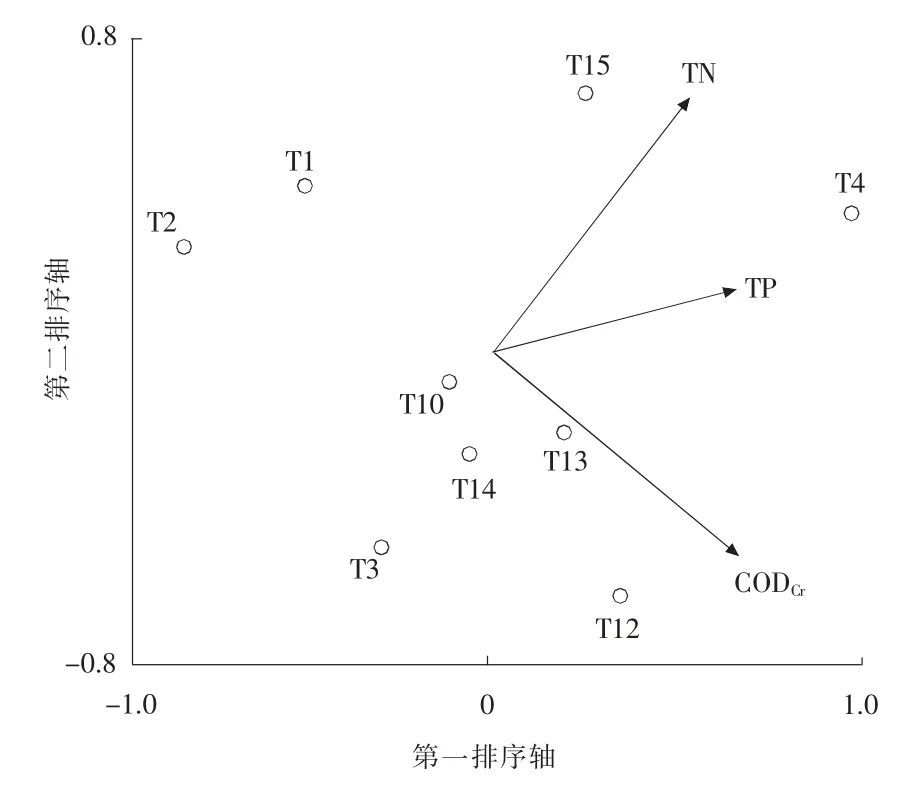
图6 组2(近湖体点位)藻类与环境因子RDA 分析
7 讨论
太湖的出入河道众多,其中望虞河作为“引江济太”的主要输水通道,对太湖主要区域水体交换的影响起着至关重要的作用[29]。 入湖河道增加了太湖的流动性、减少了太湖的换水周期,也给太湖环境治理带来了新挑战。 朱伟等[30]认为河水中大量营养盐进入太湖,磷大多数以颗粒态存在并沉积在湖泊中,在适宜条件下释放入水体。
本次的研究表明, 影响太湖主要出入湖河道着生硅藻群落的环境因子为DO,TP,TN,CODCr。 基于着生硅藻的群落结构特征, 将太湖河道着生藻类群落划分为2 个类群。 组1 的点位多为湖体点位和距离湖体较近的出湖河道点位, 组2 的点位多为入湖河道点位和距离湖体较远的出湖河道点位。
对2 组着生硅藻的生态指示型进行分析, 组1硅藻所指示的营养状况从寡营养型至富营养型均有分布, 组2 所指示的营养状况则主要为富营养型。RDA 结果表明影响组1 和组2 着生藻类分布的环境因子分别为水温,DO,pH 值,CODCr,TN 和TP。 水质指标也印证了硅藻的分组结果, 组1 的DO 均值优于组2;组2 的TN 和TP 均值是组1 的2 倍以上。黄漪平[2]的研究表明太湖主要的外源污染来自河流,人们生产生活产生的污染物质经由河道输入到湖泊中。 本研究的结果显示入湖河道的CODCr,TN,TP 等水质因子比湖体中高, 近湖体的河道水质与湖体相差不大, 而离湖体较远的河道水质因子比湖体低也表明太湖具有一定的自我净化能力,。
由于受限于采样次数和采样点位量, 本研究难免有不足之处,在今后的工作中不断收集、汇总并分析,以期能够更真实、更准确的反映硅藻和水质的关系。

