长江口不同来源溶解有机质光化学/微生物降解作用及机制研究❋
王新科, 金 红, 梁生康❋❋, 马浩阳, 郭金强, 李姗姗, 吕浩然
(1.中国海洋大学化学化工学院, 山东 青岛 266100; 2.中国海洋大学海洋化学理论与工程技术教育部重点实验室, 山东 青岛 266100;3.山东省青岛生态环境监测中心, 山东 青岛 266003)
溶解有机质(DOM)是海洋生态系统中最大的活性碳储库之一,被认为是海洋生态系统物质和能量的重要载体。河口区作为陆海交互界面,该区域DOM的源-汇作用和生物地球化学过程对全球碳循环有着重要影响。据估计,每年全球大约有0.25×1015g溶解有机碳(DOC)[1]通过河流从陆地转运到海洋,而在这个过程中,大部分陆源DOM会在河口区被移除。光化学反应和微生物降解被认为是控制河口区DOM转化、降解和循环的主要作用[2]。
实际水体中,DOM的光化学反应和微生物作用是同时发生并相互交织。河口区的陆海相互作用复杂,两种过程对河口DOM去除的相对贡献因DOM的来源不同而有很大差异。对于密西西比河[3]与亚马逊河口区[4]的陆源DOM,光化学去除作用要高于微生物降解;而对于海源DOM的去除,微生物降解则占主导,而光化学降解作用并不明显[5]。这是由于光化学作用和微生物作用对DOM的成分会有选择性的移除。陆源DOM中,含有大量有色溶解有机物(CDOM),其主要成分为芳香族化合物,易于吸收紫外线(UV)而发生光化学作用[3];微生物则易于吸收利用中性糖和氨基酸等物质,这些往往是海源DOM的重要组成部分。研究表明,光化学作用不仅可以将DOM直接转化为各种无机态[6-7],而且也可以通过改变DOM化学构成,将大分子物质转化为易于被微生物利用的小分子有机物,从而间接增强DOM的微生物矿化作用[8-10]。也有研究表明,光化学过程中UV会损伤微生物,降低其丰度,从而导致DOM的微生物矿化作用被抑制[11-12]。由于河口区陆海交互作用强烈,DOM来源和构成复杂多样,光化学降解和微生物降解作用在DOM去除中是协同还是竞争关系,尚缺乏系统认知。
本文以长江口为研究区域,同步开展陆源、海源及混合源的DOM的光降解、微生物降解、光-微生物联合降解以及光-微生物依次降解的现场培养试验。通过比较分析不同来源DOM和不同降解体系中DOC浓度,DOC重要组分TDAA以及CDOM特征参数的变化,探讨长江口不同来源DOM的光/微生物降解作用及其机制。
1 材料和方法
1.1 样品采集与试验设计
于2018年8月长江口,根据水体盐度, 分别在A1、B1和C1位置采集表层水样,三个站位的盐度分别为0.01、17.34和33.25(见图 1),分别代表陆源、混合源和海源。水样被采集后,分别经过孔径 1.2 μm GF/C 滤膜(Whatman UK)和 0.2 μm 聚碳酸酯滤膜(Mil-lipore)过滤, 得到接种水和无菌水。培养试验分为四组(见表1),分别考察不同来源的DOM的光降解、微生物降解、光-微生物联合降解、光-微生物依次降解作用。除了光-微生物依次降解培养体系外,均为双样平行培养,培养实验过程中,通过自吸水泵不断抽取现场海水注入培养箱中以维持培养温度与现场海水水体温度一致,在长江口附近海域进行培养以保证光照强度和性质与实际水体光照条件接近,现场记录温度、光照等参数。光-微生物依次降解培养为实验室培养箱恒温条件下(25 ℃)进行的培养。培养第0、3、5、8和 12 d分别取各培养体系样品。
图1 长江口不同来源溶解有机质的取样和光/微生物降解培养站位Fig.1 Sampling and photo-/microbial degradation incubation stations of dissolved organic matter from different sources in Changjiang estuary
所取水样立即用GF/F 滤膜(0.7 μm,Whatman UK)过滤,然后分装于入40和60 mL的棕色色谱瓶中,分别用于测定CDOM、DOC和TDAA等参数。其中,用于测定CDOM的水样0~4 ℃保存,用于DOC和TDAA测定的水样在-20 ℃下保存。所有的棕色色谱瓶和玻璃滤器在使用前,都先经过盐酸浸泡 24 h,然后用Milli-Q清洗3~6次,再在马弗炉中450 ℃下灼烧4 h。玻璃滤膜使用前在马弗炉中450 ℃下灼烧4 h。
1.2 样品分析方法
DOC是用高温催化氧化(HTCO)方法进行测定[13],所用仪器是日本岛津公司的TOC-VCPH型TOC分析仪。将过滤后的水样加入6 mol·L-1的盐酸酸化到pH为2左右,然后用高纯氧除去无机碳,进样后在温度为680~700 ℃和以Pt/Al2O3作催化剂的条件下,将有机碳氧化成CO2分析测定。每个样品平行进样3~5次保证分析误差通常低于2%。
CDOM样品从冷藏室取出后,首先避光自然恢复至室温,然后经孔径 0.2 μm 的聚碳酸酯滤膜(Millipore)再次过滤方可用于测定。CDOM测定仪器为日本岛津公司3600 Plus型紫外可见双光束分光光度计,将过滤后的水样置于 10 cm石英比色皿,Milli-Q水作为空白参比,在 250~800 nm波长下扫描测定[14]。

表1 长江口光/微生物降解培养试验设置
总溶解氨基酸(TDAA)应用邻苯二甲醛(OPA)柱前衍生法进行测定[15]。所用仪器为美国安捷伦公司的1260型高效液相色谱仪,检测器为荧光检测器,其激发波长和发射波长分别设定为330和450 nm,检测的精密度为3%~5%。根据标准氨基酸样品的保留时间确定氨基酸种类,而根据氨基酸的标准曲线和样品峰面积可以定量的计算氨基酸浓度,共测定13种氨基酸,分别为Asp(天冬氨酸)、Glu(谷氨酸)、Ser(丝氨酸)、His(组氨酸)、Arg(精氨酸)、Gly(甘氨酸)、Thr(苏氨酸)、Ala(丙氨酸)、Tyr(酪氨酸)、Val(缬氨酸)、Phe(苯丙氨酸)、Ile(异亮氨酸)和Leu(亮氨酸)。
1.3 数据处理和特征参数计算方法
CDOM在350 nm波长处具有最高的吸收率[16],因此通常用在波长350 nm处的吸收系数(a350)表征CDOM浓度。a350可根据公式(1)计算[17]:
aλ=2.303Aλ/L。
(1)
其中:Aλ为吸光度;λ为波长;L为比色皿长度。
光谱斜率(S)可以指征DOM平均分子量的大小,其值与DOM的加权平均分子量呈负相关[18]。 S可由公式(2)计算[17]:
aλ=aλ0eS(λ0-λ)。
(2)
aλ和aλ0分别为水样在波长λ和λ0处的吸收系数,而在本研究中所使用的光谱斜率范围为275~295 nm,即 S275-295。
TDAA(%DOC)为总溶解态氨基酸的碳摩尔占比,其值可用于表示DOM被微生物可利用性程度的高低,其值越大,DOM的微生物可利用性越高。TDAA(%DOC)根据公式(3)计算[19]:
TDAA(%DOC)=(TDAA-C)/DOC×100%。
(3)
2 结果与分析
2.1 不同来源DOC组成和光学特征
A1、B1和C1的盐度分别为0.01、17.34和33.25,根据长江口水体分区[20], 分属于河口端、混合区和外海区,其水文和化学参数相差较大(见表2)。A1、B1和C1站位水体DOC的初始浓度依次减小,分别为149.75、113.40和94.52 μmol·L-1,与Yu等[20]的报道结果基本一致。CDOM光学特征参数a350值从陆源到海源减小。其中A1站位CDOM的a350值为2.04 m-1,呈现出显著的陆源特征[21];C1站位a350值为0.27 m-1,呈现出明显的海源特征[22-23]。

表2 长江口培养站位的水文与化学参数
TDAA的浓度从陆源到海源减小,但不同来源TDAA的构成有所差异(见图2)。对于A1站位,其中Gly摩尔占比最高,达到33%;然后依次为Ala、Asp,摩尔占比在10%以上,再次为Glu、Thr、Ser、Phe、Leu,摩尔占比在5%~10%之间,其余氨基酸摩尔占比较低,不足5%,表明该站位具有明显的陆源DOM特征[24]。对于C1站位,尽管Gly摩尔占比最高,为17%,但远低于陆源DOM;其次为Ser、Thr、Leu、Val、His、Ile,摩尔占比在5%~10%之间,其余氨基酸摩尔占比较低,不足5%,表明该站位具有显著的浮游植物自生的海源DOM特征[25]。 对于B1站位,Gly在TDAA中的摩尔占比则介于陆源DOM和海源DOM之间,具有混合源的特征。
2.2 光化学/微生物降解过程中DOC浓度和组成及特征光学参数的变化
2.2.1 培养期间光照和温度等环境因子的变化 船基不同来源DOM的光降解、微生物降解、光-微生物联合降解培养试验在8月9~21日进行,温度为23~27 ℃,在午间(10:00~15:00)光照强度和光合有效辐射(PAR)分别保持在100 000~160 000lux和949~1 440 μmol·m-2·s-1之间。随后在8月22日~9月3日进行的光-微生物依次降解培养周期内,温度基本保持在(25±1) ℃。

图2 长江口陆源、混合源和海源溶解有机质中氨基酸摩尔占比Fig.2 The molar ratio of amino acids in the terrestrial, mixed and marine dissolved organic matter of the Changjiang estuary
2.2.2 DOC浓度变化 长江口不同培养试验体系中DOC变化如图3所示。对于光降解培养体系,在12 d的光照试验中,陆源DOC浓度均值从149.75 μmol·L-1降低到138.38 μmol·L-1,降解率为(7.6±5.2)%;而海源和混合源的DOC浓度在整个培养试验周期中变化不大。对于微生物降解培养体系,陆源、混合源和海源DOC都发生明显降解,降解率依次增大,分别为(3.8±2.0)%、(17.4±7.8)%和(17.5±4.3)%。对于光-微生物联合降解培养体系,混合源DOC浓度明显降低,降解率为(10.2±2.0)%;海源和陆源DOC浓度则没有呈现明显变化。对于光-微生物依次降解培养体系,陆源、混合源和海源DOC浓度均明显降低,降解率依次为8.5%、7.0%和6.7%。

(“PD”和 “BD”分别表示光降解体系和微生物降解体系;“PD+BD”表示光-微生物联合降解体系;“PD→BD”表示光-微生物依次降解体系。“PD” and “BD” stand for photodegradation system and microbial degradation system, respectively; “PD+BD” represents a synchronous system of photo-and microbial degradation.“PD→BD” represents the sequential system of photo-and microbial degradation.)
2.2.3 CDOM特征参数的变化 不同培养试验体系中a350值的变化如图4所示。对于光降解培养体系,陆源、混合源和海源的a350值均随着培养时间增加显著下降,表明各培养体系中CDOM发生显著降解。其中,陆源CDOM降解率最高,达到(70.2±1.6)%,混合源和海源的CDOM降解率相近,分别为(48.8±4.8)%和(46.2±1.7)%;光-微生物联合降解培养体系中a350变化与光降解培养体系相似,陆源、混合源和海源CDOM的降解率依次降低,分别为(70.3±1.6)%、(52.8±7.1)%和(26.8±14.8)%。与光降解培养体系和光-微生物联合降解培养体系不同,对于微生物降解和光-微生物依次降解培养体系,无论是陆源,还是混合源和海源,其a350值没有明显降低,表明CDOM浓度也未明显变化趋势。
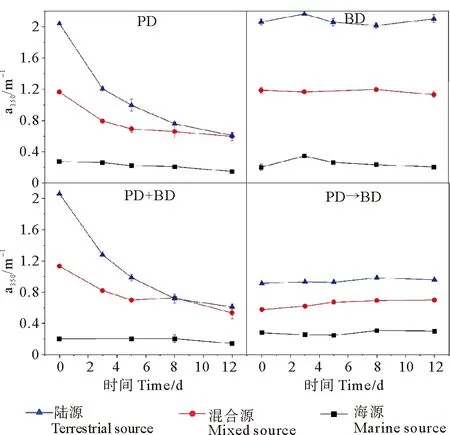
(“PD”和 “BD”分别表示光降解体系和微生物降解体系;“PD+BD”表示光-微生物联合降解体系;“PD→BD”表示光-微生物依次降解体系。“PD” and “BD” stand for photodegradation system and microbial degradation system, respectively; “PD+BD” represents a synchronous system of photo-and microbial degradation.“PD→BD” represents the sequential system of photo-and microbial degradation.)
进一步分析不同培养体系中CDOM的特征光谱参数S275-295的变化(见图5)。可以看出,对于光降解和光-微生物联合降解培养体系,随着CDOM浓度下降,陆源、混合源、海源的CDOM光谱斜率S275-295均明显上升,表明这些体系中DOM的分子量显著降低;对于微生物降解和光-微生物依次降解培养体系,不同来源的CDOM光谱斜率S275-295值均无明显的变化,表明这两个培养体系中DOM分子量未发生显著变化。
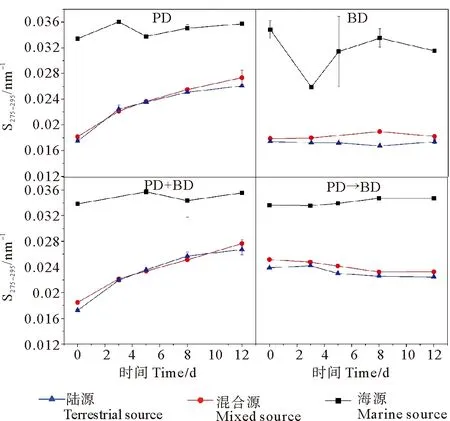
(“PD”和 “BD”分别表示光降解体系和微生物降解体系;“PD+BD”表示光-微生物联合降解体系;“PD→BD”表示光-微生物依次降解体系。“PD” and “BD” stand for photodegradation system and microbial degradation system, respectively; “PD+BD” represents a synchronous system of photo-and microbial degradation.“PD→BD” represents the sequential system of photo-and microbial degradation.)
2.2.4 氨基酸构成和浓度的变化参数 不同培养体系中氨基酸浓度的变化如图6所示。对于光降解培养体系,陆源、混合源和海源DOM中TDAA浓度都有所降低,降解率分别为27.8%、9.3%和16.2%,TDAA的降解主要发生在3~8 d,即培养周期的中后期。对于微生物降解培养体系,陆源、混合源、海源DOM中的TDAA降解率明显高于光降解培养体系,分别为25.5%、24.4%和40.3%, TDAA的降解主要发生在培养前期,即0~5 d内。对于光-微生物联合降解培养体系,仅有海源DOM中的TDAA浓度明显降低,降解率为42.4%,而陆源和混合源DOM中的TDAA浓度则未明显降低。对于光-微生物依次降解培养体系,陆源、混合源和海源DOM中的TDAA浓度也都显著降低,降解率分别为46.3%、33.6%和19.9%。
不同培养体系中TDAA(%DOC)的变化特征基本上与TDAA相似(见图7)。对于光降解、微生物降解和光-微生物依次降解培养体系,随着培养时间增长,陆源、混合源、海源的TDAA(%DOC)均明显降低。光-微生物联合降解培养体系中,陆源和混合源DOM中的TDAA(%DOC)值无明显变化,而海源DOM中TDAA(%DOC)值则明显下降。

(“PD”和 “BD”分别表示光降解体系和微生物降解体系;“PD+BD”表示光-微生物联合降解体系;“PD→BD”表示光-微生物依次降解体系。“PD” and “BD” stand for photodegradation system and microbial degradation system, respectively; “PD+BD” represents a synchronous system of photo-and microbial degradation.“PD→BD” represents the sequential system of photo-and microbial degradation.)
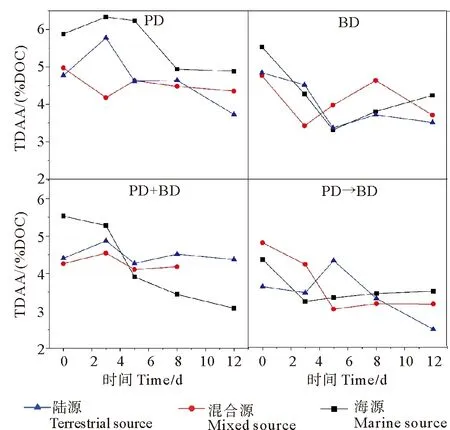
(“PD”和 “BD”分别表示光降解体系和微生物降解体系;“PD+BD”表示光-微生物联合降解体系;“PD→BD”表示光-微生物依次降解体系。“PD” and “BD” stand for photodegradation system and microbial degradation system, respectively; “PD+BD” represents a synchronous system of photo-and microbial degradation.“PD→BD” represents the sequential system of photo-and microbial degradation.)
进一步分析不同培养体系中氨基酸构成变化(见图8)。对于微生物降解培养体系,陆源和海源的TDAA中Gly摩尔占比上升,Glu、Thr、Val的摩尔占比下降。对于光降解培养体系,陆源和混合源的TDAA中Phe摩尔占比出现明显的下降。
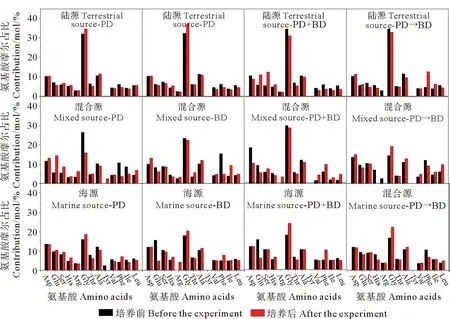
(“PD”和 “BD”分别表示光降解体系和微生物降解体系;“PD+BD”表示光-微生物联合降解体系;“PD→BD”表示光-微生物依次降解体系。“PD” and “BD” stand for photodegradation system and microbial degradation system, respectively; “PD+BD” represents a synchronous system of photo-and microbial degradation.“PD→BD” represents the sequential system of photo-and microbial degradation.)
3 讨论
3.1 不同来源溶解有机质的光降解和微生物降解及影响因素
长江口为典型的大河控制下的河口区域。本研究培养试验在长江口所采集的A1和C1站位的水样中DOM具有明显的陆源和海源特征,而B1站位DOM则既受到陆源又受到海源的影响,可以作为混合源。不同来源DOM对光化学降解和微生物降解作用的敏感性不同,这与其化学构成密切相关。
对于陆源DOM,DOC的光降解明显高于微生物降解,表明陆源DOM对光降解更为敏感,这与Amon和Benner[4]在亚马逊河的研究结果一致。在12 d光照过程中,约70%陆源CDOM被移除,远高于DOC的移除比例,表明在光降解中CDOM是被主要移除组分。这是由于陆源河流DOM主要来自土壤中老化的维管植物的被分解物[26],已经经过长时间的矿化作用,残留物以难被微生物降解的芳香族化合物为主,如木质素、腐殖质等,这些物质具有苯环及共轭结构等光敏基团,易吸收紫外光而发生光化学漂白。光降解过程中,光辐射能够破坏CDOM 的高分子聚合结构,使其裂解形成小分子量化合物或者分解为无机物,如CO、CO2等[27]。Spencer等[28]在刚果河57 d的长期光降解实验发现,CDOM降解主要发生在0~15 d,之后随降解周期增长略有增大,最终约85%~95%的CDOM被光解,表明CDOM的光降解率与培养时间密切相关。在陆源DOM光降解过程中,除CDOM外,氨基酸构成和含量也发生明显变化,约有28%的TDAA被降解,证明氨基酸也对光降解敏感。其中,具有苯环结构的Phe是CDOM重要组分,其摩尔占比下降显著,表明在光照过程中Phe吸收紫外线而被降解[2]。
对于海源DOM,DOC的微生物降解明显高于光降解,表明海源DOM对微生物降解更为敏感。海源DOM主要来主自于细菌分解颗粒有机物(如衰败后的藻类细胞、藻类排泄物等)及浮游植物的初级生产[29],含有较多的氨基酸和碳水化合物,芳香性类化合物含量较低[30],不易发生光化学降解[31]但易被微生物降解。在12 d的微生物降解培养中,(17.5±4.3)%的海源DOC被降解,与Gan等[32]在长江羽状流区进行的DOM微生物降解结果基本一致,表明海源DOM具有较高的微生物可利用性。在12 d的培养周期中,TDAA的降解率高于DOC,TDAA(%DOC)的值持续减小,这与张桂成[33]在长江口的DOC微生物降解试验结果一致,表明氨基酸作为DOM中易被降解组分,较其他组分优先被微生物利用。TDAA中Gly摩尔占比高于降解前,表明Gly相对于其它氨基酸难于降解而相对被富集,这是由于Gly为革兰氏阴性细菌细胞壁的重要组成成分[34],难于被微生物所降解[35];而Glu、Thr、Val摩尔占比低于降解前,表明这类氨基酸相对易被微生物降解移除,这与Cowie 和 Hedges[36]研究结果基本一致。
对于混合源的DOM,其组成兼具海源和陆源特征,发生明显的光化学降解和微生物降解。其中,微生物降解培养体系中,混合源DOC降解率与海源接近,TDAA(%DOC)显著降低,表明微生物降解是混合源DOM的重要去除过程。这是由于长江口富营养化严重,初级生长力旺盛[37],新鲜生产有机质占比较高,易于被微生物降解。在光降解培养体系中,虽然混合源DOC总浓度未明显降低,但a350显著减小,表明CDOM被降解;另外,S275-295值增大,表明光化学作用可将大分子量的DOM转化为小分子的有机质。从氨基酸构成看,与陆源类似,Phe摩尔占比下降,表明光化学反应可以优先移除芳香氨基酸。
3.2 DOM光化学/微生物降解过程间的相互作用(DOM光降解作用对微生物降解作用的影响)
实际海水中,DOM同时经历光化学和微生物转化及降解作用。两者在DOM降解中存在相互竞争或协同的关系。这与DOM的来源和温度光照等环境因子密切相关。
本研究中,对于光-微生物联合降解培养体系,陆源和海源DOC浓度未明显降低,而混合源的DOC降解明显低于单独的微生物降解培养体系,表明此体系中,DOM的微生物降解被光化学反应所抑制,这与Benner和Biddanda[11]的研究结果基本一致。这一方面是由于日光中UV-B辐射会损伤水体中微生物[38];另一方面,光化学降解产生的活性氧物质直接损害生物的细胞膜,从而降低微生物活性[39]。与单独的光降解培养体系相似,不同来源DOM的光-微生物联合降解培养体系中CDOM浓度显著下降,分子量明显降低,表明光化学作用可以将DOM大分子有机物降解成小分子有机物。同时,海源的DOM中TDAA浓度在光-微生物联合降解培养过程中大幅下降,表明海源TDAA等具有高微生物可利用性,即使微生物在光抑制下,也可以利用和降解。Matallana-Surget等[40]发现海洋表层细菌对紫外线有较强的抵抗力,在光照下仍具有一定的活性。
对于光-微生物依次降解培养体系,陆源和混合源的DOM中CDOM含量及DOM分子量大大降低, TDAA的降解率大大高于微生物降解培养体系,表明光化学过程与微生物过程对DOM的降解具有协同作用。陆源DOM含有大量对光敏感的芳香族化合物,经光化学反应可以转化成易被生物利用的小分子有机物,光化学转化促进了陆源DOM的微生物降解作用。这与Obernosterer 和 Benner[5]在石壁湿地的研究结果基本一致,他们发现经过光化学反应后,陆源DOC微生物可利用性提高了7%。对于光-微生物依次降解培养体系中海源的DOM,由于CDOM含量低,对光化学转化和降解并不敏感,光化学作用并未促进DOM的微生物降解。
上述分析表明,光化学作用对DOM的微生物降解作用存在双重作用[12, 41],一方面光化学过程能将大量的难以被微生物降解的有机质转化成小分子化合物促进微生物降解;另一方面光化学过程中的紫外辐射和所生成的光活性自由基对微生物种群和丰度又具有抑制作用。光化学过程和微生物过程对DOM降解是相互抑制还是协同作用,不仅与DOM的来源和组成密切相关,而且与光化学-微生物作用方式密切相关。在实际河口区的表层水体中,光化学作用和微生物作用是同步发生同时进行的。随盐度梯度增大,不仅DOM的来源和组成变化显著改变,而且水体中颗粒物组成和含量、微生物种群和丰度等也会显著不同。这对DOM的光/微生物降解作用都有重要影响。其中,对于水体中颗粒物,随含量增大,会通过散射、吸收等过程减小水体中光透射率,在降低DOM的光化学作用的同时,也会导致表层水体中紫外线杀菌作用的减弱。需要将现场受控培养试验与现场调查结果密切结合,进一步深入分析DOM的光/微生物降解作用及机制。
4 结论
(1)不同来源DOM对光化学降解和微生物降解作用的敏感性不同,这与其化学构成密切相关。陆源DOM因富含难被微生物降解的芳香族化合物,易发生光降解而难微生物降解;海源DOM含有较多的氨基酸和碳水化合物,芳香性类化合物含量较低,易被微生物降解而难光降解;混合源DOM组成兼具陆、海源特征,光化学过程和微生物过程对其转化降解作用都较为明显。
(2)光化学过程和微生物过程同步作用体系中,陆源、混合源、海源DOM微生物降解被光化学反应抑制,这主要是由于光化学过程中的紫外辐射和所生成的光活性自由基抑制了微生物活动。光化学作用然后微生物降解体系中,光化学反应先将陆源和混合源中的大分子有机质转化成易被生物利用的小分子有机物,促进了DOM的微生物降解作用,二者对DOM的降解具有协同作用。
致谢:感谢赵美训教授提供这次长江口共享航次,让我们有机会进行样品采集和培养实验;感谢潘晓驹老师和张亚龙同学在测定CDOM时提供的帮助和支持。

