氧化石墨烯对2种海洋微藻的毒性效应研究❋
杜树豪, 孟范平, 张 倩, 彭晓玲
(中国海洋大学海洋环境与生态教育部重点实验室, 山东 青岛 266100)
近20年来,石墨烯基材料(GBMs)的生产和应用因其以下优点而发展迅速[1]:①改善生物材料的机械和电气性能;②能够在生物材料表面附着和生长;③可制备更高效的生物传感器。到2028年年底,预计全球GBMs市场将达到8亿美元,较2018年预计增长15倍[2]。常见的GBMs主要包括石墨烯(GS)、氧化石墨烯(GO)和还原型氧化石墨烯(rGO)。GO是石墨烯的氧化物,含有单层并以六元环排列的sp2杂化碳原子[3],其分子中含有羧基、羟基、环氧基等含氧官能团[3-4]而易于分散在水和其它有机溶剂中[3]。目前,GO因其优良的导电性能及良好的水溶性已被广泛应用于电子器件、催化氧化、生物技术以及作为工业生产中的表面活性剂,成为GBMs市场的最大组成部分[5-8]。同时,GO又是一种碳纳米材料(即三维空间中有一维的尺寸小于100 nm)。在GO大量应用过程中,将被释放到河流、水库、湖泊和海洋等水环境中,可能会增加环境风险水平,因此其生物安全性受到较多关注。
在水生生态系统中,微藻作为初级生产者具有重要地位,研究GO对微藻生长的影响及其机制对于评价GO的潜在毒性效应具有重要作用。目前,该方面的研究对象为淡水微藻。Nogueira等[9]研究认为,GO对羊角月牙藻(Raphidocelissubcapitata)生长的抑制可能是活性氧(ROS)产生和膜损伤(细胞活力)的结果,而GO在培养基中的团聚所引起的遮光效应也会降低藻细胞密度。Hu等[6]研究发现,GO浓度≥2.5 mg·L-1时,纤细裸藻(Euglenagracilis)细胞的丙二醛(MDA,逆境胁迫下脂质过氧化的产物)含量显著增加,并认为培养基中的GO以及包覆在藻细胞表面的GO均会引起遮光效应从而降低微藻对光的利用。Zhao等[10]在研究GO对蛋白核小球藻(Chlorellapyrenoidosa)的致毒机理时发现,培养基中GO的遮光效应对微藻生长抑制的贡献率约为16.4%;GO造成细胞膜完整性明显下降则是由氧化逆境和物理性穿透共同作用所致。然而,目前尚未见到有关GO对海洋微藻毒性的研究报道。已有研究证实,离子强度增大可以促进GO团聚[11]。那么海水背景下GO对微藻的毒性程度和机理可能与淡水环境有所不同。为此,本研究拟在测定GO对2种海洋微藻(盐生杜氏藻Dunaliellasalina和海洋微拟球藻Nannochloropsisoceanic)的半抑制浓度(EC50)基础上,根据暴露期间微藻的生理学指标(GSH、GPx、GR、GST、MDA、光合色素)以及细胞形态、超微结构的变化,分析其致毒机制,为GO的海洋生态风险评价及其排放控制提供依据。
1 材料与方法
1.1 材料
GO分散液(深棕色,浓度10 000 mg·L-1):购自中国山东省济宁利特纳米技术有限责任公司,采用改进Hummer’s法合成,pH 5~7,纯度>99.9%,单层率>99%,Mn含量小于10 mg·L-1。
微藻:海洋微拟球藻(Nannochloropsisoceanic)购自中国科学院海洋研究所,盐生杜氏藻(Dunaliellasalina)购自中国海洋大学微藻种质库。两种微藻均采用F/2培养基[12]进行培养。
海水:取自青岛市石老人海域(pH=7.90±0.02、盐度30),使用前经 0.45 μm 醋酸纤维滤膜抽滤,121 ℃下灭菌20 min后冷却备用。
试剂:测定蛋白质、谷胱甘肽过氧化物酶(GPx)、谷胱甘肽还原酶(GR)、丙二醛(MDA)的试剂盒购自南京建成生物工程研究所。1-氯-2,4-二硝基苯(CDNB)、谷胱甘肽(GSH)为Sigma公司产品。NaH2PO4、Na2HPO4、丙酮等试剂均为国产分析纯。邻苯二甲醛(OPT)为国产化学纯。
1.2 方法
1.2.1 GO的粒径测定及其在蒸馏水和培养基中的形态观察 分别向蒸馏水和F/2培养基中加入GO分散液,使GO浓度均为100 mg·L-1,超声(JY92-II型,中国宁波新芝)振荡1 h后,在激光粒度分析仪(Nano S90型,英国马尔文公司)上测量GO粒径;在透射显微镜(JEM-2100型,日本电子株式会社)下观察GO形态。
1.2.2 微藻生长抑制试验与72 h半抑制浓度(72 h EC50)计算 在125 mL的F/2培养基中加入GO分散液,使其浓度分别为0、1、10、50、100和150 mg·L-1,每组3个平行,150 W超声处理1 h后,接种指数生长期的微藻(初始浓度约5×105cells·mL-1)。培养条件为:温度(25±1)℃、光强80 μmol·(m2·s)-1、光暗比12 h∶12 h。在定轨振荡光照培养箱(PGX-250D-LED型,江苏天翎)中培养72 h,转速为100 r/min。每隔24 h,在显微镜(YS2-H型,日本尼康)下观察计数,计算藻细胞密度(D,106cells·mL-1),结果以(平均值±标准差)表示。
绘制每种微藻的72 h生长曲线,按公式(1)计算各处理浓度对应的藻细胞生长抑制百分率(I),采用概率单位法[13]得到GO浓度对数(x)—概率单位(y,由百分数换算得到)的关系方程。当概率单位为5.0时,计算得到72 h EC50。
(1)
式中:I为藻细胞生长抑制百分率;Ac、At分别为对照组、处理组的生长曲线与坐标轴包围面积。
1.2.3 微藻的扫描电镜和透射电镜观察 在1.2.2节的暴露培养结束后,分别吸取对照组和GO100 mg·L-1处理组的藻液,在4 ℃、1 000 r·min-1下离心15 min,藻泥用于扫描电镜和透射电镜观察。
(1)扫描电镜观察:用于清晰显示藻细胞形态以及GO团聚体在其表面的附着情况。参照Chen等[14]的方法,向藻泥中加入2.5%戊二醛固定,用PBS(pH=7.8,0.1 mol/L)清洗3次;然后用酒精梯度脱水(30%、50%、70%、80%、100%),每次10 min;干燥后用喷金镀膜,置于扫描电镜(SEM,JSM-840型,日本电子株式会社)下观察。
(2)透射电镜观察:按照(1)的步骤将藻泥用戊二醛固定后,在含1%锇酸的PBS中固定90 min,再用系列浓度的丙酮(10%~100%)逐级脱水。经环氧树脂渗透、包埋后,用超薄切片机切片和柠檬酸铅染色,置于透射电镜(TEM,H-7650型,日本日立公司)下观察拍照[15]。
1.2.4 GO暴露下微藻的GSH及相关酶、MDA测定 对于1.2.2节中的对照组和GO浓度为10、100 mg·L-1处理组,培养结束后分别收集藻液100 mL,于4 ℃、5 000 r·min-1下离心15 min,弃上清液,向藻泥中加入PBS(pH=7.8,0.1 mol·L-1)重悬浮后,用超声波细胞破碎仪破碎30 min(120 W,间歇、工作各5 s,冰浴),在4 ℃、1 000 r·min-1下离心15 min,上清液用于以下指标测定。
(1)GSH含量和GST活性测定
GSH:分子荧光光度法[16]。在碱性介质中,OPT与氨基酸、肽反应生成荧光化合物,当激发波长为350 nm,发射波长为430 nm时,在一定范围内荧光强度与GSH浓度呈线性关系。根据GSH浓度-荧光强度标准曲线,计算样品中的GSH浓度(mg·mL-1),进而转换为每g组织蛋白中GSH含量,单位为mg/gprot。
GST:参照Habig等[17]的方法。原理为:GST能够催化GSH与CDNB反应生成1-巯基-2,4-二硝基苯(GS-DNB)。在波长340 nm下,通过测定吸光度变化率计算GST活性。酶活力单位为nmol/(min·mg)prot。
(2)GPx(U/mgprot)、GR活性(U/mgprot)和MDA(nmol/mgprot)、蛋白质含量(g·L-1):均采用南京建成生物工程研究所生产的试剂盒测定。
1.2.5 光合色素含量测定 取1.2.2节培养结束后的对照组和GO浓度10、100 mg·L-1处理组藻液各2 mL,2 500 r·min-1离心15 min,弃上清液后,加入2 mL 80%的丙酮,黑暗处抽提24 h,再以2 500 r·min-1离心15 min,取上清液测定663、646和470 nm处的吸光值(OD),根据公式(2)~(5)[18]计算叶绿素a(Chla),叶绿素b(Chlb),总叶绿素(Chl(a+b))和类胡萝卜素(Car)含量,单位为μg·(106cells)-1)。公式中,D为藻细胞密度(106cells·mL-1):
(2)
(3)
(4)
(5)
1.3 数据统计与分析
在GO对微藻的生长抑制试验和毒理学试验中,每个处理组及对照组各设置3个重复,结果以3个重复实验值的(平均值±标准差)表示。通过单因素方差分析(ANOVA)及Tukey’s post-hoc多重比较检验,进行差异显著性分析,统计显著性水平为p<0.05,数据统计分析使用SPSS 18.0软件。
2 结果与分析
2.1 GO的粒径分布及其在培养基中的形态
由图1(A)可见,GO在纯水中分散均匀,呈薄片状,无团聚现象;但是,在离子强度较高的F/2培养基(介质为海水)中,GO出现严重团聚现象,颜色加深(见图1(B))。粒度分析结果表明,本研究所用GO的粒径大多处于200~400 nm之间(见图1(C))。

图1 GO在蒸馏水(A)、F/2培养基(B)中的TEM图以及GO的粒度分布图(C)Fig.1 TEM images of GO in in distilled water (A) and F/2-medium (B) respectively after sonication and particle size-distribution in distilled water (C)
2.2 GO对2种微藻生长的抑制
由图2可见,GO对2种微藻的生长均具有明显抑制作用,其中,盐生杜氏藻在含GO的培养基中暴露24 h期间几乎无法生长。随着暴露时间延长,较高浓度GO对微藻生长的抑制效应越来越大。暴露72 h时,150 mg·L-1处理组中,盐生杜氏藻的细胞密度(0.652×106cells·mL-1)仅为同期对照组(1.457×106cells·mL-1)的44.75%;同样,海洋微拟球藻的细胞密度(1.987×106cells·mL-1)降为同期对照组(4.671×106cells·mL-1)的42.54%。根据微藻生长曲线,采用1.2.2节的方法,计算得到GO对2种微藻的72 h EC50值分别为13.04 和79.10 mg·L-1(见表1)。
2.3 微藻的GSH及其相关酶对GO暴露的响应
图3显示,2种微藻暴露于低(10 mg·L-1)、高浓度(100 mg·L-1)的GO 72 h后,与对照组相比,GSH含量均降低,其中,盐生杜氏藻的降幅分别为50.0%和71.3%,海洋微拟球藻的降幅分别为58.4%和62.0%。GPx活性也受到抑制,其中,盐生杜氏藻的降幅分别为21.4%和20.9%,海洋微拟球藻的降幅分别为43.1%和48.2%。但是,高浓度GO暴露则显著诱导微藻的GR、GST活性,盐生杜氏藻和海洋微拟球藻的GR活性分别比对照组上升38.3%和178%;GST活性分别增加95.6%和142%。
2.4 微藻的脂质过氧化程度
由图4可见,72 h暴露试验中,低浓度(10 mg·L-1)的GO对2种海水微藻MDA含量的影响不显著,而暴露在高浓度(100 mg·L-1)GO后,微藻的MDA含量发生显著变化(p<0.05)。与对照组相比,盐生杜氏藻和海洋微拟球藻的MDA含量分别增加18.0和10.9倍。

表1 GO对2种海洋微藻的72 h EC50Table 1 72 h EC50 values of GO calculated for two species of marine microalgae

图2 盐生杜氏藻(A)和海洋微拟球藻(B)在不同浓度GO中暴露的生长曲线Fig.2 Growth curves of Dunaliella salina and Nannochloropsis oceanic in batch cultures as a function of GO concentration
2.5 微藻的光合色素含量
不同浓度(0、10、100 mg·L-1)GO暴露72 h后,2种微藻光合色素含量的变化见图5。无论GO存在与否,盐生杜氏藻的3种光合色素含量均高于海洋微拟球藻。对于盐生杜氏藻,与对照组相比,2种浓度的GO处理均能显著刺激光合色素合成(p<0.05),且浓度较高(100 mg·L-1)处理组的增幅大于浓度较低(10 mg·L-1)处理组(Chla:79.9% vs. 37.6%;Chlb: 89.5% vs. 36.8%;Chl(a+b): 82.8% vs. 37.3%;Car: 56.5% vs. 32.5%)。对于海洋微拟球藻,较低浓度GO也能引起色素含量显著增加,其中,Chla和Car的变化达到显著水平(p< 0.05);较高浓度GO能显著诱导除Car(降幅为48.2%)以外的其它色素的合成(p< 0.05,增幅分别为:Chla11.7%、Chlb81.1%和Chl (a+b) 41.5%)。
2.6 微藻表面形态与微观结构
SEM观察发现,对照组的盐生杜氏藻和海洋微拟球藻近似呈球形(见图6 (A)、(D)),经过GO暴露后,细胞因外部包覆一层GO而呈不太规则的球形或其它形状(见图6 (B)、(C)、(E)、(F)中黄色箭头所指),且藻细胞总体呈皱缩状态,海洋微拟球藻尤为明显(见图6 (E)、(F))。
TEM图显示,对照组的藻细胞近似为圆形,细胞膜和细胞壁完整(注:盐生杜氏藻无细胞壁),细胞核、叶绿体、线粒体、高尔基体以及淀粉粒、油脂小球等清晰可见(见图7 (A)、(C))。暴露于GO后,可观察到以下4点明显变化:①2种微藻的细胞形态发生畸变(与SEM观察结果相符),其中,盐生杜氏藻的部分细胞膜结构受到破坏,内容物外泄(见图7 (B)中黄色箭头所指);海洋微拟球藻细胞则变得细长(见图7 (D)),细胞表面还出现一些凸起(见图7 (B)、(D)中红色箭头所指);②盐生杜氏藻细胞核严重变形,核膜模糊不清,核质发生凝聚(图7 (B)中蓝色箭头所指);③海洋微拟球藻的细胞质中分布着GO颗粒(见图7(D)中2处蓝色箭头指示的黑色阴影处);④藻细胞内的淀粉粒数量增多(或体积增大)(见图7 (B)、(D))。

(*p<0.05水平上差异显著。* denotes significant difference from the control at p<0.05.)
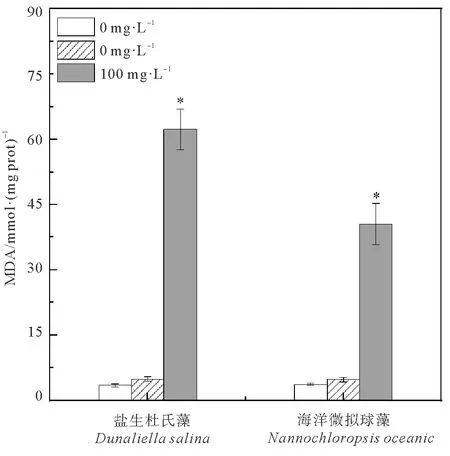
(*p<0.05水平上差异显著。*denotes significant difference from the control at p<0.05.)
3 讨论
GO对微生物的生长抑制情况因微生物种类而异。根据我国《新化学物质危害评估导则》(HJ/T 154—2004)[19]提出的生态毒理学危害性分级标准,GO对2种海洋微藻(盐生杜氏藻和海洋微拟球藻)均具有中等毒性(72 h EC50介于10~100 mg·L-1),但是,盐生杜氏藻对GO的敏感性高于海洋微拟球藻(72 h EC50:13.04 mg·L-1vs. 79.10 mg·L-1),也高于除纤细裸藻(Euglenagracilis)以外的其它淡水藻种(72 hEC50≥20.6 mg·L-1,见表1)。但是,由于目前国内外关于GO毒性效应的研究所涉及的微藻种类较少,尚无法判断海洋微藻与淡水微藻对GO敏感性的相对高低。
本研究观察到GO-微藻体系中几乎所有藻细胞的表面都有GO聚集体附着,甚至整个细胞被GO完全包裹(见图6),这是因为GO表面存在羧基、羟基和烷氧基[22-23],而微藻细胞壁上含有多糖、蛋白质、脂类等[24],其细胞膜则是由磷脂分子层、糖脂和蛋白质组成[25-26],这些生物大分子中富含酰胺基、羧基、羟基等官能团[32],使得GO与海洋微拟球藻、盐生杜氏藻(无细胞壁)之间容易通过形成氢键和共价键而结合。光是影响微藻生长最重要的环境因子之一。理论上,在海水中透光性变差(因颜色加深)的GO包覆于藻细胞表面后,必然造成入射到藻细胞内的光强减弱,相应的,光合作用会降低。但是,本研究发现,2种微藻暴露于高、低浓度GO后,单位数量藻细胞的光合色素含量总体上明显增加(见图5)。Metzler等也发现[27],纳米颗粒产生的遮光效应在减少藻细胞对光吸收的同时会导致叶绿素含量增加,并认为这种变化是微藻对遮光效应的一种应激响应,其目的是优化光的利用率,增加藻细胞对光的吸收,以消除遮光(非完全不透光)带来的不利影响。即便如此,由于微藻可获得的光强减少,其光合作用强度并不能达到对照组水平,表现为微藻生长受到抑制(见图2)。

(*p<0.05水平上差异显著。*denotes significant difference from the control at p<0.05.)图5 2种微藻暴露于GO(0、10和100 mg·L-1)72 h后的Chl a、Chl b、Chl (a+b)和Car含量Fig.5 Contents of Chl a, Chl b, Chl (a+b) and Car in two species of algae exposed to 0, 10 and 100 mg·L-1 of GO for 72 h

(A~C:盐生杜氏藻;D~F:海洋微拟球藻。其中,黄色箭头指示GO包裹细胞。A~C:Dunaliella salina; D~F: Nannochloropsis oceanic. The yellow arrows indicate GO envelops cells.)
虽然海洋微拟球藻具有细胞壁,但是包覆于其表面的GO仍能进入细胞质中(见图7(D))。细胞壁是外部物质进出藻细胞的主要部位和屏障。据报道,细胞壁上的微孔直径在5~20 nm之间,因此细胞对外部物质的进出具有选择性[28]。本研究所用的GO在淡水中的粒径大多在200~400 nm(见图1)。当GO进入F/2培养基(海水介质)后,其表面电荷因高浓度电解质的屏蔽效应而减少,胶体的稳定性变差[29],造成GO团聚而形成较大的聚集体,故其粒径必然大于淡水中的粒径。在这种情况下,GO进入海洋微拟球藻细胞内的原因可能是:细胞繁殖期间细胞壁的通透性会发生改变,使得一些大尺寸的纳米颗粒聚集体能够穿过新合成的细胞壁[30],而后通过网格蛋白介导的内吞作用(真核细胞中普遍存在)进入细胞内[31]。盐生杜氏藻细胞的表面缺少细胞壁,意味着海水介质中的GO可以直接与细胞膜接触,而GO片层的边缘通常较为尖锐(单层GO的厚度约为0.8~1 nm),其与细胞的相互碰撞过程可直接刺穿细胞膜,造成细胞完整性的丧失[32-33],这将大大降低GO进入藻细胞的阻力。因此,在TEM图像中观察到暴露于GO的盐生杜氏藻细胞形态严重畸变、细胞膜破损、内容物外泄、细胞核染色质凝集等。而经同样GO暴露后的海洋微拟球藻中较少见到这些变化(见图7 (B)、(D))。这是盐生杜氏藻生长受GO抑制较大的原因之一。文献报道无细胞壁的淡水微藻纤细裸藻对GO具有高敏感性(72 h EC50= 3.76 mg·L-1),也能够证明这一点。
碳纳米材料在藻细胞内产生氧化逆境常被认为是此类物质的致毒机理之一。大量研究已证明,碳纳米颗粒能在生物体内诱导ROS产生[34-35],其中,GO对ROS生成具有显著催化作用,由此引发脂质过氧化,造成细胞壁以及DNA等生物分子的氧化损伤,抑制细胞的生理行为而导致毒性[31,36]。本研究发现,暴露于GO的2种微藻细胞内谷胱甘肽抗氧化防御系统出现显著变化。其中,GSH含量显著降低(p<0.05),表明这种抗氧化剂在消除ROS过程中被大量消耗。一般认为[32,37],GSH可通过2条途径起到抗氧化作用,一是在GPx催化下与H2O2作用生成氧化型谷胱甘肽(GSSG);二是在GST作用下与污染物结合成为极性小的物质,实现对机体的保护作用。此外,细胞中的GR可利用NADPH作为电子供体,催化GSSG的二硫键还原,重新生成GSH,以维持细胞内的氧化还原动态平衡。就本研究而言,由于高、低浓度GO暴露下GPx活性均显著受抑(p<0.05),而GST活性未受到抑制甚至在高浓度GO处理组中显著上扬(见图3),表明GSH在GPx催化下清除H2O2而消耗的数量相对较少,相反,因与GO直接结合而消耗的GSH数量较大(虽然两者的结合机制尚不清楚)。相应的,高浓度GO暴露下活性显著上升的GR(p<0.05)只能对GSSG进行还原,而无法介入与GO直接结合的GSH的恢复,由此导致GO处理组的GSH含量始终低于对照组(见图3)。
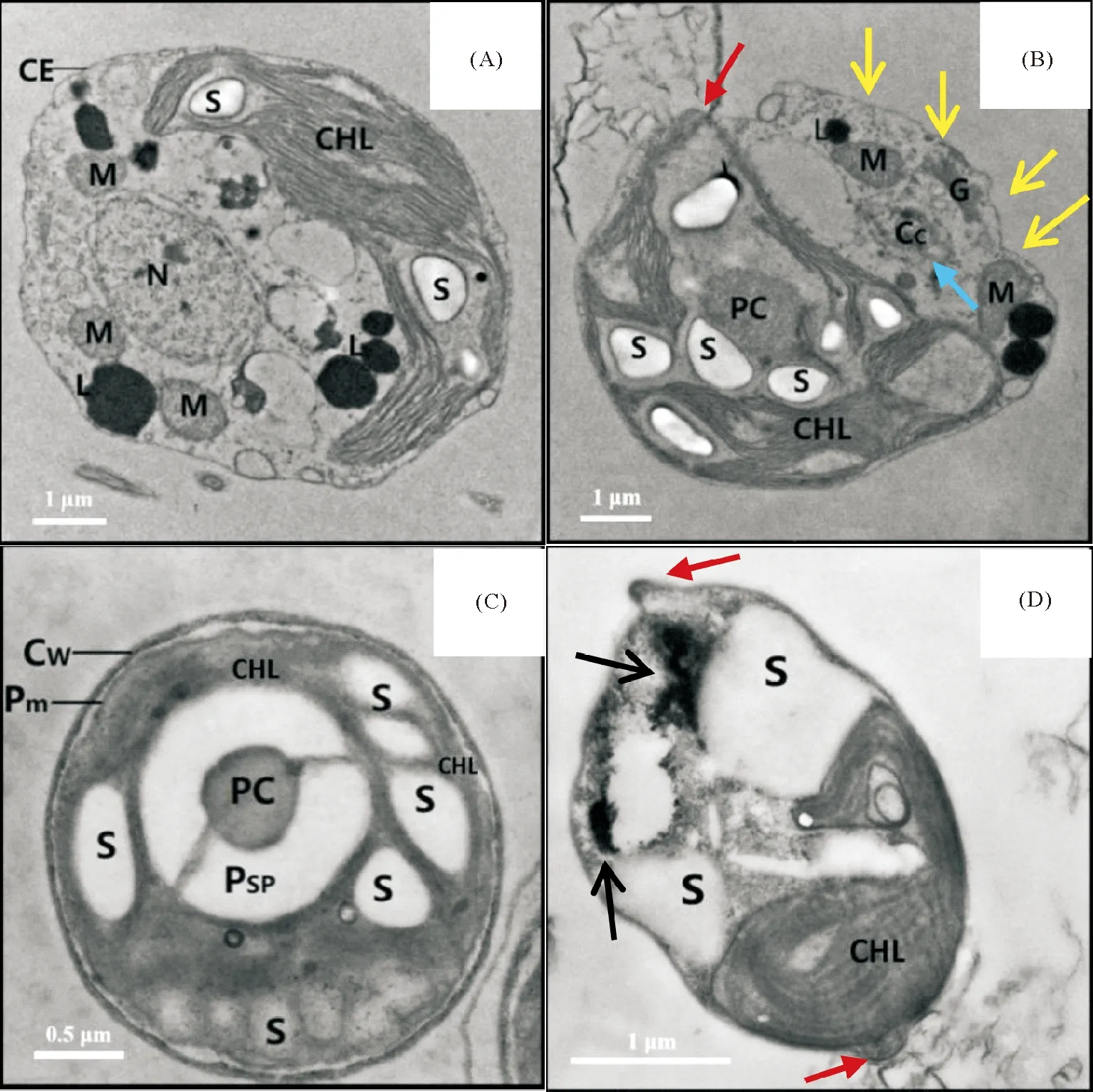
(红色箭头指向细胞表面凸起,蓝色箭头指向核染色质凝集,黑色箭头指向进入细胞内部的GO。Cw:细胞壁;CE:细胞外膜;Pm:质膜;N:细胞核;M:线粒体;CHL:叶绿体;PC:淀粉核中心;Psp:淀粉鞘;S:淀粉粒;L:油脂小球;Cc:凝集的核染色质;G:高尔基体。The red arrows indicate the cell surface bulge, blue arrows indicate the Nuclear chromatin agglutination, and black arrows indicate the internalized GO. Cw: cell wall; CE: cell envelope;Pm: plasmalemma; N: nucleus; M: mitochondrion; CHL: chloroplast; PC: pyrenoid center; Psp: pyrenoid starch plate; S: starch grain; L: lipid globule;Cc: condensed chromatin; G: golgi apparatus.)

表2 GO对不同种类微藻的生长抑制作用(EC50)比较Table 2 Growth inhibition effects (EC50) comparison of GO to the different algal species
比较发现,在较高浓度GO胁迫下,盐生杜氏藻的GR活性诱导程度较小,GSH剩余量也较低,表明其对ROS的清除能力不及海洋微拟球藻。相应的,该微藻细胞内出现较高含量的MDA(见图4),这是过多积累的ROS攻击生物大分子造成严重脂质过氧化的结果。暴露于GO的盐生杜氏藻中出现的细胞膜明显破损、核膜模糊不清等现象(见图7)也与此有关。至于2种海洋微藻细胞内的淀粉积累量增加(见图7 (B)、(D)),则是微藻对GO胁迫的一种适应机制。很多研究已证实[38,39],在氮磷营养盐不足、高盐度等生长逆境下,藻细胞会将光合作用固定的碳源更多用于储能物质(淀粉或脂质)积累,以抵御外界环境变化和实现机体自我保护。
4 结论与展望
(1)GO对盐生杜氏藻和海洋微拟球藻生长均有抑制,72 h EC50分别为13.04和79.10 mg·L-1。
(2)GO不会抑制海洋微藻光合活性,却能促进微藻光合色素合成,并以淀粉粒形式积累。
(3)GO暴露引起微藻谷胱甘肽抗氧化系统明显变化,包括GSH大量消耗、GPx活性受抑、GST和GR活性上扬。高浓度GO胁迫下细胞内MDA含量激增,脂质过氧化严重。
(4)盐生杜氏藻对GO的高敏感性与其缺少细胞壁以及GSH过度消耗有很大关系。
(5)本研究结果有助于人们加深对GO海洋生态效应的认识,今后应采用更多海洋微藻进行研究,并探讨环境因子对GO毒性的影响,为客观评价GO的海洋生态风险提供充分依据。

