PTPRO在溃疡性结肠炎组织中的表达及意义
葛倩文 吴尚农 王宏刚 沈 鹏
溃疡性结肠炎(UC)是一种非特异性的慢性结肠炎性疾病,主要表现为反复性或持续性腹泻、便血及腹痛等[1-2]。近年来,全球UC的发病率呈逐年升高趋势,严重影响着人们的生活质量和生命安全[3]。UC具有病程长、易复发等特点[4],目前UC的发病机制尚未完全明确。探究UC的病因并针对病因寻找有效的治疗方案,对于UC的治疗及预后具有重要意义。Toll样受体4(TLR4)可通过核因子-κB(NF-κB)调节肿瘤坏死因子α及白细胞介素-1β(IL-1β)水平,进而参与调节炎性反应[5]。此外有研究表明,TLR4可通过介导淋巴细胞归巢,参与UC的发病及病情进展过程[6]。TLR4在多种疾病中均可与受体型蛋白酪氨酸磷酸酶O(PTPRO)相互作用,参与疾病的发生、发展过程[7-8]。目前关于PTPRO参与UC发病的报道较少,本文对此展开研究,以期阐明PTPRO与UC的关系,为UC的临床治疗提供帮助。
1 资料与方法
1.1 一般资料
前瞻性选取2014年4月至2017年8月在淮安市第一人民医院就诊的95例UC患者作为研究对象,设为UC组。根据《炎症性肠病诊断与治疗的共识意见(2012年·广州)》[9]进行UC诊断。纳入标准:(1)初次就诊并诊断为UC;(2)患者年龄为18~60岁;(3)结直肠镜检查至回盲部。排除标准:(1)合并除UC以外的其他自身免疫性疾病;(2)合并严重的心、肝、肾功能障碍;(3)合并恶性肿瘤;(4)急性感染性肠炎;(5)随访失联。另选取本院同期行肠镜检查并切除肠内息肉的46例患者作为对照组。UC组患者中男性66例,女性29例,年龄为21~58岁,平均年龄为(44.66±5.21)岁;对照组中男性35例,女性11例,年龄为19~60岁,平均年龄为(45.50±6.34)岁。两组在性别(χ2=0.667,P=0.414)、年龄(t=0.835,P=0.405)方面比较,差异无统计学意义(P>0.05),具有可比性。本次研究中所有受试者均知情并签署了知情同意书。本研究经医院医学伦理委员会批准。
1.2 临床资料收集
收集所有受试者的年龄、性别、体质指数(BMI)、结直肠镜检查结果等信息。采用免疫比浊法检测C反应蛋白(CRP)水平,采用间接免疫荧光法检测抗中性粒细胞胞浆抗体(ANCA)水平。
1.3 PTPRO蛋白表达量检测
采用蛋白质免疫印迹法检测UC组织及肠息肉组织中PTPRO蛋白表达量[10]。在UC组织及肠息肉组织中滴加RIPA裂解液提取总蛋白,并进行定量,然后滴加匀浆缓冲液,4 ℃环境下,3 500 r/min离心15 min,取上层清液。然后120 V电压电泳100 min,转膜缓冲液平衡3次,每次5 min,之后浸入转膜缓冲液中10 min,转膜。转膜后PBS洗膜3次,每次5 min;加入一抗,4 ℃孵育过夜,PBST洗3次,每次10 min,加入辣根过氧化物酶偶联的二抗,室温下孵育1 h,PBST洗3次,每次10 min,曝光显影,用软件ImageJ进行光密度分析。
1.4 UC镜下活动度
根据UC镜下严重程度指数(UCEIS)评估UC镜下活动度[11]。UCEIS评分根据受累肠段最严重处血管纹理、出血情况及糜烂和溃疡程度进行计算。血管纹理评分:血管纹理正常计0分,斑片状计1分,完全闭塞计2分。出血情况:黏膜和肠腔无出血计0分,轻度出血计1分,中度出血计2分,重度出血计3分。糜烂和溃疡程度:无糜烂或溃疡计0分,糜烂计1分,浅表糜烂和溃疡计2分,深部糜烂和溃疡计3分。上述3项评分总和即为UCEIS评分,<2分为镜下缓解期,2~8分为镜下活动期。
1.5 预后随访
于UC患者出院后1周开始电话随访,随访为期2年,每月随访1次,末次随访时间为2019年8月26日。若随访过程中患者出现UC复发、结肠大出血、中毒性巨结肠、UC相关黏膜发育异常及UC相关癌变,则判定为预后不良[12]。
1.6 统计学方法

2 结果
2.1 PTPRO在UC组织中的表达
蛋白质免疫印迹法结果显示,UC组PTPRO蛋白表达量为3.21±0.88,高于对照组(1.14±0.21),差异有统计学意义(t=21.573,P<0.001)。
2.2 PTPRO与UC镜下活动度的关系
95例UC患者中有35例为镜下缓解期,60例为镜下活动期。镜下缓解期UC患者PTPRO蛋白表达量为2.45±0.55,低于镜下活动期UC患者(3.65±0.73),差异有统计学意义(t=9.053,P<0.001)。UC组织中PTPRO蛋白表达量评价镜下活动度的ROC曲线下面积(AUC)为0.899(95%CI:0.820~0.952),最大约登指数为0.641,其最佳截断点、敏感度及特异度分别为3.02、85.71%和78.33%。见图1。

图1 PTPRO蛋白表达量评价镜下活动度的ROC曲线
2.3 不同预后UC患者PTPRO蛋白表达情况
95例UC患者中32例(33.68%)预后不良,其中29例(30.53%)复发,2例(2.11%)结肠大出血,1例(1.05%)癌变。预后良好组PTPRO蛋白表达量为2.74±0.63,低于预后不良组(4.13±0.51),差异有统计学意义(t=10.889,P<0.001)。PTPRO蛋白表达量评价UC患者预后的ROC AUC为0.957(95%CI:0.895~0.988),最大约登指数为0.811,其最佳截断点、敏感度及特异度分别为3.48、93.75%和87.30%。具体见图2。
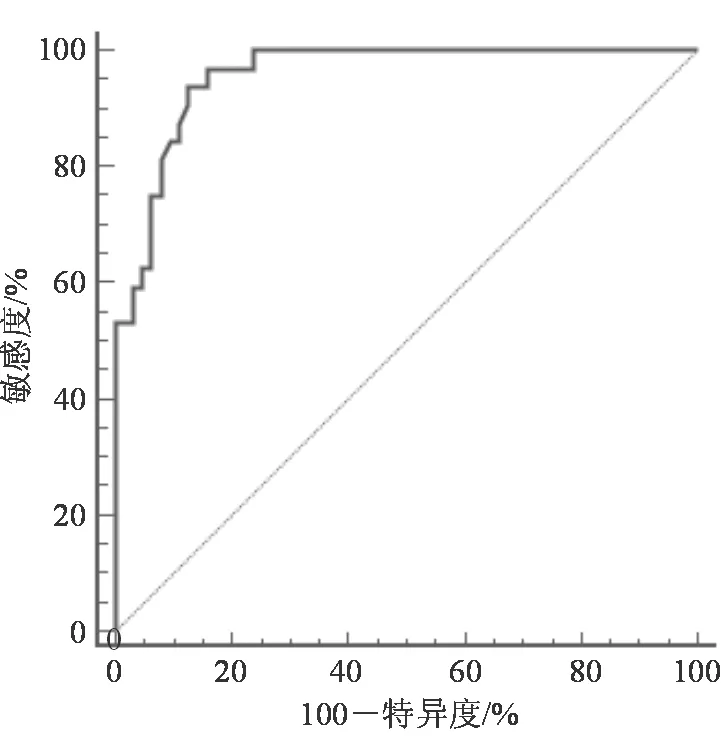
图2 PTPRO蛋白表达量评价UC患者预后的ROC曲线
2.4 不同预后的UC患者基本资料比较
预后不良组和预后良好组患者在年龄、性别、BMI及病变位置方面比较,差异均无统计学意义(P>0.05)。预后不良组患者的UCEIS评分、CRP及ANCA阳性占比均高于预后良好组,差异均有统计学意义(P<0.05)。具体见表1。
2.5 影响UC患者预后的相关因素分析
将UC患者的预后情况作为因变量,将可能影响UC患者预后的相关因素如PTPRO、UCEIS评分、CRP和ANCA作为自变量(纳入标准为单因素分析结果中P≤0.1的因素),纳入Logistic回归分析,结果显示PTPRO、UCEIS评分及ANCA与UC患者的预后关系密切。见表2。

表1 预后不良组和预后良好组的基本资料比较

表2 影响UC患者预后的相关因素分析
3 讨论
PTPRO是磷酸酪氨酸磷酸酶的受体之一,可在肝实质细胞中表达[13]。此外,在巨噬细胞和淋巴细胞中也发现有截短型PTPRO表达[14]。有研究表明,PTPRO可通过调控NF-κB参与肝脏缺血再灌注损伤[15]。UC是一种非特异性的慢性结肠炎性疾病,其发病及进展与TLR4表达失衡有关,PTPRO可通过调控TLR4参与多种疾病的进展过程[7-8],由此推测,PTPRO可能通过调控TLR4表达,参与了UC的发生、发展过程。
本研究结果发现,UC组PTPRO蛋白表达量明显高于对照组,提示PTPRO蛋白可能参与了UC的发病或疾病进展过程。通过比较不同镜下活动度UC患者PTPRO蛋白表达量,发现镜下活动期患者PTPRO蛋白表达量高于镜下缓解期患者,进一步证实上述推测。通过构建PTPRO蛋白表达量评价UC患者镜下活动度的ROC曲线,结果显示其ROC AUC大于0.8,且敏感度和特异度均较好。上述结果表明,PTPRO蛋白参与了UC的疾病发生、发展过程,检测其表达量有助于评估UC镜下活动度。此外,本研究发现预后良好组PTPRO蛋白表达量低于预后不良组,提示PTPRO蛋白表达量可能与UC患者的预后关系密切。本研究进一步构建了PTPRO蛋白表达量评价UC患者预后的ROC曲线,结果显示其ROC AUC、敏感度及特异度分别为0.957、93.75%和87.30%,表明PTPRO蛋白表达量在UC患者预后评估中的价值较高,且具有较高的敏感度和特异度。通过单因素和Logistic回归方法分析影响UC患者预后的相关因素,结果显示UCEIS评分、ANCA与UC患者的预后关系密切,与已报道的研究结论相似[16-18]。此外,本研究指出PTPRO蛋白表达量也与UC患者的预后存在一定关系。
PTPRO与TLR4相互作用参与了多种疾病的发生、发展过程,如爆发性肝炎、急性肝损伤及肝细胞癌等[7-8]。在上述疾病模型中,PTPRO对TLR4的调节均依赖NF-κB信号转导通路。TLR4表达于微血管内皮细胞、心肌细胞及肠上皮细胞等,还可表达于除自然杀伤细胞、T细胞和B细胞以外的免疫细胞中[19]。TLR4对脂多糖较为敏感,可介导肠上皮细胞对细菌细胞壁中脂多糖的高反应性[20]。TLR4可激活NF-κB,促使细胞分泌肿瘤坏死因子-α,从而参与炎性反应[21]。肠-肝轴异常会诱发肝、胆及肠道疾病,如原发性硬化性胆管炎的发病与UC有关[22-23];肠道炎性疾病会增加肠上皮黏膜通透性,使病原体通过肠道进入门静脉,并随血液循环至肝脏,最终引发肝脏疾病[24]。TLR4在健康人群的结肠黏膜组织中表达水平较低,但在UC黏膜组织中表达水平较高[25]。有研究表明,TLR4可通过白细胞介素-1受体(IL-1R)同源结构域及其下游信号转导分子髓样分化因子88、IL-1R相关激酶、肿瘤坏死因子受体相关因子-6等,参与病原体诱导的肠上皮细胞中NF-κB的活化,促进免疫炎性因子分泌,导致UC发生[19]。
综上所述,PTPRO蛋白在UC组织中高表达,检测其表达量有助于评估UC患者镜下活动度及预后情况。本文尚存在一定不足,如样本量偏小,未进一步分析确认PTPRO是否通过调控TLR4影响UC的预后等,下一步将探究PTPRO参与UC发病及进展的病理生理机制,为其靶向药物的研制提供参考。

