长非编码RNA ARID2-IR在慢性肾小球肾炎中的作用及机制研究
张爱萍 贺芳 佘开儒
435200 黄石,湖北省阳新县人民医院肾内科(张爱萍),感染科(佘开儒);430022 武汉,华中科技大学同济医学院附属协和医院心血管外科(贺芳)
慢性肾小球肾炎(chronic glomerulonephritis,CGN)是原发性肾小球疾病的最常见形式,以蛋白尿、血尿、高血压和水肿为基本临床表现,病情缓慢,最终发展为慢性肾衰竭,其分子机制尚不清楚[1-2]。大量证据表明,CGN是由遗传和环境风险因素引起的多因素疾病[3-4]。研究发现,与复杂疾病有关的大多数单核苷酸多态性(single-nucleotide polymorphisms,SNPs)位于人类基因组的非编码区,例如长非编码RNA(long non-coding RNA,LncRNA),但其作用机制尚不清楚。
LncRNA是一种转录本超过200个核苷酸,没有蛋白编码功能的特殊RNA分子[5-6]。尽管这些分子最初被认为是没有生物学相关性的转录“垃圾产物”,但最近的研究表明LncRNA不仅在细胞过程(例如增殖,分化和代谢)中而且在肿瘤、代谢和神经退行性病变中起着重要作用[7-8]。据报道,LncRNA AT富集互动域2-IR(AT-rich interactive domain 2-IR,ARID2-IR)在慢性肾脏病中发挥着重要作用[9-10],但在CGN中的作用尚不清楚。本研究将探讨LncRNA ARID2-IR在CGN人群中的表达及其机制。
资料和方法
一、研究对象与试剂
1.研究对象 纳入2018年至2019年在湖北省阳新县人民医院肾内科确诊为CGN的52例患者作为CGN组。入选标准:(1)年龄>18岁;(2)患者尿化验异常(蛋白尿、血尿、管型尿)、水肿及高血压病史达一年以上,并符合2003年国际肾脏病学会和肾脏病理学会联合制定的关于CGN的国际标准[11];(3)近1周未服用治疗药物;(4)患者基本资料和临床资料完整。排除标准:(1)继发性肾小球疾病者;(2)遗传性肾小球疾病者;(3)严重心理疾病、精神病患者;(4)存在其他恶性疾病,如肿瘤、免疫系统疾病和心血管疾病等患者;(5)孕妇和哺乳期妇女。52例CGN患者通过肾活检确定主要病理分型包括:系膜增生性肾小球肾炎(20例)、系膜毛细血管性肾小球肾炎(16例)、膜性肾病(9例)、局灶节段性肾小球硬化(7例)。另选45名健康成年人群作为对照组。本研究经过湖北省阳新县人民医院医学伦理委员会审查通过(伦理批件号:YXL2018003),所有受试者均签署知情同意书。
2.试剂 RNA Lock血液RNA稳定剂、高效血液总RNA提取试剂盒、cDNA第一链合成试剂盒和SYBR Green荧光定量检测试剂盒购自于天根生化科技有限公司。
二、方法
1.一般资料的收集 为所有受试者建立个人档案,收集基本信息(包括年龄、性别、身高、体重),计算体质量指数=体重(kg)/身高(m)2,测量收缩压和舒张压。
2.血生化检测 采集两组人群静脉血,由医院检验科贝克曼库尔特AU5800全自动生化分析仪检测血尿素氮(blood urea nitrogen,BUN)和血肌酐(serum creatinine,Scr)。
3.实时荧光定量PCR检测 用高效血液总RNA提取试剂盒提取外周血总RNA,检测RNA浓度和纯度后逆转录成cRNA。通过实时荧光定量PCR扩增检测基因表达。引物序列:LncRNA ARID2-IR上游5’-TTTTCCCACGCTGTCTGTCA-3’,下游5’-CAGTT TCCCCCGATGGTGAG-3’;IFT80上游5’-GCAAG GAACACCAGTGTATTCA-3’,下游5’-GGC CGTAA CTATCCCATACCTTA-3’;IGHG4上游5’-GGCTACC TCAGCGATAGCAG-3’,下游5’-GGGGTGTAATAG GGGGTCCC-3’;RLBP1上游5’-AAGGATGAGCTG AACGAGAGA-3’,下游5’-AGCCGGAAATTCACAT AGCCT-3’;ANKRD27上游5’-TTGACAGGAACA TCGCCTCTT-3’,下游5’-GAGAGCATTCGCTGAG TCTATG-3’;TSPAN6上游5’-ACTTGTTTCAAG AGCGTTCTGC-3’,下游5’-CAATGAGCACGAAGGG GACAT-3’;内参β-actin上游5’-TCAGGTCATCAC TATCGGCAAT-3’,下游5’-AAAGAAAGGGTGTAA AACGCA-3’。引物由NCBI在线引物设计工具设计(https://www.ncbi.nlm.nih.gov/tools/primer-blast/),由北京擎科生物技术有限公司合成。
三、统计学方法
结 果
一、两组临床资料比较
对照组与CGN组人群在年龄、性别和体质量指数方面差异无统计学意义(P>0.05);CGN组的收缩压、舒张压、BUN和Scr均显著高于对照组(P<0.05)。(表1)
二、LncRNA ARID2-IR的表达及相关性分析
采用实时荧光定量PCR检测对照组与CGN组人群LncRNA ARID2-IR的表达。如图1所示,CGN组LncRNA ARID2-IR的表达显著高于对照组,差异有统计学意义(t=2.543,P=0.013)。系膜增生性肾小球肾炎、系膜毛细血管性肾小球肾炎、膜性肾病和局灶节段性肾小球硬化4种病理类型之间LncRNA ARID2-IR表达的差异无统计学意义(F=0.197,P=0.898)。
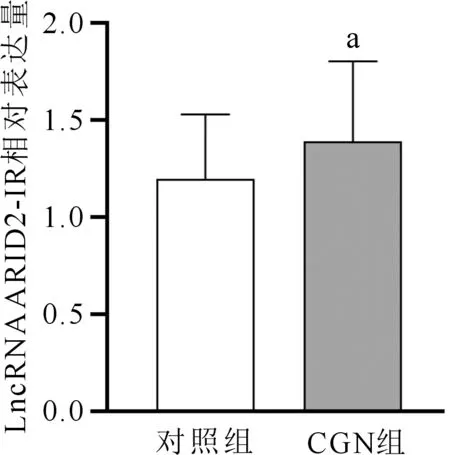
注:与对照组比较,aP<0.05图1 两组LncRNA ARID2-IR的相对表达量比较
如图2A所示,LncRNA ARID2-IR表达与BUN呈显著正相关(r=0.225,P=0.027);如图2B所示,LncRNA ARID2-IR表达与Scr呈显著正相关(r=0.266,P=0.008)。

图2 LncRNA ARID2-IR与肾功能指标的相关性分析 A.LncRNA ARID2-IR与BUN的相关性分析;B.LncRNA ARID2-IR与Scr的相关性分析
三、LncRNA ARID2-IR下游靶基因通路富集及表达
通过Starbase数据库(http://starbase.sysu.edu.cn/),我们对LncRNA ARID2-IR作用的下游靶基因进行了预测。结果显示一共有88个靶基因,我们对这些基因进行功能富集分析,以推测LncRNA ARID2-IR的生物学功能。如图3所示,这88个基因主要富集在钙信号通路、甲状腺激素信号通路、cAMP信号通路、催产素信号通路、Rap1信号通路、mTOR信号通路、胰岛素分泌、TGF-beta信号通路、FoxO信号通路、胰岛素抵抗10个通路中。根据与LncRNA ARID2-IR匹配得分,得分排名前5的靶基因为IFT80、IGHG4、RLBP1、ANKRD27和TSPAN6,通过实时荧光定量PCR进行验证,相对于对照组,CGN组中IFT80(t=4.089,P<0.01)和RLBP1(t=2.147,P=0.034)高表达,差异有统计学意义(图4)。

表1 两组临床资料比较

图3 LncRNA ARID2-IR下游靶基因的通路富集

注:与对照组相比,aP<0.05图4 LncRNA ARID2-IR下游主要靶基因的表达
四、LncRNA ARID2-IR、IFT80和RLBP1的ROC曲线
ROC曲线显示,LncRNA ARID2-IR(图5A)、IFT80(图5B)和RLBP1(图5C)的AUC分别为0.783、0.821和0.738,对于CGN具有诊断意义。
五、二分类Logistic回归分析
进行二分类Logistic回归分析以确定LncRNA ARID2-IR、IFT80和RLBP1对CGN的影响,自变量为LncRNA ARID2-IR、IFT80和RLBP1,因变量为是否患有CGN。建立的二分类Logistic回归模型具有统计学意义,LncRNA ARID2-IR(OR=4.754,P<0.05)、IFT80(OR=3.518,P<0.01)和RLBP1(OR=4.718,P<0.05)水平升高会增加患CGN的风险(表2)。

图5 三种指标诊断CGN的ROC曲线 A.LncRNA ARID2-IR的ROC曲线;B.IFT80的ROC曲线;C.RLBP1的ROC曲线

表2 二分类Logistic回归模型以确定LncRNA ARID2-IR、IFT80和RLBP1对CGN的影响
讨 论
CGN的病理机制非常复杂,对于CGN的发病原因、预防和治疗目前尚存在许多争议,因此寻找CGN发生发展中新的生物标记物成为现阶段肾病研究的一个热点[12]。越来越多的证据表明,LncRNA是基因调控和细胞功能的关键分子,并且在肾脏相关疾病中具有重要作用[10]。有研究报道在CGN患者中LncRNAs表达水平的失调[13-14]。Gao等[13]通过对CGN大鼠肾脏组织测序数据生物信息学分析,鉴定出40个显著上调的LncRNA和24个下调的LncRNA,653个上调的mRNA和128个下调的mRNA,其中LncRNA NONRATT026650、LOC102547664、NONRATT77021989、NONRATT 012453、LOC102551856、LOC102553536和NONRATT7047175在CGN的发展中发挥重要作用。
LncRNA ARID2-IR被报道与肾脏疾病密切相关。Yang等[10]研究发现,LncRNA ARID2-IR过表达可能有助于糖尿病肾脏病中细胞外基质的产生,而早期生长反应蛋白1(early growth response protein-1,Egr1)可以通过上调LncRNA ARID2-IR来部分促进糖尿病肾脏病中细胞外基质的产生。Zhou等[9]通过动物模型研究发现,LncRNA ARID2-IR的过表达促进白细胞介素1β诱导的NF-κB信号转导和炎性细胞因子表达,促进NF-κB依赖性肾脏炎症的发展,抑制LncRNA ARID2-IR的表达可对肾脏炎性疾病发挥治疗作用。本研究中我们发现CGN组LncRNA ARID2-IR的表达显著高于对照组。在CGN组中,LncRNA ARID2-IR表达与BUN和Scr呈显著正相关,说明LncRNA ARID2-IR的上调和肾功能损伤有关。
在本研究中,通路富集分析表明,LncRNA ARID2-IR的靶基因主要参与钙信号通路、甲状腺激素信号通路、cAMP信号通路、催产素信号通路、Rap1信号通路、mTOR信号通路、胰岛素分泌、TGF-beta信号通路、FoxO信号通路、胰岛素抵抗10个通路。甲状腺激素信号通路与CGN密切相关,甲状腺激素影响肾脏发育、肾脏血流动力学、肾小球滤过率以及钠和水稳态[15]。胰岛素抵抗与肾脏疾病进展相关,研究发现IgA肾病患者的胰岛素抵抗较高[16-17]。此外,研究发现胰岛素/磷脂酰肌醇3-激酶/Akt和mTOR信号对于足细胞肥大和适应至关重要[18-19]。肾脏中的脂肪因子和异位脂质蓄积促进了足细胞的胰岛素抵抗和适应不良的反应,以应对肾脏滤过的机械作用[20]。FoxO信号通路的激活可以减少有关通过SIRT1介导的脱乙酰作用,SIRT1基因是一种长寿基因,可以保护肾脏细胞免受各种细胞应激的伤害[21-22]。通路富集分析表明,LncRNA ARID2-IR的靶基因与CGN进展中的重要信号通路相关,进一步支持了LncRNA ARID2-IR与CGN的潜在关联。我们通过实时荧光定量PCR验证了与LncRNA ARID2-IR匹配得分最高的5个靶基因IFT80、IGHG4、RLBP1、ANKRD27和TSPAN6,结果显示CGN组IFT80和RLBP1的表达高于对照组人群。ROC曲线显示LncRNA ARID2-IR、IFT80和RLBP1对于CGN具有诊断意义。Logistic回归分析表明,LncRNA ARID2-IR、IFT80和RLBP1的上调能增加发生CGN的风险。
综上所述,我们的发现表明CGN患者中LncRNA ARID2-IR的上调与CGN肾功能有关,其机制可能是通过调控靶基因IFT80和RLBP1实现的。我们的发现对后续进一步的动物实验和离体细胞实验打下了理论基础,为阐明LncRNA ARID2-IR在CGN进展中的确切生物学功能和作用机制还需进行深入研究。

