虾肝肠胞虫全基因组分泌蛋白的预测分析*
宁梓健 姜宏波 刘 琦 包 杰
(沈阳农业大学 畜牧兽医学院 沈阳 110866)
虾肝肠胞虫(Enterocytozoon hepatopenaei, EHP)是一种严格细胞内寄生的微孢子虫,成熟的孢子呈椭圆形,大小为(1.4±0.3)×(0.8±0.1) μm,后端有1 个空泡,胞内含1 个细胞核,5~6 圈极丝,1 个与极丝相连的锚定盘和 1 层电子致密的孢子壁(乔毅等, 2018)。EHP 于2009 年首次从斑节对虾(Penaeus monodon)中发现并命名(Tourtip et al, 2009),感染EHP 的对虾往往正常进食,但生长缓慢甚至停滞,直接影响到养殖产量,给养殖户带来严重的经济损失(刘珍等, 2016; 宋增磊等, 2019),如何预防和治疗 EHP 已经成为对虾养殖产业急需解决的科学问题。明确EHP 的入侵机理是切断EHP 的传播途径和针对性用药的基础。EHP 的一些生物合成途径和三羧酸循环的基因缺失表明其对宿主有很强的依赖性(Katinka et al, 2001),需要从宿主吸收营养完成生活史发育,因此,在进化过程中微孢子虫进化出一种极其复杂和独特的感染机制以抵抗宿主免疫系统的攻击。
分泌蛋白(Secreted protein)是在细胞内合成后分泌到细胞外起作用的蛋白质,已有研究表明,其是介导真核病原微生物与宿主之间相互作用的重要因子(McKerrow et al, 1993; Gupta et al, 2012)。在其他微孢子虫中已有研究表明,一些分泌蛋白在虫体入侵宿主过程中扮演着重要角色(李田等, 2013; Wang et al,2015)。因此,查找和分析EHP 的分泌蛋白对于揭示入侵机理和虫体的免疫逃避将具有重要意义。目前,对EHP 在虾体内的感染机制了解甚少,尤其是在宿主–寄生虫相互作用水平上。本研究在基因组测序数据的基础上,利用生物信息学方法在全基因组范围内预测EHP 的分泌蛋白,同时,对所得分泌蛋白的功能进行注释,并对其序列特征和基序进行分析,研究结果可为筛选EHP 致病相关因子和探究其侵染机理提供参考。
1 材料与方法
1.1 基因组数据来源和主要分析软件
虾肝肠胞虫基因组数据来源于GenBank 数据库(http://www.ncbi.nlm.nih.gov),其 NCBI 登录号为MNPJ00000000.1。
用到的主要分析软件和网站如下:蛋白质跨膜结构域预测软件Tmhmm-2.0c(Krogh et al, 2001),线粒体蛋白预测软件MitoProtⅡ(Claros et al, 1996),细胞核蛋白预测软件Nucpred-1.1(Brameier et al, 2007)、NLStradamus.1.7(Nguyen Ba et al, 2009)和PredictNLS(https:// rostlab.org/owiki/index.php/PredictNLS),蛋白质信号肽预测软件SignalP-4.0(Petersen et al, 2011),蛋白质GPI 锚定位点预测软件Kohgpi-1.5(Fankhauser et al, 2005),蛋白质亚细胞定位预测软件TargetP-1.1(Emanuelsson et al, 2000)和WoLF PSORT(Horton et al,2007),真核生物分泌蛋白预测程序 EuSecPred2.0(https://silkpathdb.swu.edu.cn/eusecpred),氨基酸组成分析软件WebLogo(http://weblogo.threeplusone.com/create.cgi)(Crooks et al, 2004),蛋白质序列基序分析程序为MEME(http://meme-suite.org/tools/meme)(Bailey et al,2009)。
1.2 分泌蛋白的预测
针对 EHP 全基因组的蛋白质编码序列,运行EuSecPred 2.0在线流程筛选分泌蛋白(Druzhinina et al,2012)。由于本程序的局限性,只能预测到经典途径分泌的蛋白质,可能会漏掉部分非经典途径分泌的蛋白质。运行Tmhmm 程序去除跨膜蛋白,运行Nucpred、NLStradamus.pl 和PredictNLS 程序剔去其中的细胞核蛋白质,然后,通过SignalP-4.0 过滤掉其中无信号肽序列的蛋白质,通过MitoProt 程序过滤掉定位于线粒体的蛋白,利用TargetP 和WoLF PSORT 对具有信号肽的蛋白质进行亚细胞定位预测,保留定位于细胞膜外的蛋白质,最后,利用Kohgpi 程序剔除具有GPI 锚定位点的蛋白质,最终得到EHP 的分泌蛋白集合。
1.3 分泌蛋白的功能分析
利用BLASTP 程序,将预测获得的EHP 分泌蛋白序列分别与数据库Nr 和Swiss-Prot 数据库进行比对,将比对结果中得分最高的同源序列的功能作为对应分泌蛋白的功能参考(李田等, 2013; 罕园园等, 2014)。
1.4 分泌蛋白的序列特征分析
根据SingalP-4.0 信号肽预测的结果,截取所有分泌蛋白的信号肽序列,并统计分泌蛋白和信号肽序列的长度以及各类氨基酸组成,同时,截取信号肽剪切位点前后各3 个氨基酸,并利用WebLogo 对其组成进行统计,然后,利用MEME 程序预测分泌蛋白和信号肽中的基序。
2 结果与分析
2.1 预测的虾肝肠胞虫分泌蛋白
利用EuSecPred 流程对获得的2548 个虾肝肠胞虫蛋白质序列进行预测,发现具有跨膜域的蛋白有2018 个,1741 个蛋白质具有细胞核定位信号,144 个蛋白质具有信号肽序列,126 个蛋白具有线粒体定位信号,119 个蛋白具有亚细胞定位信号,筛选后最终获得了109 个分泌蛋白(表1)。
2.2 虾肝肠胞虫分泌蛋白的功能分类
预测获得109 个分泌蛋白,对其进行功能注释得出,其中60 个蛋白质(占预测所得分泌蛋白的54.05%)为无明确功能信息的蛋白质,另外49 个分泌蛋白在数据库中检索到了同源蛋白,其中酶类数目最多,包括具有调控宿主细胞增殖和免疫系统功能的酶类:多肽N-乙酰氨基半乳糖转移酶和泛素羧基末端水解酶;同时,还预测到1 个孢壁蛋白:SWP7,孢壁蛋白被认为在粘附、侵染以及致病等方面扮演着重要角色;另外,预测到2 种蛋白抑制因子:α-胰蛋白酶抑制剂重链H1、亮氨酸拉链假定肿瘤抑制因子2,这2 种蛋白抑制因子可能会抑制宿主免疫系统、调控细胞增殖;还预测到2 种糖蛋白(图1)。
2.3 虾肝肠胞虫分泌蛋白的序列特征
2.3.1 分泌蛋白与信号肽的长度和氨基酸组成 虾肝肠胞虫109 个分泌蛋白序列长度范围为30~700 aa,主要集中在30~400 aa,平均长度为219.34 aa,中值为181.00 aa(图2);信号肽长度范围在9~32 aa,主要长度集中在15~20 aa,平均长度为18.09 aa,中值为18.00 aa (图3)。

表1 预测的虾肝肠胞虫分泌蛋白基因及序列分析Tab.1 Coding genes and sequence information of the predicted EHP secreted proteins

续表
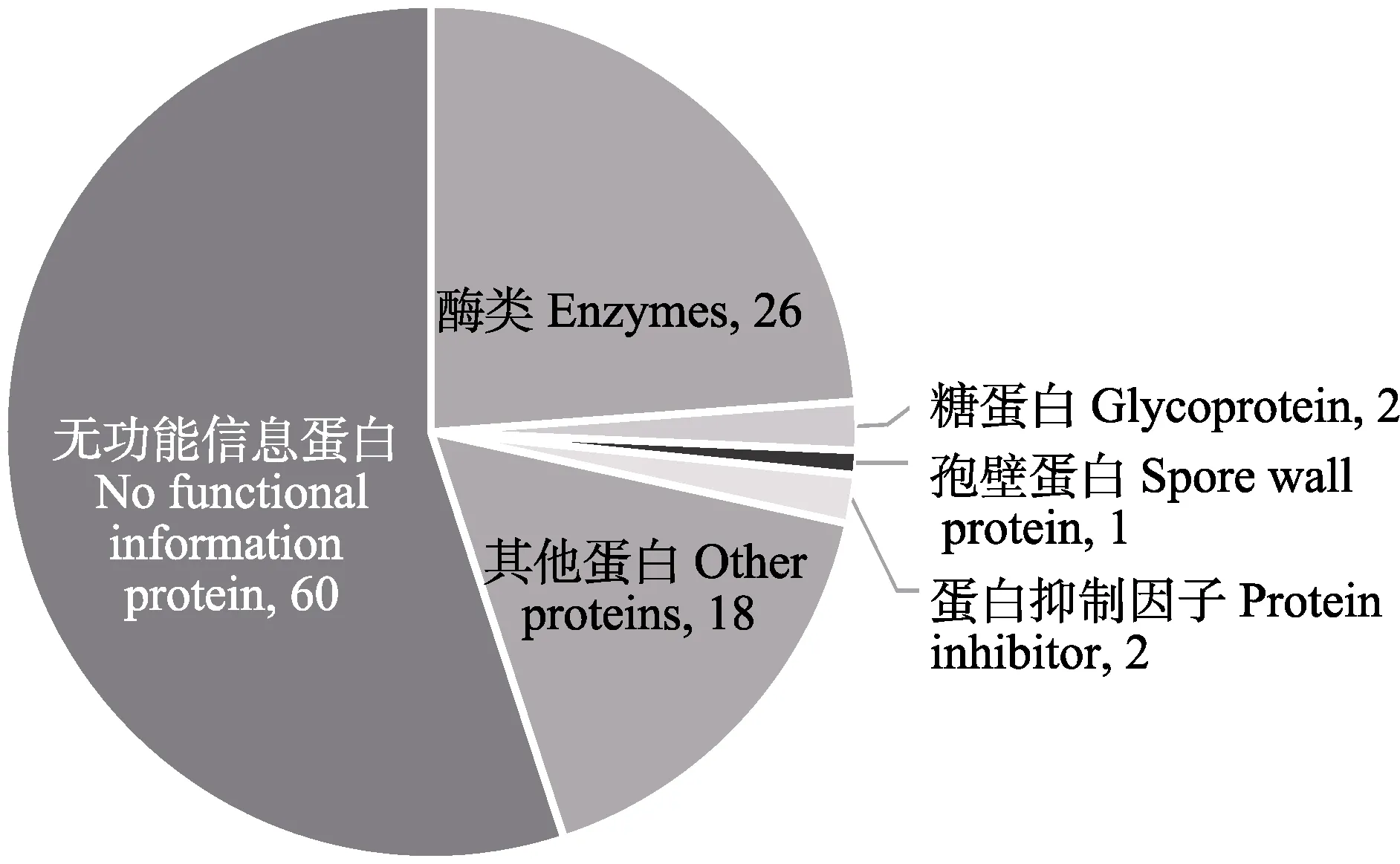
图1 虾肝肠胞虫分泌蛋白的功能分类Fig.1 Functional classification of EHP secreted proteins

图2 虾肝肠胞虫分泌蛋白氨基酸长度分析Fig.2 Analysis of the lengths of EHP scecreted proteins

图3 虾肝肠胞虫分泌蛋白信号肽长度分析Fig.3 Analysis of the signal peptides length of secreted proteins in EHP
对分泌蛋白和信号肽的氨基酸组成统计分析发现,分泌蛋白和信号肽均以疏水性氨基酸为主(图4)。分泌蛋白序列中疏水性氨基酸占比为42.57%,其次是亲水性氨基酸,占比为29.30%。而信号肽同样以疏水性氨基酸为主,占比高达68.93%,而亲水性氨基酸比例仅为22.42%。
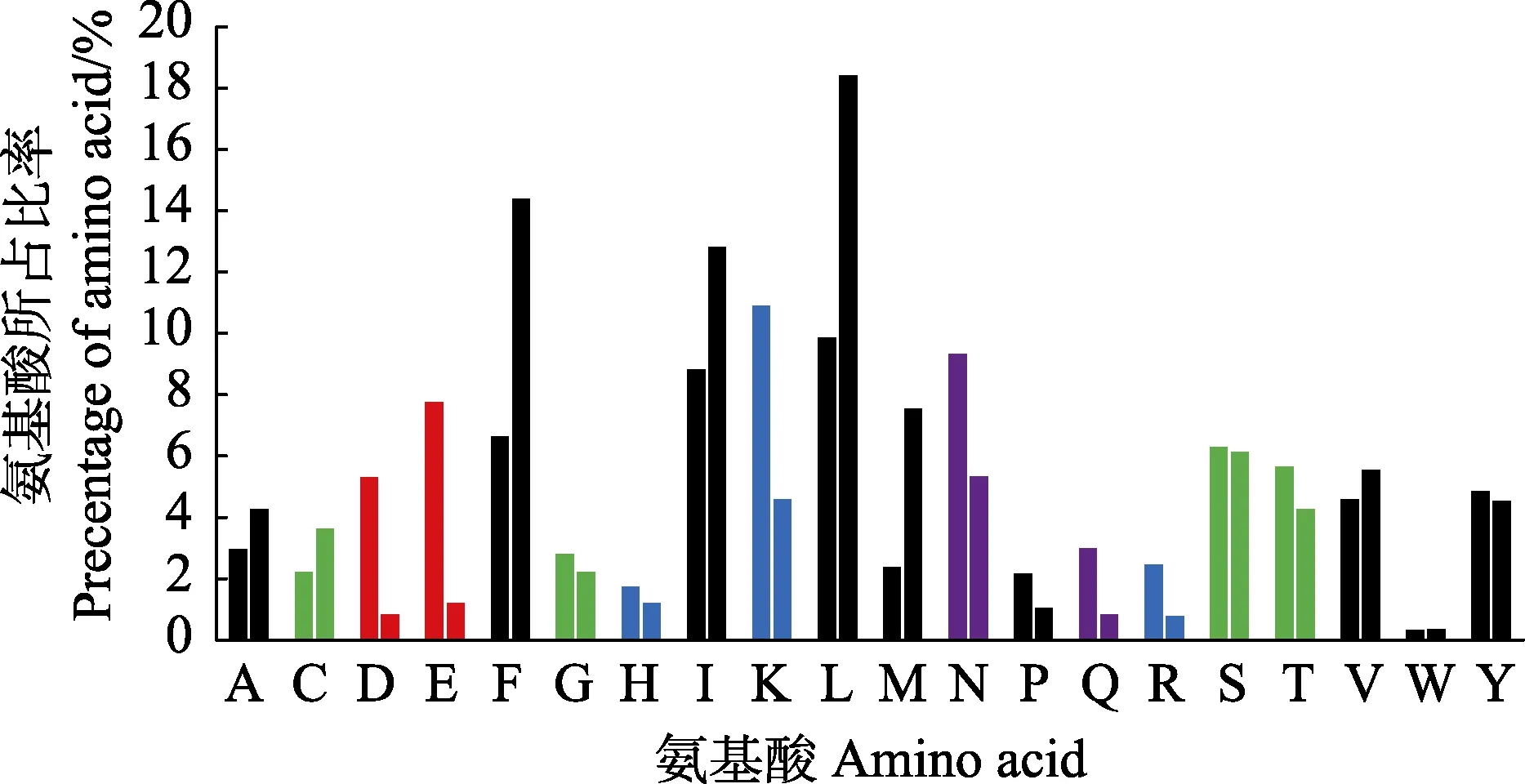
图4 虾肝肠胞虫分泌蛋白的氨基酸组成Fig.4 Amino acid composition of EHP secreted proteins
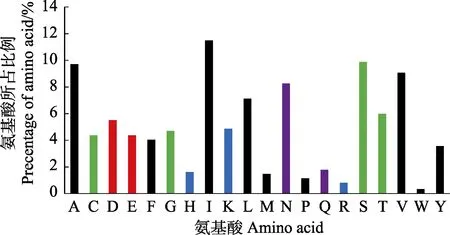
图5 虾肝肠胞虫分泌蛋白信号肽剪切位点处氨基酸的组成Fig.5 The composition of amino acids flanking the signal peptide splice site in the secretory proteins of EHP
2.3.2 信号肽剪切位点处氨基酸组成 统计信号肽剪切位点前后各3 个氨基酸的组成(图5),分析发现,与整个信号肽氨基酸组成类似,信号肽剪切位点氨基酸组成同样以疏水性氨基酸为主,其占比为47.90%,其中,异亮氨酸(I)和丙氨酸(A)含量最丰富;亲水性氨基酸占比为34.95%,其中,丝氨酸(S)和天冬酰胺(N)所占比例较高。从各个位置的氨基酸组成分析,上游的–3 位主要为异亮氨酸(I),–2 位主要为苯丙氨酸(F),紧邻信号肽剪切位点的–1 和1 位主要为丙氨酸(A),下游的3 位同样主要为异亮氨酸(I)(图6)。

图6 虾肝肠胞虫分泌蛋白信号肽剪切位点处氨基酸组成Fig.6 Composition patterns of amino acids flanking the signal peptide splice site in the secreted proteins of EHP
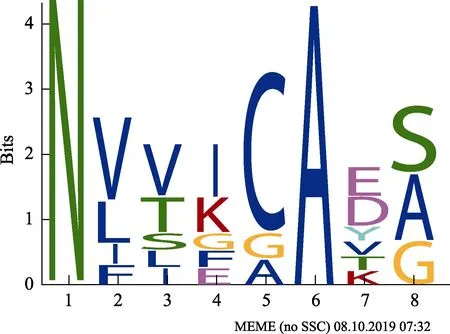
图7 虾肝肠胞虫分泌蛋白信号肽基序Fig.7 Motif in signal peptide of EHP secreted proteins
2.3.3 分泌蛋白和信号肽中的基序 对虾肝肠胞虫信号肽区域的基序分析,发现了1 种氨基酸组成模式:NV[VT][IK]CA[ED][SA](图7)。对其非信号肽区分析发现3 种基序:VAYDMFLSRCILHMLDVMMLYVE NESFMDQVAEVFCFNWTATEFYNSIIR,[QM]L[RK][FA]QN[TR][ND]G[SC][NK]D[NE][KE]I[SK][QE]L[KF][IE]KIK[TE][MI]C[NK][RK]I[ED][LA][IF][VI][NF][MK][VI][VE]Q[QA][QM][TQ][YN][QE][LI]K[ME]DD[PH]和SCFGKFSFPISNRSAEYFKTVYDQWNELTVKIPV KIYRTTL(图8)。
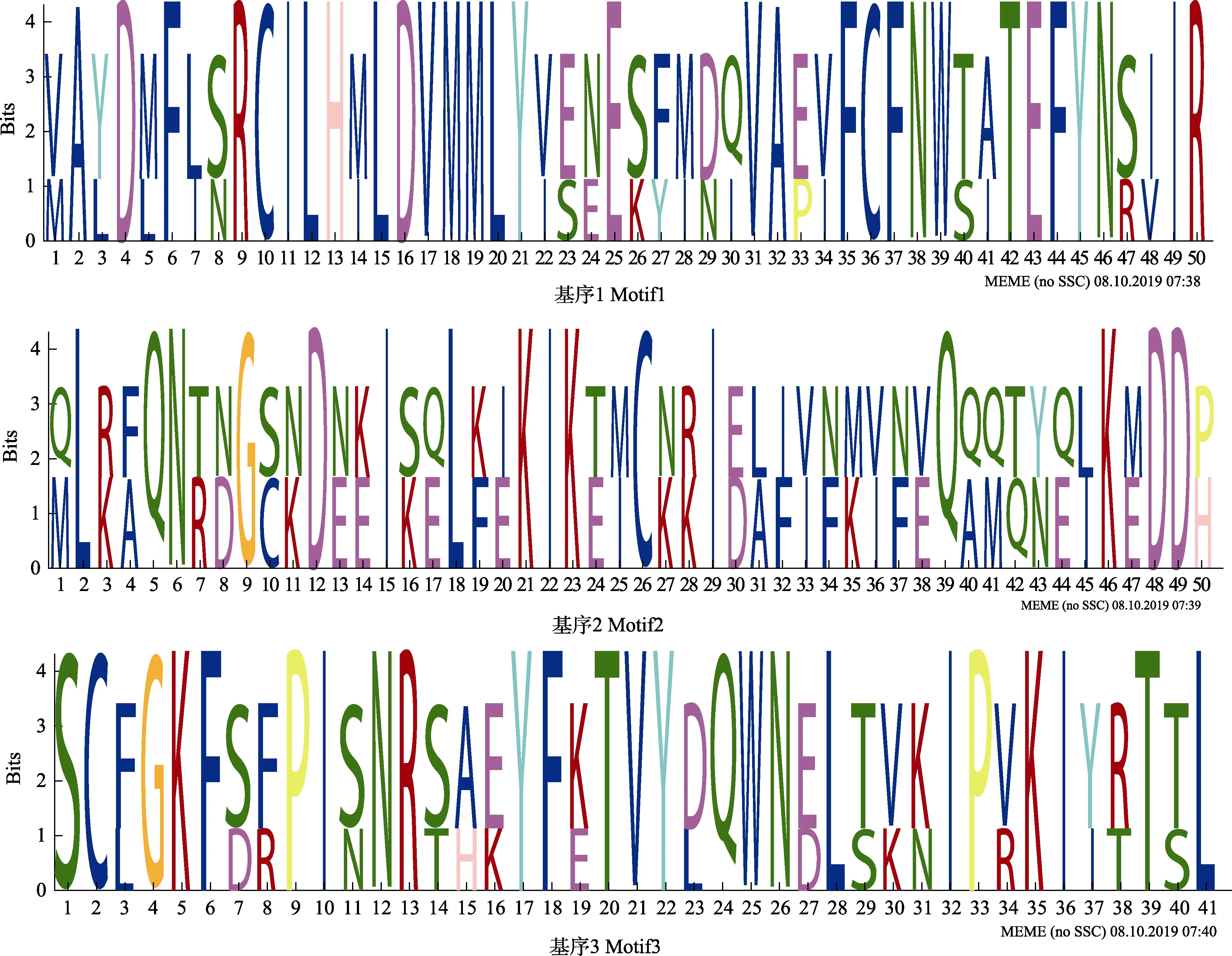
图8 虾肝肠胞虫非信号肽区基序Fig.8 Motif in non-signal peptide of EHP secreted proteins
3 讨论
对于专性胞内寄生的微孢子虫来说,目前,仅有一些关于孢壁蛋白分离方法的报道(吴正理等, 2007),尚没有分泌蛋白的分离方法。生物信息学算法的快速发展为成功预测微孢子虫的分泌蛋白提供了可能。本研究基于虾肝肠胞虫基因组数据库,运行EuSecPred 2.0 在线流程在全基因组2548 条蛋白质中进行筛选和预测,最终获得了109 条分泌蛋白,这些分泌蛋白组成以疏水性氨基酸为主,这与其信号肽和剪切位点前后各3 个氨基酸组成相一致。
本研究预测获得的 109 条分泌蛋白,其中,60 个是无功能注释的蛋白质,这部分蛋白质可能是虾肝肠胞虫分泌的特有蛋白质。在有明确功能注释的49 个分泌蛋白中,有些是与微孢子虫黏附和入侵相关的蛋白,如孢壁蛋白(Spore wall protein,SWP)、钙粘蛋白(Cadherin)和多肽N-乙酰氨基半乳糖转移酶12(Polypeptide N-acetylgalactosam inyltransferase 12,GALNT12)。孢壁(Spore wall)是微孢子虫最外层的结构,在侵染过程中,孢壁应最先与宿主细胞接触。孢壁蛋白作为孢壁的主要成分,对维持孢壁稳固结构和保护胞内原生质起着重要作用,同时直接参与侵染过程中与宿主细胞的特异性识别过程。Jaroenlak 等(2018)鉴定并分离了EHP 的第1 个孢壁蛋白(EhSWP1),在其N 末端发现了3 个肝素结合基序,进一步的体外结合实验、竞争实验和诱变研究表明,EhSWP1 能够和肝素结合进而引发入侵。同样,Yang 等(2018)研究证明,家蚕微孢子虫(Nosema bombycis)的部分孢壁蛋白在粘附和侵染过程中起关键作用,本研究中筛选的SWP7 也可能与EHP 的入侵相关。钙粘蛋白是1 种Ca 依赖的细胞粘着糖蛋白,可能与宿主细胞的靶向信号识别并粘附;同时,Frixione 等(1994)研究表明,Ca2+会以某种方式触发孢子萌发。GALNT12 是合成O-糖链的起始酶,而粘蛋白主要由O-糖链组成,参与很多与粘附相关的过程,O-糖链还可调控细胞表面受体的表达,进而影响细胞的生长和凋亡(刘可人等,2006)。因此,推测EHP 侵染过程中分泌的GALNT1可能参与到宿主细胞的识别和粘附。
在这些分泌蛋白中还有一些抑制宿主免疫功能的分泌蛋白。α-胰蛋白酶抑制剂重链H1(Inter-alphatrypsin inhibitor heavy chain H1, ITIH1)可调控细胞外基质稳定并抑制C5 转化酶活性(Zhuo et al, 2008),进而抑制宿主免疫系统。泛素羧基末端水解酶(Ubiquitin carboxyl-terminal hydrolase,UCH)可水解被泛素(Ubiquitin)标记的需要被分解的蛋白质,也可以标记跨膜蛋白,然后通过酶促反应相互连接,进而介导靶蛋白的降解或跨膜运输。Ciechanover 等(2000)研究表明,泛素蛋白水解系统在广泛的细胞基本过程中发挥重要作用。其中,包括调节细胞周期、调节免疫和炎症反应、控制信号转导途径、发育和分化、DNA修复等。这些复杂的过程是通过蛋白质的单个或子集的特异性降解来控制的。虾肝肠胞虫UCH7 在侵染过程中的信号传递及调控宿主免疫方面行使何种功能尚需研究进行明确。
另外,还有调控细胞增殖的蛋白,比如亮氨酸拉链假定肿瘤抑制因子2 (Leucine zipper putative tumor suppressor, LZTS2),拥有特定的亮氨酸拉链结构域(LZ),参与Wnt/β-catenin信号通路调控β-catenin的表达及细胞内分布,与NF-κB拥有广泛的相互作用,从而调控细胞增殖和凋亡(Peng et al, 2011; 王枭雄等,2014)。在微管系统中,LZTS2也有重要的调节作用,可抑制细胞的有丝分裂和迁移(张轶等, 2016)。EHP分泌的LZTS2是否能抑制宿主细胞的增殖和迁移从而抑制宿主细胞行使其功能尚需进一步研究。
分泌蛋白在多种寄生虫系统中介导粘附和侵袭,对于明确胞内寄生虫的感染机制至关重要。本研究初步筛选了109 个分泌蛋白,接下来进一步对这些分泌蛋白进行功能研究对于理解虾肝肠胞虫的入侵机理具有重要意义。

