贵州地方白羽鸡种MSTN基因SNP位点快速筛查及其蛋白功能预测
龙广丽 牟腾慧 刘洋 饶永超 杨德凤 谭光辉 林家栋 傅筑荫 张福平


摘要:【目的】明確贵州地方白羽鸡种肌肉生长抑制素(MSTN)基因的多态性,筛选出改良白羽鸡肉质品质的分子遗传标记,为选择培育优良肉质鸡种提供参考依据。【方法】以兴义矮脚鸡白羽品系、罗曼蛋鸡及兴义矮脚鸡白羽品系与罗曼蛋鸡杂交的自交后代(F2)为研究对象,提取3个鸡种的血液基因组DNA构建DNA混合池,PCR扩增MSTN基因全部外显子序列,直接测序筛选SNP位点并进行生物信息学分析,探究SNP位点突变对MSTN基因mRNA二级结构及编码蛋白结构和功能的影响。【结果】在鸡MSTN基因第1外显子(Exon-1)筛查到6个SNPs位点,分别为G51A、A60G、G195C、A234G、C297T和C324T,且6个SNPs位点均为同义突变。在A234G位点处检测到兴义矮脚鸡白羽系和F2代存在多态性,但罗曼蛋鸡未发生变异;在C297T位点处检测到罗曼蛋鸡存在多态性,以C为优势等位基因,而兴义矮脚鸡白羽品系和F2代均未发生变异;G51A、G60A、G159C和C324T等4个SNPs位点在3个鸡种中均存在多态性。A234G位点突变对鸡MSTN基因mRNA二级结构稳定性无影响,G51A位点突变致使MSTN基因mRNA二级结构最小自由能降低但未改变其构象,A60G、G195C、C297T和C324T等4个SNPs位点突变均引起MSTN基因mRNA二级结构和最小自由能的改变。鸡MSTN基因编码蛋白为不稳定的脂溶性蛋白,存在信号肽,但不存在跨膜区域,其二级结构由无规则卷曲、β-折叠和α-螺旋组成,且以无规则卷曲占比最高。【结论】MSTN基因在贵州地方白羽鸡种中的多态性较丰富,其中A60G、G195C、C297T和C324T等4个SNPs位点突变会导致基因mRNA二级结构的构象发生改变,可作为改良白羽鸡肉质品质的分子遗传标记进一步研究。
关键词: 贵州地方白羽鸡种;MSTN基因;肉质性状;SNP位点;多态性;生物信息学
中图分类号: S831.89 文献标志码: A 文章编号:2095-1191(2020)08-1840-09
Rapid screening and protein function prediction of MSTN gene SNP sites in Guizhou local chicken breeds
LONG Guang-li1,2,3, MOU Teng-hui1,2,3, LIU Yang1,2,3, RAO Yong-chao1,2,3,
YANG De-feng1,2,3, TAN Guang-hui1,2, LIN Jia-dong1,2, FU Zhu-yin2,3,
ZHANG Fu-ping1,2,3*
(1College of Animal Science, Guizhou University/Key Laboratory of Animal Genetics, Breeding and Reproduction in the Plateau Mountainous Region, Ministry of Education/Key Laboratory of Animal Genetics, Breeding and Reproduction in Guizhou, Guiyang 550025, China; 2Institute of Poultry, Guizhou University, Guiyang 550025, China;
3Scientific Research Chicken Farm of Guizhou University, Guiyang 550025, China)
Abstract:【Objective】To identify the polymorphism of the myostatin (MSTN) gene of Guizhou local white feather chicken breeds, screen out ideal molecular genetic markers which could improve the meat quality of white feather chi-ckens, and provide a reference for selecting and breeding excellent broiler chicken breeds. 【Method】Taking Xingyi bantam white feather line, Roman laying chicken and self-progeny(F2) of cross between Xingyi bantam white feather line and Roman laying chicken as the research object, the blood genomic DNA of three chicken breeds was extracted to construct a DNA mixing pool. The PCR amplification of all exon sequences of MSTN gene was directly sequenced and screened. Then the SNP sites were bioinformatically analyzed to explore the impact of SNP site mutations on the se-condary structure of MSTN gene mRNA and the structure and function of the encoded protein. 【Result】Six SNPs sites were screened in the first exon(Exon-1) of the chicken MSTN gene, which were G51A, A60G, G195C, A234G, C297T and C324T, and the six SNPs sites were all synonymous mutations. At the A234G locus, polymorphisms were detected in the Xingyi bantam white feather line and F2 generation, but no mutations occurred in the Roman laying chickens; polymorphisms were detected in the Roman laying chickens at the C297T locus, with C as the dominant position. There were no mutations in Xingyi bantam white feather line and F2 generation. At four SNPs, including G51A, G60A, G159C and C324T, polymorphisms were all detected in three chicken breeds. A234G site mutation had no effect on the stability of the secondary structure of chicken MSTN gene mRNA. G51A site mutation reduced the minimum free energy of mRNA secon-dary structure but did not change its conformation. Four SNPs site mutations including A60G, G195C, C297T and C324T caused changes in the secondary structure and minimum free energy of MSTN gene mRNA. The chicken MSTN gene encoding protein was an unstable fat-soluble protein with a signal peptide but no transmembrane regions. Its secondary structure consisted of random coils, β-fold and α-helixes, with random coils accounting for the highest proportion. 【Conclusion】The MSTN gene has abundant polymorphisms in Guizhou local white feather chicken breeds. Among them, four SNPs mutations such as A60G, G195C, C297T and C324T cause changes in the conformation of the gene mRNA secondary structure, which can be used to do further studies as molecular genetic markers improving the quality of white feather chicken.
Key words: Guizhou local white feather chicken breeds; MSTN gene; meat quality traits; SNP site; polymorphism; bioinformatics
Foundation item: Guizhou Science and Technology Planning Project(QKHZC〔2016〕2507)
0 引言
【研究意义】兴义矮脚鸡白羽系主产于贵州黔西南州兴义市,其胫短身矮、体躯匀称、全身羽毛白色,为隐性白羽鸡,在生产性能和肉质方面具有许多优良特性,但产蛋性能不高(朱丽莉等,2011;李林洪,2019)。罗曼蛋鸡的产蛋率高,蛋品质优良(刘雅正,2014),但至今针对其肉质方面的相关研究甚少。优势杂交可显著提高畜禽的生产性能和经济效益(王芬和王鹏,2009),目前国内隐性白羽鸡在杂交育种中主要用作母本(李俊英,2005)。选用兴义矮脚鸡白羽系作为配套母本与罗曼蛋鸡杂交,其后代具有较高的生产性能,但在生产性能改良过程中兴义矮脚鸡白羽系杂交后代的体型发生明显变化,因此,亟待筛选出白羽鸡肉质品质的理想分子遗传标记,在不改变地方鸡种优质性能的前提下有效提高白羽鸡的产肉性能。【前人研究进展】肌肉生长抑制素(Myostatin,MSTN)又称为生长分化因子8(Growth differentiation factor-8,GDF-8),可抑制成肌细胞的活化、增殖和分化(McFarland et al.,2007)。MSTN基因是转化生长因子β(TGF-β)超家族成员之一,其特异性表达于畜禽肌肉组织中(McPherron et al.,1997)。MSTN基因作为胞外信号分子能与成肌细胞膜上的受体结合而引起受体自身磷酸化,启动细胞内一系列信号传导途径,作用于生肌决定因子靶基因的调控区,调节肌肉组成蛋白基因表达,进而对骨骼肌的生长发育起负调控作用(Lee,2004;Grade et al.,2009;赵义龙等,2017)。MSTN基因突变或缺失可使家畜表现出肌肉超级发达的双肌性状(郑云,2007;杨永生等,2012;赵振华等,2015),在负向调控肌细胞的过程中若MSTN活性丧失或减弱,则无法正常调节肌纤维沉积,导致动物肌肉过度发育(Grobet et al.,1997;Bellinge et al.,2005;张贤娴等,2018)。近年来的相关研究显示,MSTN基因作为畜禽生长发育及肉用性状相关的候选基因,其在胚胎发育过程中的免疫中和作用可促进肌肉生长(Kim et al.,2006),同时参与脂肪代谢过程,抑制脂肪形成(Guo et al.,2008),进而调节动物肌肉与脂肪的比例,在改善畜禽肉质方面具有极高的研究价值(曹婷等,2017)。Fontanesi等(2011)研究发现家兔MSTN基因SNP位点突变与其肝脏和胴体量相关;Xu等(2013)研究表明北京鸭MSTN基因多态性与其胸肌肌肉厚度显著相关;Zhang等(2015)研究发现,MSTN基因c.234G>A突变位点可作为辅助育种分子标记,以提高鸡的繁殖效率;Mitrofanova等(2017)在分析鸡MSTN基因SNP多态性时发现,AA基因型个体的活重明显高于其他基因型個体。可见,MSTN基因是繁育优良肉质鸡种的一个重要候选基因。【本研究切入点】鸡MSTN基因全长5493 bp,包含3个外显子(刘雪颖,2008),但至今有关白羽鸡MSTN基因多态性及其蛋白结构的研究鲜见报道。【拟解决的关键问题】以兴义矮脚鸡白羽品系、罗曼蛋鸡及兴义矮脚鸡白羽品系与罗曼蛋鸡杂交的自交后代(F2)为研究对象,构建DNA混合池,PCR扩增MSTN基因全部外显子序列,直接测序筛选SNP位点并进行生物信息学分析,明确SNP位点突变对MSTN基因mRNA二级结构及编码蛋白结构和功能的影响,旨在筛选出改良白羽鸡肉质性状的分子遗传标记,为选择培育优良肉质鸡种提供参考依据。
1 材料与方法
1. 1 试验材料
兴义矮脚鸡白羽品系(B)、罗曼蛋鸡(L)及F2代各60份血液样品,均采自贵州大学科研鸡场,所有血液样品均置于肝素钠抗凝真空采血管中,-20 ℃保存备用。血液基因组DNA提取试剂盒、GoldView核酸染料、DL2000 DNA Marker和2×Taq Master Mix均购自生工生物工程(上海)股份有限公司;TBE缓冲液、双蒸水和琼脂糖等试剂购自上海鼎国生物技术有限公司。
1. 2 基因组DNA提取
利用血液基因组DNA提取试剂盒提取血液样品基因组DNA,以1.0%琼脂糖凝胶电泳检测提取效果,用紫外分光光度计测量各DNA样品浓度,测量3次取平均值,并将所有DNA样品浓度调至100 ng/μL,各取10.0 μL构建不同鸡种的DNA混合池。
1. 3 引物设计及PCR扩增
根据GenBank已公布的鸡MSTN基因序列(登录号NC_006094.5),运用Primer Premier 5.0设计引物(表1),并委托生工生物工程(上海)股份有限公司合成。PCR反应体系25.0 μL:2×Taq Master Mix 12.5 μL,上、下游引物各1.0 μL,DNA模板1.0 μL,双蒸水9.5 μL。扩增程序:94 ℃预变性3 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,进行35个循环;72 ℃延伸10 min,4 ℃保存。PCR扩增产物用1.0%琼脂糖凝胶电泳进行检测。
1. 4 序列校对及等位基因频率估算
利用DNASTAR中的MegAlign和EditSeq程序结合测序峰图,拼接得到白羽鸡种MSTN基因编码区(CDS)序列,然后与GenBank已公布的鸡MSTN基因CDS序列进行比对,鉴定筛选出SNP位点。运用SeqMan分析测序峰图,采用MWSnap v3.00.74中的标尺测量各SNP位点等位基因的相应峰高,并按照崔建勋等(2005)、祖盘玉等(2019)的方法估算等位基因频率。
fi=hi/(h1+h2)
式中,fi表示SNP位点某等位基因频率,h1和h2分别表示测序峰图某等位基因1峰和2峰的高度。
1. 5 生物信息学分析
参照翁吉梅等(2018)的研究方法对3个鸡种的MSTN基因进行生物信息学分析。采用RNAfold和RNA structure预测不同SNP位点及其突变前后对MSTN基因mRNA二级结构的影响,并以PredictProtein预测SNP位点突变前后的MSTN蛋白二级结构。
2 结果与分析
2. 1 PCR扩增结果
PCR扩增得到鸡MSTN基因的全部外显子序列(Exon-1、Exon-2和Exon-3),经1.0%琼脂糖凝胶电泳检测显示,电泳条带单一、明亮清晰,无拖带等现象,说明扩增效果良好,且片段大小与预期结果相符。图1为鸡MSTN基因Exon-1的PCR擴增电泳检测结果。
2. 2 测序分析结果
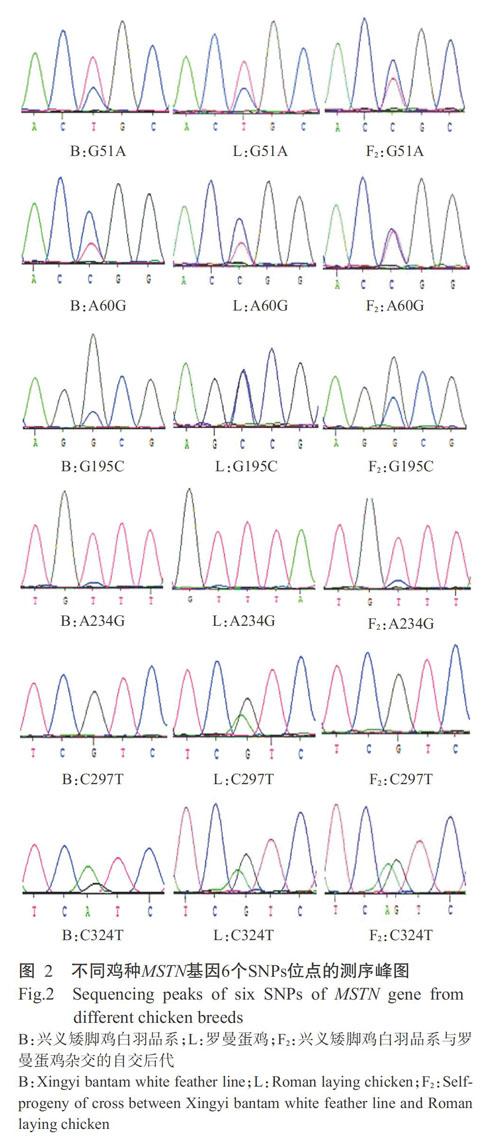
以鸡MSTN基因(登录号NC_006094.5)为参考序列,采用DNA混合池(每个品种60份血液样品,各取1.0 μL)结合PCR直接测序法对鸡MSTN基因外显子序列上的SNP位点进行鉴定,再运用DNASTAR等在线软件对所得序列进行比对分析,结果在鸡MSTN基因Exon-1上筛查到6个SNPs位点(图2),分别是G51A、A60G、G195C、A234G、C297T和C324T,且6个SNPs位点均为同义突变。
2. 3 等位基因频率估算结果
利用MWSnap v3.00.74中的标尺测量不同鸡种MSTN基因6个SNPs位点的等位基因峰值,并估算等位基因频率,结果(表2)显示,在A234G位点处检测到兴义矮脚鸡白羽系和F2代存在多态性,但罗曼蛋鸡未发生变异;在G159C位点处检测到罗曼蛋鸡的G和C基因频率差异不明显,而在兴义矮脚鸡白羽系和F2代均以G为优势等位基因;在C297T位点处检测到罗曼蛋鸡存在多态性,以C为优势等位基因,而兴义矮脚鸡白羽品系和F2代均未发生变异。G51A、A60G、G159C和C324T等4个SNPs位点在3个鸡种中均存在多态性。
2. 4 生物信息学分析结果
2. 4. 1 mRNA二级结构预测分析结果 采用RNAfold预测不同鸡种MSTN基因SNP位点突变前后各基因型的mRNA二级结构,结果如图3所示。A234G位点突变未引起MSTN基因mRNA二级结构构象及最小自由能的改变,即对其稳定性无影响;A60G、G195C和C297T位点突变致使MSTN基因mRNA二级结构的最小自由能分别增加至-282.90、 -281.90和-281.20 kcal/mol,结构稳定性降低;而G51A和C324T位点突变致使MSTN基因mRNA二级结构的最小自由能分别降低为-284.30和-286.10 kcal/mol,结构稳定性增强。此外,A60G、G195C、C297T和C324T位点突变会导致MSTN基因mRNA二级结构的构象发生改变,但G51A和A234G位点突变未改变MSTN基因mRNA二级结构的构象。
2. 4. 2 MSTN蛋白理化性质预测分析结果 ProtParam预测分析结果表明,鸡MSTN蛋白由375个氨基酸残基构成,其相对分子量为42707.04 Da,总原子数为5983,分子式为C1903H2986N510O562S22,理论等电点(pI)为6.93,正、负电荷氨基酸残基均有46个。在含有的常见20种氨基酸中,所占比例最高的是亮氨酸(Leu),占总氨基酸的8.0%;所占比例最低的是组氨酸(His),占1.3%;无吡咯赖氨酸(Pyl)和硒半胱氨酸(Sec)。鸡MSTN蛋白不稳定系数为43.68,属于不稳定性蛋白;其平均亲水性为(-0.392),属于脂溶性蛋白。
2. 4. 3 信号肽预测分析结果 采用SignalP 4.0对鸡MSTN蛋白信号肽进行预测,结果(图4)表明,C分值为0.124,Y分值为0.260,S分值为0.560(若S分值平均值高于0.500,则为分泌蛋白,且存在信号肽),说明鸡MSTN蛋白存在信号肽,属于分泌蛋白。
2. 4. 4 MSTN蛋白跨膜结构预测结果 以TMHMM 2.0预测分析鸡MSTN蛋白跨膜结构,结果发现组成MSTN蛋白的375个氨基酸残基均在膜外(图5),不存在跨膜区域。
2. 4. 5 MSTN蛋白亚细胞定位分析结果 PSORT II Prediction的蛋白亚细胞定位结果表明,鸡MSTN蛋白在细胞质(47.8%)、细胞核(21.7%)、细胞膜(13.0%)和细胞骨架(4.3%)中发挥生物学作用。
2. 4. 6 MSTN蛋白二级结构分析结果 SOPMA预测结果表明,在鸡MSTN蛋白二级结构中所占比例最高的是无规则卷曲(图6),属于混合型蛋白。其中,α-螺旋主要形成于第2~18、40~42、46~63、74~79、86~96、111~112、209~217、290~293和327~328位氨基酸残基;β-折叠在第115~120、136~141、150~153、155~160、169~179、187~195、203~207、225~231、238~240、252~257、280~289、296~299、304~305、307~311、325~326、343~345、349~353、359~364和368~371位氨基酸残基处分布较多;无规则卷曲则在第1~2、19~39、43~45、64~73、80~85、97~110、113~114、121~135、142~149、154、161~168、180~186、196~202、208、218~224、232~237、241~251、258~279、294~295、300~303、306、312~324、329~342、346~348、354~358、365~367和372~375位氨基酸残基处分布较多。
3 讨论
在鸡的肌肉发生、生长和发育过程中,MSTN基因发挥着重要作用,其CDS序列具有丰富多态性,对鸡的生长性状有显著影响(Dushyanth et al.,2016)。张冉和林浴霜(2012)研究发现,在鸡胚发育过程中不同鸡品种及不同发育阶段的MSTN基因表达量存在明显差异,说明MSTN对不同鸡品种肌肉发育的调节能力存在差异,而导致肌纤维数量及肌肉含量不同。左斌等(2015)研究表明,MSTN基因主要影响鸡的生长性状,可作为地方鸡品种选育的候选基因。王彦钦和邵勇钢(2017)研究发现,MSTN基因多态性与拜城油鸡体重、屠体重、半净膛重、全净膛重、胸肌重和腿肌重等生产性能指标密切相关,故推测该基因可作为拜城油鸡选育的分子遗传标记。此外,有研究发现MSTN基因多态性对12周龄鸡屠宰及肉质性能的各项指标均有影响,说明MSTN基因不仅在骨骼肌的生长发育过程中发挥作用,还可能参与脂质代谢和脂肪沉积(顾志良等,2003)。MSTN基因是提高畜禽肌肉产量和改善肉品质研究的首选基因(王巧巧等,2018),作为肌肉发育的負向调控因子,可通过影响MyoD、Myogenin和Myf5等基因控制肌细胞从G1期到G2期及G2期到M期的转变,进而影响肌肉的发育过程(Feldman et al.,2006)。李维等(2017)研究发现,MSTN基因对赤水乌骨鸡肉质指标中的pH和剪切力具有明显影响,推测该基因参与调控赤水乌骨鸡肉质性状。可见,MSTN基因是影响鸡肉质性状的主效基因之一,探究MSTN基因SNP位点突变对基因表达的影响,对提高白羽鸡的养殖效益具有重要意义。
本研究在鸡MSTN基因Exon-1上发现G51A、A60G、G195C、A234G、C297T和C324T等6个SNPs位点,均为同义突变,未改变编码氨基酸序列,由于密码子的简并性,同义密码子的使用频率存在差异,但对MSTN基因表达是否产生影响还有待进一步探究。此外,在G159C位点检测到罗曼蛋鸡的G和C基因频率差异不明显,而在兴义矮脚鸡白羽系和F2代中均以G为优势等位基因,说明罗曼蛋鸡与其他2个鸡种在该位点处存在明显差异。在MSTN基因Exon-2和Exon-3上未发现SNP位点,与毛亮等(2009)对藏鸡MSTN基因、温彦涛等(2012)对优质鸡S3系MSTN基因的多态性检测结果相似,但与张丽等(2018)对静宁鸡MSTN基因进行SNP位点筛查的结果相比,G51A、C297T和C324T是新发现的SNP位点,可能是相对于Exon-1,Exon-2和Exon-3更加保守所致。鸡MSTN蛋白理化性质预测结果显示,亮氨酸的占比最高,组氨酸的占比最低,且未发现吡咯赖氨酸和硒半胱氨酸;其不稳定系数为43.68,即MSTN蛋白属于不稳定性蛋白,与任卫合等(2018)的研究结果相似。
CDS序列上的核苷酸突变可能引起基因mRNA二级结构及其编码蛋白结构改变,进而影响其生物学功能(李倩,2013)。采用RNAfold对鸡MSTN基因mRNA二级结构的预测结果显示,A234G位点突变未引起MSTN基因mRNA二级结构改变;A60G、G195C和C297T位点突变导致MSTN基因mRNA二级结构的最小自由能增加,mRNA二级结构稳定性降低;G51A和C324T位点突变则致使MSTN基因mRNA二级结构的最小自由能降低,mRNA二级结构稳定性增强。此外,鸡MSTN蛋白二级结构中以无规则卷曲结构数量最多,属于混合型蛋白,与任卫合等(2018)、张丽等(2018)的研究结果相似,即均以无规则卷曲占比最高。无规则卷曲的增加易改变蛋白质构象,进而影响其生物学功能(郑海军等,2013),但由于使用的预测软件不同,致使其他结构区域的占比略有差异,因此鸡MSTN蛋白的结构与功能还需进一步探究。
4 结论
MSTN基因在贵州地方白羽鸡种中的多态性较丰富,其中A60G、G195C、C297T和C324T等4个SNPs位点突变会导致基因mRNA二级结构的构象发生改变,可作为改善白羽鸡肉质品质的分子遗传标记进一步研究。
参考文献:
曹婷,周汉林,荀文娟,施力光,周雄,侯冠彧. 2017. MSTN基因对猪骨骼肌发育调控的作用及其研究进展[J]. 基因组学与应用生物学,36(4):1511-1517. [Cao T,Zhou H L,Xun W J,Shi L G,Zhou X,Hou G Y. 2017. The effect of MSTN gene in the regulation of skeletal muscle development of pig and its research progress[J]. Genomics and Applied Biology,36(4):1511-1517.]
崔建勋,杜红丽,张细权. 2005. 利用DNA池和测序技术快速筛查SNPs及估算基因频率[J]. 遗传学报,32(4):372-377. [Cui J X,Du H L,Zhang X Q. 2005. Rapidly scree-ning SNPs and estmiating allelic frequencies by DNA pooling and sequencing[J]. Acta Genetica Sinica,32(4):372-377.]
顾志良,朱大海,李宁,李辉,邓学梅,吴常信. 2003. 鸡Myostatin基因单核苷酸多态性与骨骼肌和脂肪生长的关系[J]. 中国科学(C辑),33(3):273-280. [Gu Z L,Zhu D H,Li N,Li H,Deng X M,Wu C X. 2003. Relationship between single nucleotide polymorphism of chicken Myostatin gene and skeletal muscle and fat growth[J]. Science in China (Series C),33(3):273-280.]
李俊英. 2005. 不同优质鸡品种与隐性白羽肉鸡杂交组合的屠体及肉品质性状分析[D]. 北京:中国农业大学. [Li J Y. 2005. Analysis of carcass and meat quality traits of crosses of different quality chicken and recessive white plymouth rock[D]. Beijing:China Agricultural University.]
李洪林. 2019. 贵州地方鸡种隐性白羽与慢羽分子标记研究与应用[D]. 贵阳:贵州大学. [Li H L. 2019. Study and application of recessive white feather and slow feather molecular markers in Guizhou local chicken breeds[D]. Guiyang:Guizhou University.]
李维,祖盘玉,李洪林,林家栋,张福平. 2017. 赤水乌骨鸡肌肉生长抑制素基因多态性及其与肉质性状的关联分析[J]. 中国畜牧兽医,44(4):1115-1121. [Li W,Zu P Y,Li H L,Lin J D,Zhang F P. 2017. Polymorphisms of MSTN gene and its association with meat quality traits in Chishui black-bone chicke[J]. China Animal Husbandry & Veterinary Medicine,44(4):1115-1121.]
李倩. 2013. mRNA二级结构与基因功能和基因必要性的关系[D]. 杨凌:西北农林科技大学. [Li Q. 2013. Correlations among mRNA secondary structrue,gene functions and essentiality[D]. Yangling:Northwest A & F University.]
劉雪颖. 2008. 藏鸡三个基因的SNPs检测及其与生长性状的关联分析和金水乌鸡资源群体的构建[D]. 武汉:华中农业大学. [Liu X Y. 2008. Tibetan chicken SNPs detection of three chicken genes and their association with growth traits and construction of resource population for Jinshui Silky[D]. Wuhan:Huazhong Agricultural University.]
刘雅正. 2014. 罗曼蛋鸡营养需要[J]. 国外畜牧学:猪与禽,(5):47. [Liu Y Z. 2014. Nutritional needs of Luoman Laying hens[J]. Foreign Animal Husbandry: Pigs and Avians,(5):47.]
毛亮,徐亚欧,麻丽霞. 2009. 藏鸡肌肉生长抑制素基因克隆及序列分析[J]. 西南民族大学学报(自然科学版),35(4):772-775. [Mao L,Xu Y O,Ma L X. 2009. Study on cloning of the MSTN gene in the Tibetan gallus[J]. Journal of Southwest University for Nationalities(Natural Science Edition),35(4):772-775.]
任卫合,任稳稳,马博妍,高成宏,李宏旭,刘丽霞,曹忻,张丽. 2018. 大耳白兔MSTN基因SNPs位点筛查及生物信息学分析[J]. 浙江农业学报,30(12):2018-2023. [Ren W H,Ren W W,Ma B Y,Gao C H,Li H X,Liu L X,Cao X,Zhang L. 2018. SNPs screening and bioinforma-tics analysis of MSTN gene in white rabbits[J]. Acta Agriculturae Zhejiangensis,30(12):2018-2023.]
王芬,王鹏. 2009. 朗德鹅与昌图豁鹅杂交后代性能试验[J]. 中国畜禽种业,(10):144-145. [Wang F,Wang P. 2009. Performance test of hybrid offspring of Landes goose and Changtu goose[J]. The Chinese Livestock and Poultry Breeding,(10):144-145.]
王巧巧,王亚南,唐辉,王金忠,高翔,李显耀. 2018. 鸡肌纤维发育相关基因研究进展[J]. 家禽科学,(5):43-48. [Wang Q Q,Wang Y N,Tang H,Wang J Z,Gao X,Li X Y. 2018. Advances in research on genes related to chi-cken muscle fiber development[J]. Poultry Science,(5):43-48.]
王彦钦,邵勇钢. 2017. 拜城油鸡肌肉生长抑制素基因多态性与生产性能的相关性研究[J]. 中国畜牧兽医,44(4):1054-1060. [Wang Y Q,Shao Y G. 2017. Study on the association relationship between the polymorphism of MSTN gene and production performance in Baicheng fatty chicken[J]. China Animal Husbandry & Veterinary Medicine,44(4):1054-1060.]
温彦涛,武子寅,赵振华,李春苗,黎寿丰,王杏龙. 2012. 鸡MSTN基因多态性及其与屠体性状的关联分析[J]. 中国家禽,34(16):29-32. [Wen Y T,Wu Z Y,Zhao Z H,Li C M,Li S F,Wang X L. 2012. Polymorphisms in exon 1 of myostatin gene and its relationship with carcass traits in chicken[J]. China Poultry,34(16):29-32.]
翁吉梅,罗铮,徐伟,封竣琪,蔡惠芬,罗卫星,陈说. 2018. 黔北麻羊FTO基因SNPs筛选及其生物信息学分析[J]. 中国畜牧杂志,54(9):39-45. [Weng J M,Luo Z,Xu W,Feng J Q,Cai H F,Luo W X,Chen S. 2018. Screen and bioinformatics analysis of FTO gene SNPs in Qianbei Ma goat[J]. Chinese Journal of Animal Science,54(9):39-45.]
杨永生,贺建华,邓惠中,谢红兵,江碧波,罗佳捷. 2012. 肌肉生长抑制素对动物肌肉、脂肪和骨骼的影响[J]. 动物营养学报,24(2):220-225. [Yang Y S,He J H,Deng H Z,Xie H B,Jiang B B,Luo J J. 2012. Myostain:Effects on muscle,fat and bone of animals[J]. Chinese Journal of Animal Nutrition,24(2):220-225.]
张丽,刘丽霞,戴洪伟,陈红,王瑞,岳炳辉. 2018. 静宁鸡肌肉生长抑制素基因单核苷酸多态性筛查及生物信息学分析[J]. 浙江大学学报(农业与生命科学版),44(5):629-637. [Zhang L,Liu L X,Dai H W,Chen H,Wang R,Yue B H. 2018. Single nucleotide polymorphism scree-ning and bioinformatics analysis of myostatin gene in Jingning chicken[J]. Journal of Zhejiang University(Agri-culture & Life Sciences),44 (5):629-637.]
張冉,林浴霜. 2012. 不同品种鸡MSTN基因表达差异的研究[J]. 中国家禽,34(6):61-63. [Zhang R,Lin Y S. 2012. Study on the difference of MSTN gene expression in different breeds of chickens[J]. China Poultry,34(6):61-63.]
张贤娴,冉金山,任鹏,李菁菁,尹玲倩,许应锋,陈异,黎志强,刘益平. 2018. 鸡肌肉生长抑制素基因单核苷酸多态性检测及其与生长性状的关联性分析[C]//中国畜牧兽医学会. 中国畜牧兽医学会2018年学术年会禽病学分会第十九次学术研讨会论文集:416. [Zhang X X,Ran J S,Ren P,Li J J,Yin L Q,Xu Y F,Chen Y,Li Z Q,Liu Y P. 2018. Detection of single nucleotide polymorphism of chicken Myostatin gene and its association analysis with growth traits[C]//Chinese Society of Animal Husbandry and Veterinary Society. The 19th Academic Seminar of 2018 Annual Conference Avian Diseases.]
赵义龙,黄金凤,张琪智,买尔外提·波拉提,赵金香,矫继峰. 2017. 肌肉生长抑制素在动物生产中的应用[J]. 四川畜牧兽医,(8):29-31. [Zhao Y L,Huang J F,Zhang Q Z,Mauriti·Bolati,Zhao J X,Jiao J F. 2017. Myostatin application in animal production[J]. Sichuan Animal & Veterinary Medicine,(8):29-31.]
赵振华,黎寿丰,黄华云,李春苗,王钱保,薛龙岗. 2015. MSTN基因突变对优质鸡肌肉生长的影响[J]. 安徽农业大学学报,42(5):733-737. [Zhao Z H,Li S F,Huang H Y,Li C M,Wang Q B,Xue L G. 2015. The myostatin gene(MSTN) and its relationship with muscle fiber traits in chickens[J]. Journal of Anhui Agricultural University,42(5):733-737.]
郑海军,朱荣,葛春蕾,蔡鲜,徐望,陈伟,陆源. 2013. 人白细胞介素-29的生物信息学分析[J]. 中国生物制品学杂志,26(2):209-212. [Zheng H J,Zhu R,Ge C L,Cai X,Xu W,Chen W,Lu Y. 2013. Bioinformatics of human interleukin-29[J]. Chinese Journal of Biologicals,26(2):209-212.]
鄭云. 2007. 鹅Myostatin基因单核苷酸多态性与生产性能相关的研究[D]. 扬州:扬州大学. [Zheng Y. 2007. Study on SNP of the Myostatin gene and its association with production performance in geese[D]. Yangzhou:Yangzhou University.]
朱丽莉,王文涛,傅筑荫,陈彬. 2011. 兴义矮脚鸡白羽系(群)的生产性能观测[J]. 中国家禽,33(8):53-54. [Zhu L L,Wang W T,Fu Z Y,Chen B. 2011. Observation on the production performance of the white feather strain of Xingyi bantam chicken(group)[J]. China Poultry,33(8):53-54.]
祖盘玉,李维,林家栋,李洪林,刘洋,牟腾慧,龙广丽,简华峰,张福平. 2019. 赤水乌骨鸡TYR基因多态性及生物信息学分析[J]. 南方农业学报,50(12):2806-2811. [Zu P Y,Li W,Lin J D,Li H L,Liu Y,Mou T H,Long G L,Jian H F,Zhang F P. 2019. Polymorphism and bioinformatics analysis of TYR gene in Chishui black-bone chicken[J]. Journal of Southern Agriculture,50(12):2806-2811.]
左斌,任冰冰,蒋小松,熊应龙,王康环,蒋利,刘光伟,王海,徐亚欧. 2015. 泸宁鸡和米易鸡MSTN基因多态性及其与生长性状的关联性[J]. 贵州农业科学,43(7):26-30. [Zuo B,Ren B B,Jiang X S,Xiong Y L,Wang K H,Jiang L,Liu G W,Wang H,Xu Y O. 2015. Polymorphism of myostatin(MSTN) gene and correlation between MSTN polymorphism and growth traitss in Luning and Miyi chicken[J]. Guizhou Agricultural Sciences,43(7):26-30.]
Bellinge R H S,Liberles D A,Iaschi S P A,Obrien P A,Tay G K. 2005. Myostatin and its implications on animal breeding:A review[J]. Animal Genetics,36(1):1-6.
Dushyanth K,Bhattacharya T K,Shukla R,Chatterjee R N,Sitaramamma T,Paswan C,Guru Vishnu P. 2016. Gene expression and polymorphism of myostatin gene and its association with growth traits in chicken[J]. Animal Biotechnology,27(4):269-277.
Fontanesi L,Scotti E,Frabetti A,Fornasini D,Picconi A,Russo V. 2011. Identification of polymorphisms in the rabbit (Oryctolagus cuniculus) myostatin(MSTN) gene and association analysis with finishing weight in a commercial rabbit population[J]. Animal Genetics,42(3):339. doi:10.1111/j.1365-2052.2010.02163.x.
Feldman B J,Streeper R S,Farese R V Jr,Yamamoto K R. 2006. Myostatin modulates adipogenesis to generate adipocytes with favorable metabolic effects[J]. Proceedings of the National Academy of Sciences of the United States of America,103(42):15675-15680.
Grade C V C,Salerno M S,Schubert F R,Dietrich S,Alvares L E. 2009. An evolutionarily conserved Myostatin proximal promoter/enhancer confers basal levels of transcription and spatial specificity in vivo[J]. Development Genes and Evolution,219(9-10):497-508.
Grobet L,Martin L J,Poncelet D,Pirottin D,Brouwers B,Riquet J,Schoeberlein A,Dunner S,Ménissier F,Massabanda J,Fries R,Hanset R,Georges M. 1997. A deletion in the bovine myostatin gene causes the double-muscled phenotype in cattle[J]. Nature Genetics,17(1):71-74.
Guo W,Flanagan J,Jasuja J,Kirkland J,Jiang L,Bhasin S. 2008. The effects of myostatin on adipogenic differentiation of human bone marrow-derived mesenchymal stem cells are mediated through cross-communication between Smad3 and Wnt/beta-catenin signaling pathways[J]. The Journal of Biological Chemistry,283(14):9136-9145.
Kim Y S,Bobbili N K,Lee Y K,Jin H J,Dunn M A. 2006. Production of a polyclonal anti-myostatin antibody and the effects of in ovo administration of the antibody on posthatch broiler growth and muscle mass[J]. Poultry Science,86(6):1196-1205.
Lee S J. 2004. Regulation of muscle mass by myostatin[J]. Annual Review of Cell and Developmental Biology,20:61-86. doi:10.1146/annurev.cellbio.20.012103.135836.
McFarland D C,Velleman S G,Pesall J E,Liu C N. 2007. The role of myostatin in chicken(Gallus domesticus) myogenic satellite cell proliferation and differentiation[J]. General and Comparative Endocrinology,151(3):351-357.
McPherron A C,Lawler A M,Lee S J. 1997. Regulation of skeletal muscle mass in mice by a new TGF-beta superfamily member[J]. Nature,387(6628):83-90.
Mitrofanova O V,Dementeva N V,Krutikova A A,Yurchenko O P,Vakhrameev A B,Terletskiy V P. 2017. Association of polymorphic variants in MSTN,PRL,and DRD2 genes with intensity of young animal growth in Pushkin breed chickens[J]. Cytology and Genetics,51(3):179-184.
Xu T S,Gu L H,Zhang X H,Ye B G,Liu X L,Hou S S. 2013. Characterization of myostatin gene(MSTN) of Pekin duck and the association of its polymorphism with breast muscle traits[J]. Genetics and Molecular Research,12(3):3166-3177.
Zhang G X,Zhang T,Wei Y,Ding F X,Zhang L,Wang J Y. 2015. Functional identification of an exon 1 substitution in the myostatin gene and its expression in breast and leg muscle of the Bian chicken[J]. British Poultry Science,56(6):639-644.
(責任编辑 兰宗宝)
收稿日期:2019-12-29
基金项目:贵州省科技计划项目(黔科合支撑〔2016〕2507号)
作者简介:*为通讯作者,张福平(1978-),博士,副教授,主要从事家禽育种研究工作,E-mail:zfu-1010@126.com。龙广丽(1994-),研究方向为畜牧养殖,E-mail:632816729@qq.com

