金催化剂催化乙二醛制乙醛酸反应条件的研究*
王晓莉,包双成
(1 内蒙古化工职业学院实习实训中心,内蒙古 呼和浩特 010022;2 内蒙古师范大学化学与环境科学学院,内蒙古 呼和浩特 010022)
自液相催化空气氧化乙二醛制备乙醛酸的研究报道以来,贵金属催化剂的研究一直成为研究的热点,由于多相催化剂的使用从而避免了大量使用硝酸或生物活性酶,且催化剂易于回收和循环利用,具有生产费用低廉,工艺流程短,操作简单,反应条件温和,环境污染轻等优点,并且所使用的氧源来源广,廉价易得,是工业生产中的首选氧化剂。但该反应目前存在的主要问题是草酸等副产物较多,因此选择适当的主、助催化剂、载体和反应条件等,进一步提高乙二醛的转化率和乙醛酸的选择性,找到催化活性、选择性和稳定性间的平衡点是该法目前的研究重点[1-5]。
本文采用固定化凝胶法制备了系列Au/C催化剂,考察了Au/C催化剂催化乙二醛空气氧化制乙醛酸反应从反应时间,反应温度,反应溶液pH值,反应中催化剂用量等方面进行不同的条件反应,最终确定了最佳的反应条件。
1 实 验
1.1 原料与试剂
氯金酸(AR),上海试剂一厂;硼氢化纳(AR),天津市盛淼精细化工有限公司;聚乙烯醇(AR),天津市北联精细化学品开发有限公司;活性炭(AR),天津市盛淼精细化工有限公司;乙二醛(AR),国药集团化学试剂有限公司;氢氧化钠(AR),北京化学试剂公司。
1.2 Au/C催化剂的制备
Au/C催化剂的制备按文献[6]的方法合成。
1.3 乙二醛空气氧化制乙醛酸
在500 mL装有电动搅拌器、回流冷凝管的四口烧瓶中,加入2.5 mL质量分数40%的乙二醛与200 mL蒸馏水,加入催化剂,常压下以一定流量通入氧气,缓慢加热至指定温度于水浴中恒温反应,用0.05 mol/L NaOH溶液调节反应液的pH值,反应结束后,冷却,过滤分离催化剂,对有机产物进行检测。
2 结果与讨论
2.1 反应时间对乙二醛空气氧化制乙醛酸的性能影响
首先,选取了理论负载量为1%的金催化剂,实验中固定反应温度为40 ℃、催化剂用量为0.2 g、氧气流量为0.4 L/min、采用滴加方式填加0.05 mol/L NaOH来保持溶液的pH为7.7左右的反应条件下,考察了反应时间对乙二醛空气氧化制乙醛酸的性能影响,结果如图1所示。由图1可知,随反应时间增加转化率和乙醛酸的选择性不断增加,当反应8 h时,催化剂活性较好,乙二醛的转化率为14.7%,乙醛酸的选择性和产率分别为48.4%和7.1%。随反应时间的进一步延长,乙二醛转化率继续增加,而乙醛酸的选择性开始降低,这可能为反应产物乙醛酸被进一步氧化生成草酸的原故,因此确定最佳反应时间为8 h。


图1 反应时间对Au/C催化性能的影响
2.2 反应温度对乙二醛空气氧化制乙醛酸的性能影响
实验中固定催化剂用量为0.2 g、氧气流量为0.4 L/min、采用滴加方式填加0.05 mol/L NaOH溶液保持反应体系的pH为7.7左右、反应时间为8 h,考察了反应温度对乙二醛空气氧化制乙醛酸的性能影响,结果如图2所示,由图2可知,在较低温度时,乙二醛的转化率和乙醛酸的产率都较低,随着反应温度的升高,两者均有所升高,这可能因为温度升高,反应速率加快所致。当反应温度为50 ℃时具有较好的催化氧化效果,乙二醛转化率为17.2%,乙醛酸的选择性和产率分别为49%和8.4%,但进一步提高反应温度,乙醛酸的选择性开始下降。这是由于乙二醛氧化反应属于放热反应,升高温度不太利于反应进行,从节约能源出发我们选择50 ℃为反应温度。反应方程式如下:


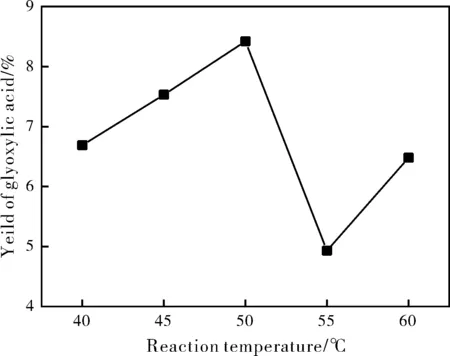
图2 反应温度对Au/C催化性能的影响
2.3 反应溶液pH值对乙二醛空气氧化制乙醛酸的性能影响
实验中固定反应温度为50 ℃、催化剂用量为0.2 g、反应时间为8 h、氧流量0.4 L/min 情况下,通过改变溶液的pH值考察了其对乙二醛空气氧化制乙醛酸的性能影响。在反应过程中分别调节反应体系的pH值为6.7、7.7、8.7和对pH不进行调节时的反应活性结果如表1所示。由表1发现,pH 值对催化剂性能影响较大,当pH=7.7,Au/C催化剂显示出很好的催化活性;如不调节pH值,Au/C催化剂的催化活性很低,反应产物中检测不到乙醛酸。实验过程中还发现,如果在实验过程中不调节pH值,反应液的pH在逐渐降低,可能是乙二醛反应生成了草酸。而当pH值过高时,NaOH可与乙二醛发生坎尼扎罗反应生成乙醇酸,影响乙醛酸的产率,所以pH=7.7为最佳值。
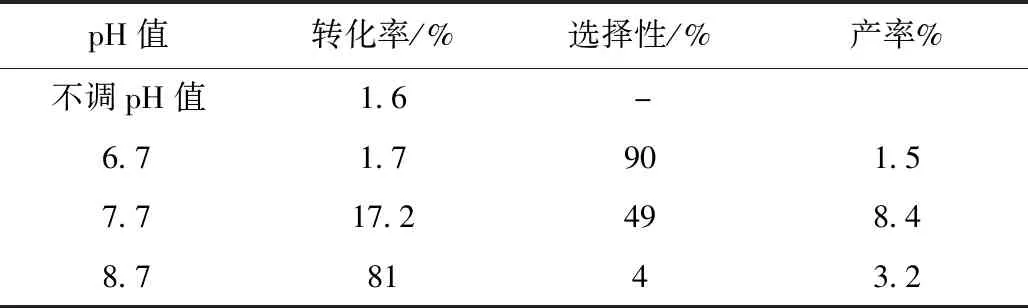
表1 溶液的pH值对Au/C催化性能的影响
2.4 催化剂用量对乙二醛空气氧化制乙醛酸的性能影响
在四口烧瓶中加入0.1 mol/L的乙二醛溶液200 mL,固定反应温度为50 ℃、反应时间为8 h、氧流量0.4 L/min 情况下,考察了催化剂用量对乙二醛空气氧化制乙醛酸的性能影响,结果如图3所示。乙二醛转化率随着催化剂用量的增加而增加,表明催化剂用量对催化效果有一定影响,催化剂用量较少时,催化反应不完全,当催化剂用量在0.2 g时催化性能较高,继续增加催化剂用量,乙醛酸收率增加不明显。考虑反应成本,该反应体系选择催化剂用量为0.2 g。


图3 催化剂用量对催化性能的影响
2.5 XPS表征
为了研究催化剂活性组分与催化活性之间的关系,我们选择对Au/C催化剂进行XPS测试。图4为催化剂的XPS全谱图,图4中出现了O1s、C1s和Au4f的峰。为了得到催化剂活性组分的价态情况,我们对新鲜催化剂和反应后回收催化剂Au4f和O1s能谱进行了拟合处理,如图5所示。新鲜催化剂的Au4f 能谱拟合后Au4f7/2谱峰分裂结合能分别为83.9 eV和84.8 eV;反应后回收催化剂的Au4f7/2谱峰分裂出结合能分别为83.8 eV和84.3 eV。根据文献报道[7-9],Au0和Auδ+(0<δ<3,或Au1+)的Au 4f7/2峰与Au 4f5/2谱峰分别出现在84.0 eV、87.7 eV和84.8 eV、88.4 eV的位置。两个催化剂的前者与Au0标准的Au4f7/2结合能84.0 eV相一致。并且样品的Au4f7/2和Au4f5/2差值(ΔEb=3.7 eV)与零价金完全相同。因此可以判断,Au/C催化剂上的金是以零价金形式存在[10]。

图4 Au/C催化剂的XPS全谱图
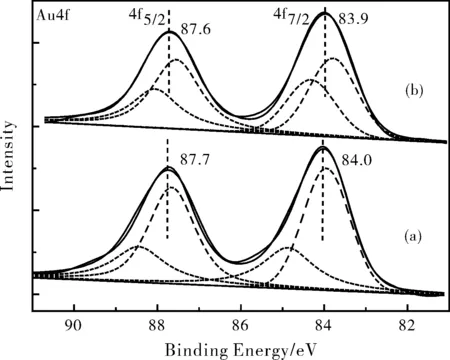

图5 Au/C催化剂的Au4f和O1s XPS能谱图
电子结合能标识元素表[11]中O1s 的结合能为531 eV,而新鲜的催化剂和反应后催化剂的O1s谱峰分别为532.9 eV和533.1 eV。表明其中氧源为表面吸附的氧物种,即污染氧。这一结果与Armelao的相一致[12]。表2列出了催化剂表面O和Au的百分含量。从列表可看出反应后金催化剂表面Au含量有所降低。

表2 XPS测试中Au/C催化剂表面元素含量
3 结 论
通过对乙二醛空气氧化反应条件的考察,发现催化剂用量为0.2 g,反应温度为50 ℃,反应时间为8 h,反应溶液pH值为7.7的条件下,Au/C催化剂催化活性最佳,乙二醛转化28%,乙醛酸选择性达到35.5%。从XPS结果可看出Au/C催化剂上的金是以零价金形式存在的。

