马鲛鱼抗氧化肽的纳流液相色谱法分离与筛选
薛雅茹, 郭 睿, 张 博*
(1. 黎明职业大学材料与化学工程学院, 福建 泉州 362000; 2. 厦门大学化学化工学院, 福建 厦门 361005)
马鲛鱼(Scomberomorusniphonius),又名鲅鱼、鱼,主要分布在黄海、渤海以及福建沿海等地[1]。该鱼在加工过程中往往会废弃大量内脏、鱼头等加工副产物,重量约占原料鱼的40%~55%[2]。而马鲛鱼内脏中含有丰富的蛋白质,是制备肽类及相关生物分子产品的良好来源。大量研究表明,抗氧化肽能清除人体内的多余自由基,但国内外利用马鲛鱼内脏制备活性肽的研究尚未见报道。
Ambigaipalan等[3]发现海洋生物源抗氧化肽与传统的化学合成抗氧化剂相比更有益于人体健康。目前,由于可控酶解法制备海洋生物源抗氧化肽具有酶的专一性高、水解过程温和、不引入有毒有害试剂等优点,因此得到了广泛的应用[4]。但由于每种蛋白酶的专一性不同,不同酶的酶切位点各异,如胰蛋白酶只选择性水解精氨酸或赖氨酸羧基形成的肽键。因此,酶解所获得的活性肽结构及功能活性各不相同。而工业上制备抗氧化肽时,蛋白酶的选择盲目性较大,为了降低成本,往往使用价格低廉的酶(如木瓜蛋白酶),导致制备的肽活性普遍较差。为了提高马鲛鱼加工的附加值,拓宽马鲛鱼资源的精深加工范围,得到高活性的海洋生物源抗氧化肽,亟须开发一种针对马鲛鱼内脏抗氧化肽的制备及分离纯化方法。
由Box等提出的响应面分析法(response surface methodology, RSM)是通过一定量的试验数据构建多元二次回归方程,用以拟合工艺参数与响应值的函数关系,进而得到最优工艺参数的优化设计方法[5,6]。响应面分析法与目前常用的正交试验设计法相比,具有试验次数少、精度高、周期短的优点,目前已得到广泛应用[7]。本研究采用响应面分析法优化了马鲛鱼内脏抗氧化肽的制备工艺。
纳流液相色谱是近年兴起的高效生化分离分析技术,其通常在100 μm内径的石英毛细管柱中,以nL/min的流速水平进行样品分离,具有样品需求量低、溶剂消耗少、选择性高、灵敏度高、分离快速等特点[8-12]。对于多肽/蛋白质等样品的液相色谱分离,最常见的是以表面键合C18为代表的反相色谱固定相和以强阳离子交换(strong cation exchange, SCX)为代表的离子交换色谱固定相[13]。C18固定相通过疏水作用力依据样品中各组分极性强弱进行分离,疏水性越强的组分在反相固定相中的保留越强[14]。SCX则是通过离子相互作用对样品进行分离,样品各组分的离子价位越高、离子半径越小,则SCX对其保留越强[15,16]。
本研究在海洋鱼类抗氧化肽经典制备工艺的基础上[17,18],针对马鲛鱼体系,从5种食品加工常用水解酶中筛选出最佳水解酶,进而基于响应面分析法优化得到马鲛鱼内脏抗氧化肽的最佳制备方法。为筛选出适合于马鲛鱼内脏抗氧化肽分离分析的色谱固定相,基于纳流高效液相色谱平台进行分离纯化,分别考察了反相C18柱和SCX柱对马鲛鱼内脏氧化肽酶解液分离后各组分的抗氧化能力,筛选出具有高抗氧化活性的组分。
1 实验部分
1.1 仪器、试剂与材料
LC-20AD液相色谱仪,日本岛津有限公司;Economic ECD2000紫外检测器,捷克ECOM公司;绞肉机,北京利仁科技责任有限公司;HHS型电热恒温水浴锅,上海博讯实业有限公司医疗设备厂;AL104-IC型电子分析天平,梅特勒-托利多仪器(上海)有限公司;TG16-WS型台式高速离心机,湖南湘仪实验仪器制造有限公司;HYP-308型消化炉,上海纤检仪器有限公司;KDN-103F型自动凯氏定氮仪,上海纤检仪器有限公司;400Y型中草药粉碎机,永康市铂欧五金制品有限公司;FE20型精密pH计,梅特勒-托利多仪器(上海)有限公司;UV-2012PC型紫外分光光度计,尤尼克-上海仪器有限公司;CJJ78-1型磁力搅拌器,常州市金坛晨阳电子仪器厂。
马鲛鱼内脏,由惠安瑞芳食品有限公司提供;牛胰蛋白酶(250 USP u/mg),上海源叶生物科技有限公司;风味蛋白酶(1.5×104u/g),上海吉至生化科技有限公司;酸性蛋白酶(8.0×105u/g)、中性蛋白酶(2.0×105u/g)、碱性蛋白酶(2.0×105u/g),江苏锐阳生物科技有限公司;二苯代苦味肼基自由基(DPPH·),美国Sigma公司;异丙醇、氢氧化钠、盐酸、硫酸、硫酸铜、硫酸钾、硼酸、95%乙醇、甲醛、水杨酸等,均为分析纯试剂;乙腈为色谱纯。
1.2 样品预处理及条件优化
马鲛鱼内脏→解冻→清洗(除去鱼卵、鱼胆)→搅成糜状→异丙醇浸提5 h后脱脂(重复3次)→55 ℃烘干→粉碎→过筛→马鲛鱼内脏粉末→加入蒸馏水100 mL→热变性处理15 min→调pH→加酶→酶解→水浴95 ℃灭酶10 min→离心10 min→取上清液→马鲛鱼内脏抗氧化肽溶液(antioxidative peptide fromScomberomorusniphoniusviscera, APS)。
1.2.1酶的筛选
分别将风味蛋白酶、胰蛋白酶、酸性蛋白酶、中性蛋白酶、碱性蛋白酶5种蛋白酶置于50 g/L马鲛鱼内脏溶液中发生酶解反应,水解条件见表1。以DPPH·清除率、·OH清除率和水解度(DH)为指标,筛选最佳水解酶。
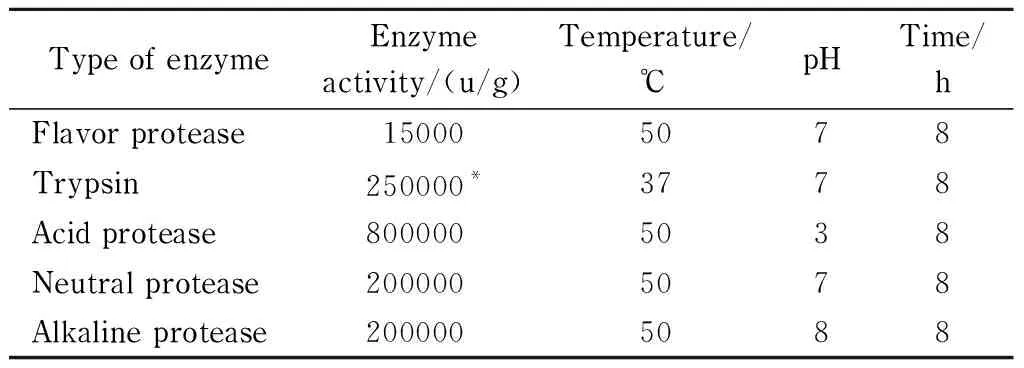
表 1 蛋白酶的水解条件
1.2.2响应面试验设计
在预实验单因素试验的基础上,以DPPH·清除率为响应值Y,以A(加酶量)、B(酶解温度)、C(酶解时间)为自变量,考察胰蛋白酶水解条件。采用Box-Behnken中心组合试验设计,设计三因素三水平响应面试验。试验共17个试验点,其中12个为析因点,自变量取值在A、B、C所构成的三维顶点,5个为零点,为区域中心点,以估计误差。因素水平编码值见表2。试验以随机次序进行,重复3次,取平均值。

表 2 响应面分析试验的因素和水平
1.3.1脱脂后马鲛鱼内脏基本成分的测定
水分的测定采用常压直接干燥法,参考GB 5009.3-2010[19];蛋白质的测定采用微量凯氏定氮法,参考GB 5009.5-2016[20];脂肪的测定采用索氏抽提法,参考GB 5009.6-2016[21];灰分的测定采用高温灼烧法,参考GB 5009.4-2016[22]。
1.3.2水解度的测定[23]
采用甲醛滴定法测定氨基酸态氮的含量[24]。准确取出10.0 mL APS,加水定容于50 mL容量瓶中,摇匀,备用。吸取20.0 mL的备用样品稀释液于250 mL烧杯中,加入60 mL蒸馏水,放入转子,转动磁力搅拌器。将待测溶液搅拌稳定后把精密pH计带有的复合电极小心插入烧杯里的溶液中,再用0.05 mol/L NaOH标准溶液滴定至pH为8.2,用移液管量取10.0 mL甲醛溶液加入待测液中,用转子搅拌均匀。最后滴定至pH为9.2,用0.05 mol/L NaOH标准溶液进行滴定,并记下NaOH标准溶液所消耗的体积。取250 mL烧杯,装入80 mL蒸馏水,进行空白试验且试验条件与上述一样,同时记下所消耗的NaOH标准溶液的体积。根据式(1)计算游离氨基酸态氮的含量:
(1)
式中:x为氨基酸态氮的含量,g/100 mL;c为氢氧化钠标准溶液的浓度,mol/L;V1为液体中加入10 mL甲醛后,滴定至pH为9.2时所消耗的氢氧化钠标准溶液体积,mL;V0为空白试验加入甲醛后滴定至pH为9.2时氢氧化钠标准溶液所消耗的体积,mL;V为测定时吸取样品稀释液的体积,mL; 10为测定用样品溶液体积,mL; 0.0140为氮的毫摩尔质量,g/mmol。
由式(2)计算样品的水解度(DH):
(2)
式中:DH为样品的水解度;x1为APS中游离氨基态氮的含量;x0为酶解前样液中氨基态氮的含量;x为未酶解原料的蛋白液中游离氨基态氮的含量。
1.3.3抗氧化活性指标的测定
DPPH·清除率的测定参考Liu等[25]的方法并加以改进。将2 mL的APS加入到2 mL的2.0×10-4mol/L的DPPH·溶液中,均匀混合,在黑暗处静置30 min后,用紫外分光光度计测定混合溶液在517 nm条件下的吸光度值(A2)。以2 mL无水乙醇与2 mL DPPH·溶液的吸光度为空白管(A0),以2 mL APS+2 mL无水乙醇的吸光值为对照管(A1)。清除率用式(3)计算:
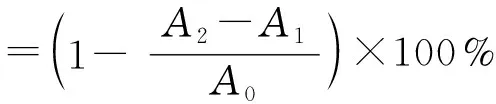
(3)
式中:A0为2 mL无水乙醇+2 mL DPPH·溶液的吸光值;A1为2 mL APS+2 mL无水乙醇的吸光值;A2为2 mL APS+2 mL DPPH·溶液的吸光值。
·OH清除率的测定参考Zhang等[26]的方法并加以改进。在试管中依次加入2 mL 5 mmol/L FeSO4、3 mL 6 mmol/L水杨酸、4 mL APS,摇匀后加入0.1% H2O22 mL,加蒸馏水定容至10 mL,摇匀,静置30 min。计算样品对·OH的清除能力(SA),如式(4):
(4)
式中:Ei为加APS体系的吸光度;Ej为不加水杨酸体系的吸光度;E0为不加APS体系的吸光度。
1.4 仪器条件
色谱分析柱:C18柱(15 cm×100 μm, 5 μm, 30 nm),SCX柱(15 cm×100 μm, 5 μm, 100 nm);样品阀进样量:4 nL;检测波长:214 nm;流速:0.6 mL/min;流动相:60%乙腈;洗脱方法:1∶1 000分流比,60%乙腈等度洗脱。
样品溶液经0.45 μm滤膜过滤后进样;结束后将同一个吸收峰收集的样液混合浓缩,冻干,分析各峰组分的DPPH·清除力。
2 结果与讨论
2.1 脱脂后马鲛鱼内脏基本成分分析
动物内脏中往往含有较高的脂肪成分及其衍生物,由于脂肪对酶解会造成一定的影响,因此,在酶解前需要进行脱脂处理[17]。对脱脂马鲛鱼内脏粉末进行基本成分的测定,结果显示,马鲛鱼内脏经搅碎、异丙醇反复浸提脱脂后蛋白含量为79.45%,说明可作为良好的肽类制备来源。
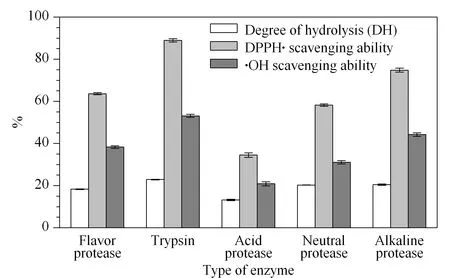
图 1 不同蛋白酶对酶解液水解度、DPPH·清除率和·OH清除率的影响(n=3)Fig. 1 Effect of various proteases on degree of hydrolysis,DPPH· and ·OH scavenging ability (n=3)
2.2 酶的筛选结果
由图1可知,5种蛋白酶水解度的大小依次为胰蛋白酶>碱性蛋白酶>中性蛋白酶>风味蛋白酶>酸性蛋白酶,胰蛋白酶酶解液清除DPPH·和·OH能力最强,清除率分别为88.93%±0.82%和53.09%±0.73%,这与各种蛋白酶的水解能力大小排序基本一致。这可能是因为不同蛋白酶的酶解物中含有不同氨基酸序列的肽,而酶解物的自由基清除能力又和组成肽的氨基酸序列和长度密切相关。由此可推断,胰蛋白酶水解物中可能含有更多的能减少自由基堆积和氧化反应产生的活性肽[8]。
2.3 响应面试验结果分析
2.3.1响应面试验结果与方差分析

表 3 Box-Behnken试验设计及结果
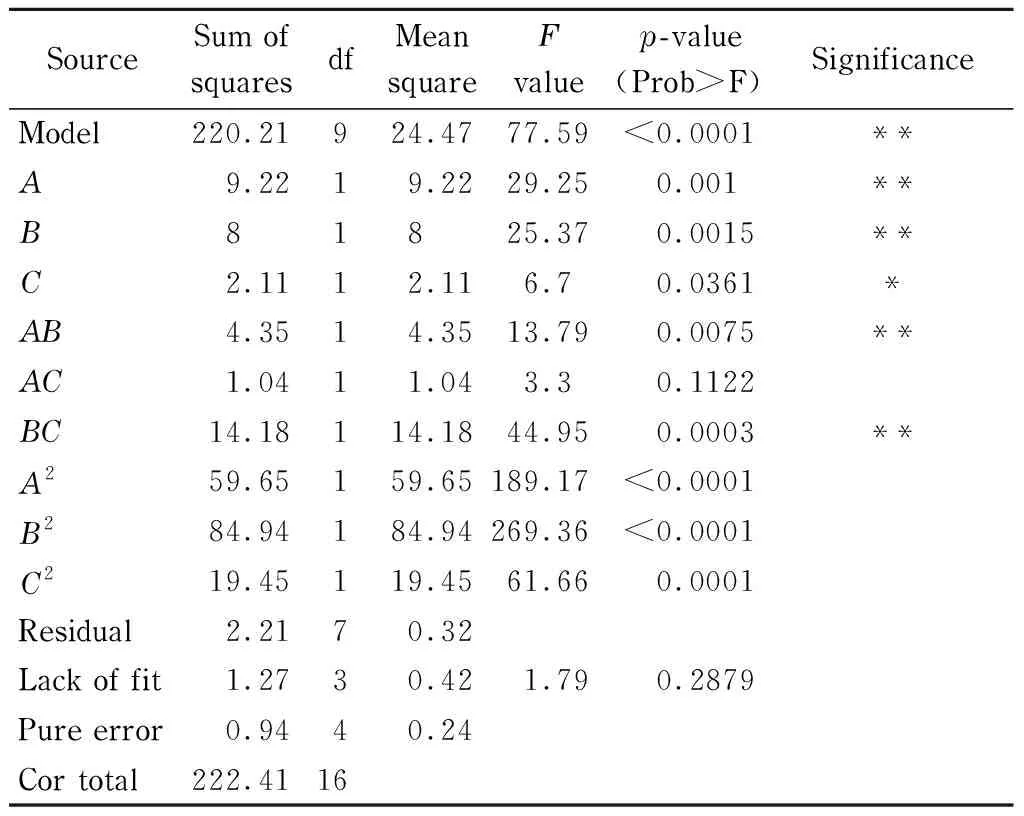
综上分析可得,该模型可以用来分析、预测胰蛋白酶酶解马鲛鱼内脏制备抗氧化肽的工艺条件。
经回归拟合后,试验因子对响应值的影响可用回归方程表示为:
Y=94.25-1.07A+1.00B+0.51C-1.04AB-
0.51AC-1.88BC-3.76A2-4.49B2-2.15C2
从表4可以看出,方程一次项中,A、B、C均达到显著水平(p<0.05),其中,A、B对DPPH·清除率影响较大,达到极显著水平(p<0.01)。在二次项中,A2、B2、C2(p<0.01)为极显著项,三者系数均为负值,说明方程具有极大值点可进行优化分析[17]。交互项中,AB、BC达到极显著水平(p<0.01),AC影响不显著,可以看出各因素对响应值的影响不是简单的线性关系[28]。
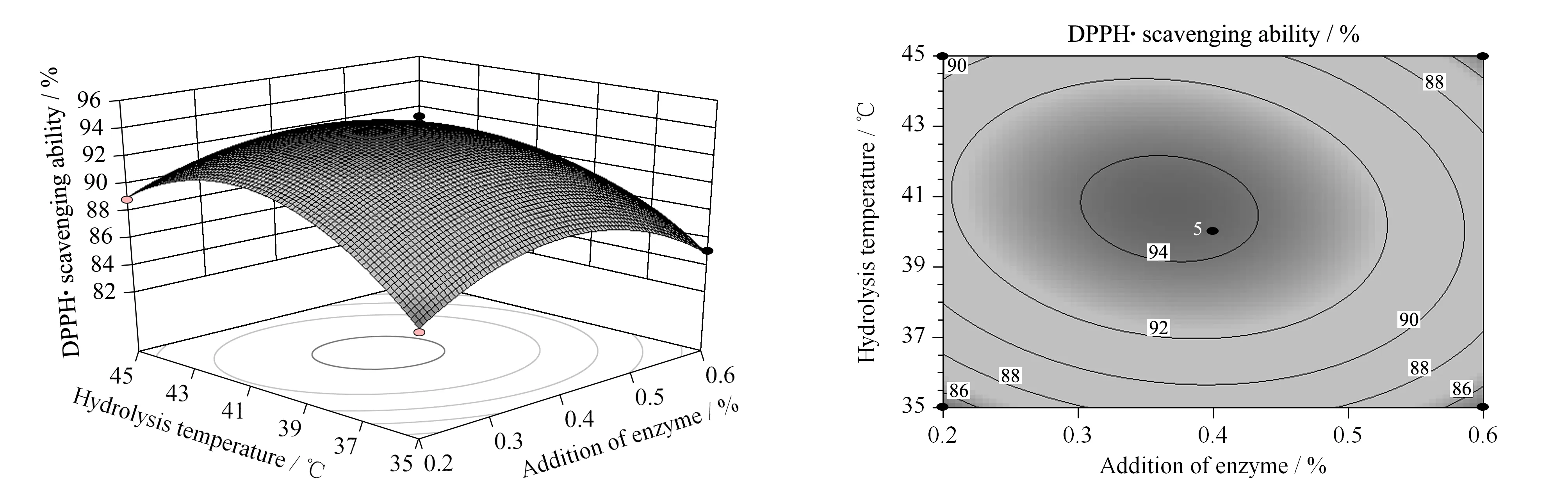
图 2 加酶量和酶解温度对DPPH·清除率交互影响的响应面和等高线Fig. 2 Surface and contour plots of influence for the addition of enzyme and hydrolysis temperature against DPPH· scavenging ability

图 3 加酶量和酶解时间对DPPH·清除率交互影响的响应面和等高线Fig. 3 Surface and contour plots of influence for the addition of enzyme and hydrolysis time against DPPH· scavenging ability
2.3.2单因素的交互作用分析
由图2~4可知,在不同酶解条件下,APS的DPPH·清除率与单因素结果具有较好的一致性。各因素之间有交互作用。其中加酶量和酶解温度(p=0.007 5)、酶解时间和酶解温度(p=0.000 3)之间的交互作用达到极显著水平。
图2显示了当酶解时间位于中心点即2.5 h时,酶解温度和加酶量对DPPH·清除率的交互影响效应。由图2可以看出,在同一酶解温度下,DPPH·清除率随着加酶量的增加呈先上升后下降的趋势;在同一加酶量下,DPPH·清除率随着酶解温度的增加而先增加后减少。
图3显示了当酶解温度位于中心点即40 ℃时,酶解时间和加酶量对DPPH·清除率的交互影响效应。由图3可以看出,在同一酶解时间下,DPPH·清除率随着加酶量的增加而先增大后减小;在同一加酶量下,DPPH·清除率随着酶解时间的增加而先缓慢增加后缓慢减少。二者交互作用相对较弱(p>0.05),这可能是由于即使提高了加酶量也仍需要一定的酶解时间使酶与底物得以适当反应,使水解程度达到最佳状态,充分反应而又不过度降解,从而生成DPPH·清除率较高的抗氧化肽。
图4显示了当加酶量位于中心点即0.4%时,酶解时间和酶解温度对DPPH·清除率的交互影响效应。由图4可以看出,在同一酶解温度下,DPPH·清除率随着酶解时间的增加而先增加后趋于平稳;在同一酶解时间下,DPPH·清除率随着酶解温度的升高而先升高后降低。说明在一定的酶解温度范围内,要达到较高的DPPH·清除率,适当地升高酶解温度可以缩短酶解所需的时间。
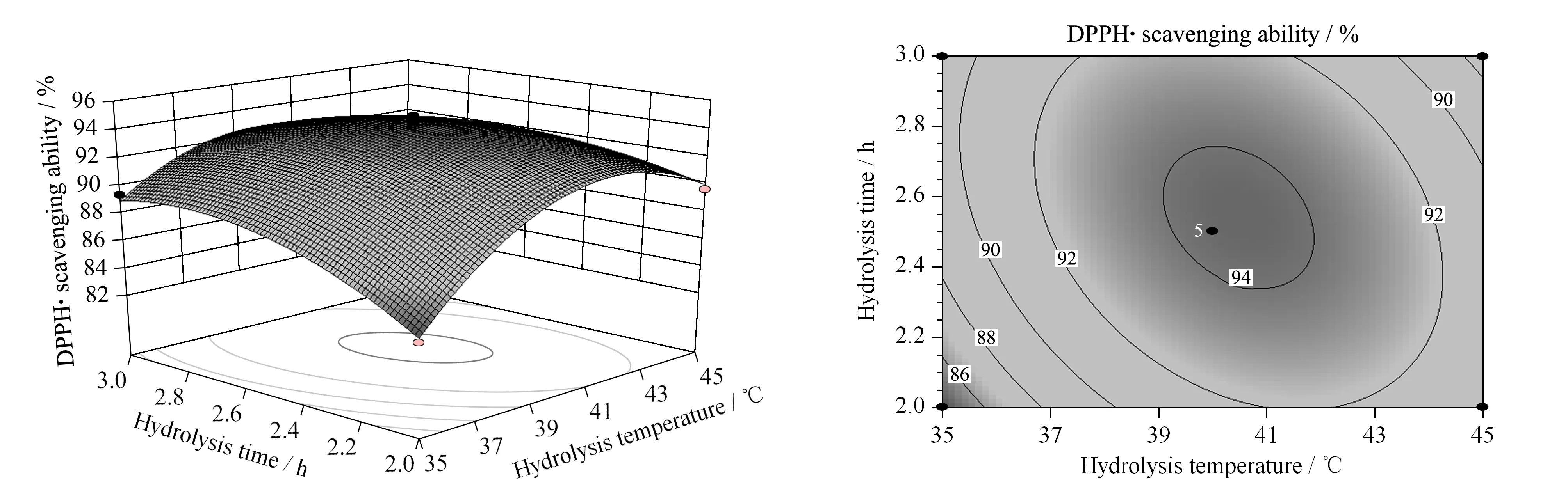
图 4 酶解温度和酶解时间对DPPH·清除率交互影响的响应面和等高线Fig. 4 Surface and contour plots of influence for hydrolysis temperature and hydrolysis time against DPPH· scavenging ability
根据Design Expert v8.0.6对模型进行优化,得出结果:加酶量0.368%、酶解温度40.55 ℃、酶解时间2.545 h。在此条件下,模型预测APS对DPPH·的清除率达到94.415%。考虑到实际试验时操作的可行性,调整工艺条件为:加酶量0.37%,酶解温度41 ℃,酶解时间2.5 h。重复3次试验,得到DPPH·清除率为93.78%±0.35%,与预测值相比,相对误差为0.67%,说明拟合模型优化出的条件较为准确。在此条件下,APS的水解度为23.66%, ·OH清除率为62.59%。
在前人报道的工作中,李娜等[29]以鳕鱼鱼鳔为原料,采用复合蛋白酶酶解制备抗氧化肽,制备所得的抗氧化肽DPPH·清除率为61.1%。李致瑜等[17,18]以大黄鱼内脏为原料,选用碱性蛋白酶酶解制备抗氧化肽,所得抗氧化肽的DPPH·清除率为85.97%。本工作中,以马鲛鱼内脏作为抗氧化肽源,胰蛋白酶表现出最优的酶解效率,且DPPH·清除率达到93.78%的优良水平,表明胰蛋白酶是马鲛鱼内脏来源抗氧化肽制备的最优水解酶。
2.4 纳流液相色谱分离纯化APS结果分析
为检测出APS溶液各组分的抗氧化能力,本研究选用具有样品需求量低、高灵敏度、高选择性等特点的纳流液相色谱法进行分离。为了筛选出更适合APS分离纯化的固定相,将经0.45 μm滤膜过滤后的APS溶液分别用C18纳流色谱柱和SCX纳流色谱柱进行色谱分离,收集分离后的不同组分分别进行DPPH·清除力表征,以筛选出抗氧化能力最高的组分。
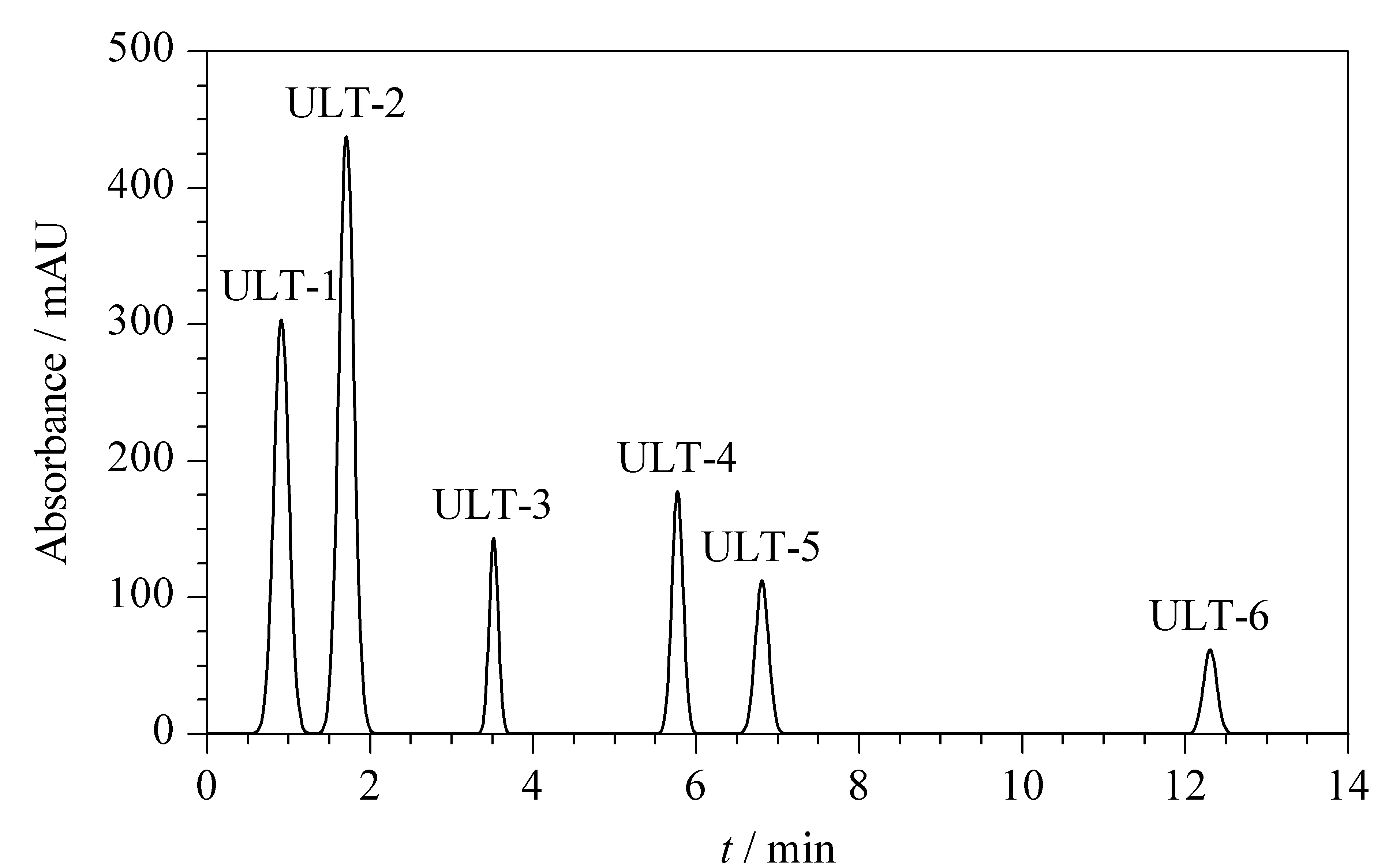
图 5 C18柱分离APS的高效纳流液相色谱图Fig. 5 nano-HPLC chromatogram of APS using C18 column Mobile phase: 60% ACN; flow rate: 0.6 mL/min; split ratio: 1∶1000; chromatographic column: C18, 15 cm×100 μm, 5 μm, 30 nm.
图5、图6分别为以C18柱和SCX柱分离APS的色谱图。根据色谱图可知C18柱分离APS得到6个组分,SCX柱分离APS得到9个组分。其中,SCX-1至SCX-5、SCX-6和SCX-7、SCX-8和SCX-9这3组的洗脱时间更为接近,表明这3组的电荷基团强度接近,且保留时间越长的组分含有的阴离子越多,碱性也就越强。游丽君等[30]的工作表明,疏水性适中、碱性强的抗氧化肽具有更优的抗氧化活性。为进一步探究分离纯化后各组分的抗氧化能力,对分离得到的各组分进行收集,并进行抗氧化活性能力检测,检测结果见图7和图8。
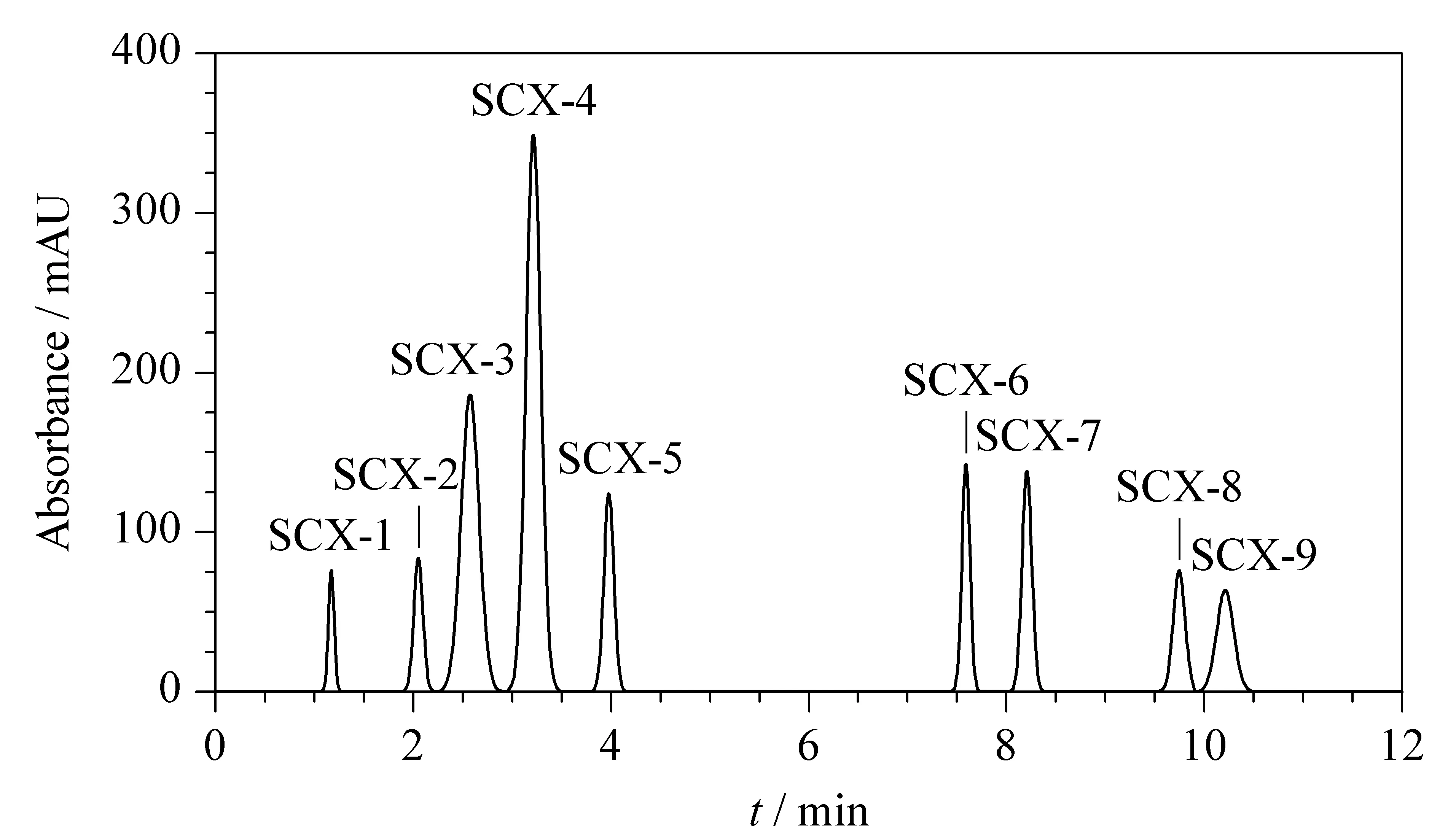
图 6 SCX固定相分离APS的高效纳流液相色谱图Fig. 6 Nano-HPLC chromatogram of APS using SCX stationary phase Mobile phase: 60% ACN; flow rate: 0.6 mL/min; split ratio: 1∶1000; chromatographic column: SCX, 15 cm×100 μm, 5 μm, 100 nm.
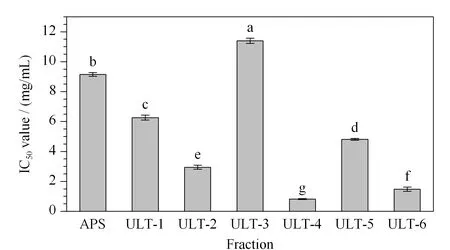
图 7 C18固定相分离后各组分的DPPH·清除力Fig. 7 DPPH· scavenging activity of fractions obtained on C18 column The letters indicate significant difference at 0.05 level (data=mean±standard, n=3).
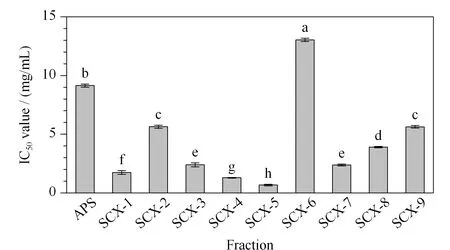
图 8 SCX柱分离后各组分的DPPH·清除力Fig. 8 DPPH· scavenging activity of fractions obtained on SCX column The letters indicate significant difference at 0.05 level (data=mean±standard, n=3).
由图7可知,ULT-4组分的DPPH·清除力最高,半抑制浓度(IC50)为0.816±0.017 mg/mL,表现出最强的抗氧化活性(p<0.05),效果为未纯化的APS的11.2倍。由图8可知,SCX-5组分的DPPH·清除力最高,IC50值为0.672±0.051 mg/mL,表现出最强的抗氧化活性(p<0.05),效果为APS的13.6倍。两者相比,SCX-5的抗氧化活性强于ULT-4,且SCX组各组分的抗氧化能力总体强于C18组,因此说明SCX固定相更适合APS的分离纯化。
3 结论
本文以脱脂马鲛鱼内脏蛋白为原料进行酶的筛选。以DPPH·清除率为响应值,采用响应面法优化了马鲛鱼内脏来源抗氧化肽的制备方法,得到最佳酶解条件:加酶量0.37%,酶解温度41 ℃,酶解时间2.5 h,底物质量浓度50 g/L,酶解pH 7.0。此条件下,马鲛鱼内脏抗氧化肽的水解度为23.66%, DPPH·清除率为93.78%,·OH清除率为62.59%。DPPH·清除率与理论预测值的相对误差在±1%以内,拟合模型较为准确。
利用高效纳流液相色谱平台对马鲛鱼内脏抗氧化肽进行分离与活性筛选。SCX固定相无论是从分离的组分数量,各组分的抗氧化能力,以及抗氧化能力最强组分等方面都明显优于C18固定相。所筛选出活性组分的抗氧化活性最强,其DPPH·清除力的IC50值可达到0.672±0.051 mg/mL,为未纯化时的13.6倍。结果表明,SCX固定相更加适用于马鲛鱼内脏抗氧化肽的分离纯化,对马鲛鱼内脏来源抗氧化肽的活性筛选与深加工研究具有实际指导意义。

