2020年1~4月全国新型冠状病毒检测试剂获准数据分析
张华吉 李秀记 郭媛媛 孙晓灿 张晓宇
(1.《中国药学杂志》社有限公司,北京 100022;2.中国食品药品检定研究院仪器设备处,北京 102629;3.国家药品监督管理局信息中心应用系统二处,北京 100044;4.北京华灿康国际医药研究有限公司,北京 100027)
21 世纪以来,人类冠状病毒发生3 次大暴发,分别是2003 年严重急性呼吸综合征(severe acute respiratory syndrome,SARS)、2012 年中东呼吸综合征(middle east respiratory syndrome,MERS) 和2019年12 月新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)[1]。2020年1月29日,全国31个省(区、市)均启动突发公共卫生事件一级响应,经过94 天的全民艰苦奋战,新冠病毒肺炎疫情得到有效控制,到2020 年5 月2 日,全国31 个省(区、市)均解除突发公共卫生事件一级响应[2],新冠病毒肺炎疫情防控阶段性成效进一步巩固,复工复产有序推进,经济社会生活得到有效恢复。应对新冠肺炎疫情是一场持久战,快速准确地诊断是控制疫情暴发的关键因素。目前,新冠病毒核酸和抗体检测在国内已经普遍开展,并成为常态化防控的主要手段之一。为了解国内新型冠状病毒检测试剂上市情况,经查阅国家药品监督管理局网站国产新型冠状病毒检测试剂注册信息[3],分析产品上市数据,为科研、生产经营决策提供参考。
1 新型冠状病毒检测试剂获批上市情况
截至2020 年4 月30 日,国家药品监督管理局共全国批准26 家企业30 个品规的新型冠状病毒检测试剂上市,并纳入第三类医疗器械进行监管。批准上市的新型冠状病毒检测试剂用于新型冠状病毒(2019-nCoV)感染的肺炎的辅助诊断及应急储备,注册证有效期均为1 年,产品有效期均为暂定6 个月。
1.1 新型冠状病毒检测试剂上市日期分布
面对严峻的疫情,国家卫健委将新型冠状病毒感染的肺炎纳入《中华人民共和国传染病防治法》规定的乙类传染病,并采取甲类传染病的预防、控制措施[4];国家药品监督管理局启动应急审评审批机制,开辟快速审批通道[5];国家药品监督管理局器械审评中心制定了《2019 新型冠状病毒核酸检测试剂注册技术审评要点》《2019 新型冠状病毒抗原抗体检测试剂注册技术审评要点(试行)》,指导企业进行注册申报工作[6,7];科技部布署应急项目,加快推进新冠病毒现场快速检测产品的研发和应用[8];企业面对检测试剂巨大的市场需求,研发工作如火如荼。1 月26 日,3 家企业4 个品规的新型冠状病毒检测试剂首次在国内获批上市,大大缓解了检测试剂的市场供需矛盾。随后,其他23 家企业26 个品规陆续获批上市,图1 列示了30 个新型冠状病毒检测试剂批准时间及产品数量。
截至2020 年4 月30 日,共有26 家企业的30个品规上市,1~4 月上市产品数量分为7、5、13、4个,见图2。产品获批上市数量在3月出现峰值,4 月有所回落,月均上市7 个产品。
1.2 新型冠状病毒检测试剂上市地区分布
30 个新型冠状病毒检测试剂注册证书分布在全国12 个省(市),上海获批6 个位居首位,湖北获批5 个位居其次,广东获批4 个排在第三,北京、福建、江苏、四川、天津、重庆各获批2 个,河北、湖南、浙江各获批1 个。
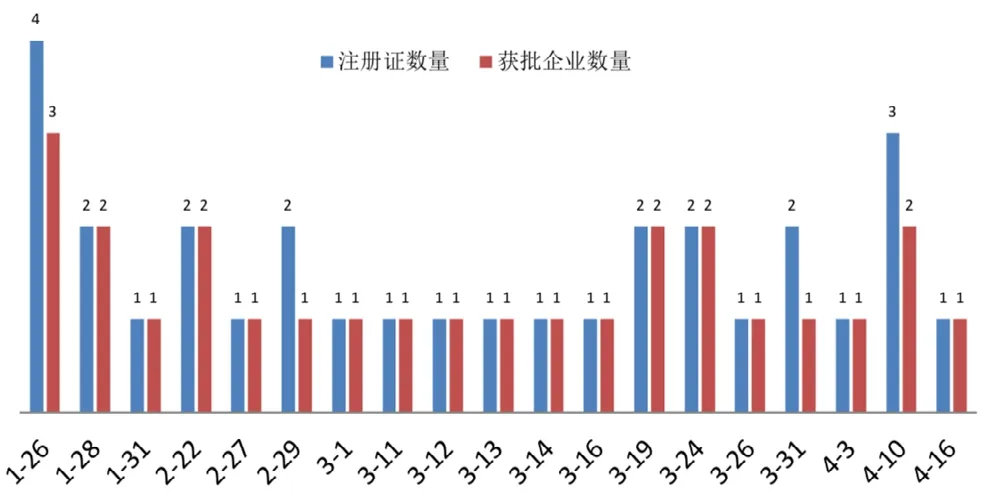
图1 2020 年1~4 月新型冠状检测试剂获批时间及数量
获批新型冠状病毒检测试剂生产企业主要集中在东部省份。东部省份北京、天津、上海、河北、江苏、浙江、福建、广东8 省(市)共获得20 个注册证,占总数的66.67%;中部省份湖北、湖南2省共获得6 个注册证,占总数的20.00%;西部省份重庆、四川2 省(市),共获得4 个注册证,占总数的13.33%。
1.3 新型冠状病毒检测试剂采用的方法
新型冠状病毒检测试剂主要有两类,一类是核酸检测试剂,一类是抗体检测试剂。目前COVID-19 确诊主要依靠病毒核酸检测,核酸检测存在漏诊及对检测条件要求较高等不足,与核酸检测相比,抗体检测通常具有普及面广、样品采集便捷、容易实现高通量、成本低等优点,与核酸检测联合应用可有效弥补核酸检测的缺陷[9,10]。
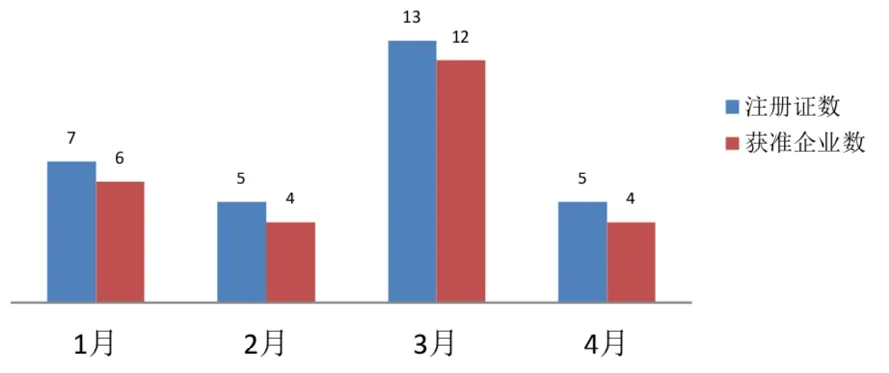
图2 2020 年1~4 月新型冠状检测试剂按月获批情况
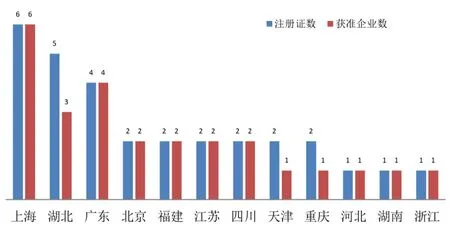
图3 2020 年1~4 月新型冠状检测试剂获批企业所在省份

图4 2020 年1~4 月全国各地区新型冠状检测试剂获批数量及占比
30 个获批检测试剂中,19 个是核酸检测试剂,占获批检测试剂总量的63.33%,分别采用荧光PCR 法、RNA 捕获探针法、RNA 恒温扩增-金探针层析法、恒温扩增-实时荧光法、恒温扩增芯片法、联合探针锚定聚合测序法、双扩增法、杂交捕获免疫荧光法8种方法检测患者病毒核酸进行诊断;另11 个是抗体检测试剂,占获批总量的36.67%,分别采用胶体金法、磁微粒化学发光法检测患者血清、血浆样本中新型冠状病毒(2019-nCoV) IgG 或IgM 抗体进行诊断。
30 个检测试剂中,采用荧光PCR 法检测的有12 个,占获批总量的40.00%;采用胶体金法的6 个,占总量的20.00%,采用磁微粒化学发光法的有5 个,占总量的16.67%;采用上述其他方法的各1 个,见图5。

图5 2020 年1~4 月获批新型冠状检测试剂采用的检测方法
2 获批上市有关新型冠状病毒检测试剂
上海之江生物科技股份有限公司研制的新型冠状病毒2019-nCoV 核酸检测试剂盒(荧光PCR 法)获得国内首个新型冠状病毒检测试剂注册证[11],该试剂在1h 左右即可出具新型冠状病毒核酸检测结果。
重庆医科大学联合博奥赛斯(重庆)生物科技有限公司研发的新冠病毒IgM/IgG 抗体检测试剂盒(磁微粒化学发光法)是全国首个获批上市的化学发光法新冠病毒IgM/IgG 抗体检测试剂盒[12]。
上海仁度生物科技有限公司开发的新型冠状病毒2019-nCoV 核酸检测试剂盒(RNA 捕获探针法),采用RNA 特异靶标捕获和转录介导的恒温扩增实时检测技术,在一个反应管中自动化完成核酸提取、扩增步骤,90min可出结果,并可实现连续并行检测,提升检测效率[13]。
博奥生物集团有限公司联合清华大学、四川大学华西医院共同设计开发了用于呼吸道多病毒检测的全新微流控芯片系统——六项呼吸道病毒核酸检测试剂盒(恒温扩增芯片法),该芯片只需采集患者的口、咽拭子等分泌物样本,在90min 内便可一次性检测包括新型冠状病毒(2019-nCoV)在内的6种呼吸道常见病毒,并已获得欧盟CE-IVD 认证[14]。
杭州优思达生物技术有限公司的新型冠状病毒2019-nCoV 核酸检测试剂盒(恒温扩增-实时荧光法)通过检测咽拭子和痰液样本中新型冠状病毒ORF1ab 基因、N 基因和E 基因进行定性诊断,为三重靶标设计,是国内获批的第一个新冠核酸即时检验(point-of-care testing)试剂[15]。
中国科学院相关院属科研机构联合企业成功研制4 套检测产品获准上市[16],分别为广州生物医药与健康研究院和广东和信健康科技有限公司联合研发的新型冠状病毒(2019-nCoV) IgM 抗体检测试剂盒(胶体金法)、武汉病毒研究所与珠海丽珠试剂股份有限公司合作研发的新型冠状病毒(2019-nCoV) IgM/IgG 抗体检测试剂盒(胶体金法)、苏州生物医学工程技术研究所与安邦(厦门)生物科技有限公司合作研发的新型冠状病毒2019-nCoV 核酸检测试剂盒(杂交捕获免疫荧光法)、上海巴斯德研究所与上海仁度生物科技有限公司合作研发的新型冠状病毒2019-nCoV 核酸检测试剂盒(RNA 捕获探针法)。
3 获批企业有关情况
如图2 所示,截至2020 年4 月30 日,全国共有26 家企业的新型冠状病毒检测试剂获批上市,1~4 月获批企业数量分为6、4、12、4 个,3 月有多达12 家企业获得产品注册证。26 家企业在全国12 个省(市),如图3 所示,上海6 家位居首位,广东4 家位居其次,湖北3 家排在第三,北京、福建、江苏、四川、重庆各获批2 家,河北、天津、湖南、浙江各获批1 家。
获批新型冠状病毒检测试剂注册证书主要集中在东部省份。东部省份北京、天津、上海、河北、江苏、浙江、福建、广东8 省(市)共获得注册证的企业有19 家,占总数的73.08%;中部省份湖北、湖南2 省有4 家,占总数的15.38%;西部省份重庆、四川2 省(市)3 家,占总数的11.54%。
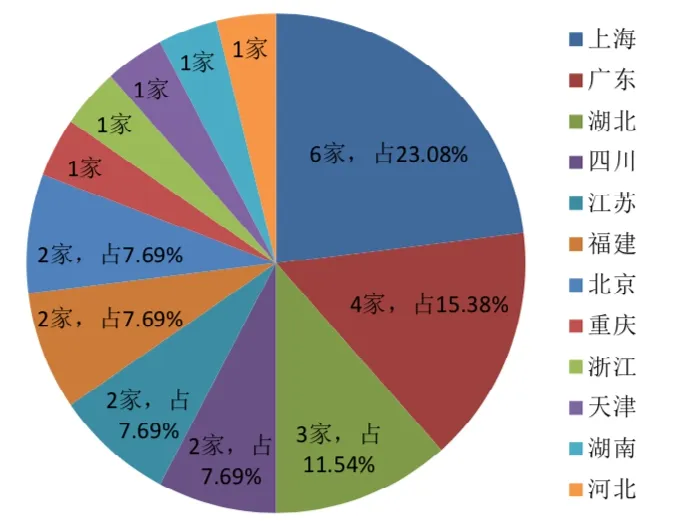
图5 2020 年1~4 月各省份新型冠状检测试剂获批企业数量及占比
26 家企业中,获得2 个注册证的有4 家,分别是华大生物科技(武汉)有限公司、博奥赛斯(重庆)生物科技有限公司、武汉中帜生物科技股份有限公司、丹娜(天津)生物科技有限公司,其他22家企业各自获得1 个注册证。
4 结语
当前国内新冠病毒疫情防控形势逐步向好,国内上市的30 个新冠病毒检测试剂日产能已达902.5万人份[17],切实保障了国内医疗检测需求,但国际疫情仍呈现加速扩散蔓延之势,我国疫情仍存在反弹风险,全球对疫情防控用医疗器械包括检测试剂的需求数量剧增[18],做好新冠病毒检测试剂的研发和审批仍是当前紧迫的任务。

