1例Miyoshi肌病的临床、影像、病理及基因检测报道
谌书云
【摘要】目的:分析Miyoshi肌病的临床影响及基因检测情况。方法:回顾性分析1例Miyoshi肌病的临床病例,并总结其临床表现、影像学资料以及基因检测报告。结果:患者足跟、足尖行走不能,行走跨阈步态;影像学检查发现磁共振成像显示下肢肌肉不仅存在萎缩脂肪化,还存在明显水肿信号,主要以小腿中下部明显。基因检测结果发现二代测序显示为dysferlin基因的复合杂合突变。结论:Dysferlin肌病易误诊和漏诊。肌肉组织活检特异性dysferlin显著降低或缺如、DYSF基因突变,有助于明确诊断和分型诊断。
【关键词】Miyoshi;dysferlin;dysferlinopathy;远端肌病;肌营养不良
【中图分类号】R746 【文献标识码】A 【DOI】10.12332/j.issn.2095-6525.2020.12.235
1 临床资料
患者男性,21岁,以双下肢进行性无力为首发症状,病程4年,表现为平地行走耐力降低,行走拖步改变,足跟、足尖行走不能,症状缓慢加重,2年前逐渐出现上楼、蹲起困难,行走跨域步态,无明显上肢无力,无面部和颈部肌无力,无发声及吞咽困难,无呼吸困难、胸闷,无肌痛、僵硬、肉跳等;既往无特殊疾病史;患者为第1胎第1产,足月顺产,无产伤史和窒息史,无围生期特殊疾病病史,生长发育里程碑正常;父母非近亲婚配,身体健康;家族中无类似疾病病史,无其他遗传性疾病病史。
体格检查:神志清楚,高级认知功能正常,语言表达清晰,脑神经检查未见明显异常;双上肢肌力5级,双下肢近端肌力5-级、远端4级,双上肢肌容积、肌张力、腱反射正常,双侧下肢轻度肌萎缩,足内肌萎缩不明显,未见明显足下垂,高足弓表现,张力下降,下肢腱反射减弱,双侧指鼻试验稳准,跟.膝.胫试验稳准,感觉系统无明显异常,病理反射未引出。
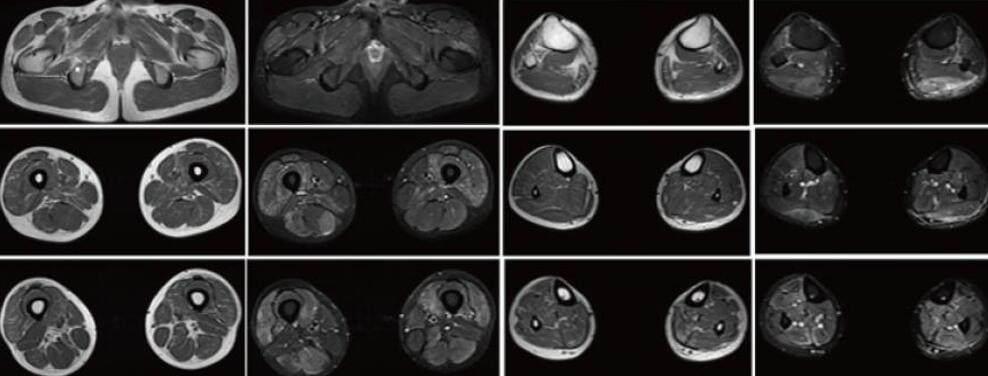
实验室检查:生化:ALT 104.10 U/L(9-50),AST 95.60 U/L(15-40);乳酸 3.96mmol/L(0.6-2.2);甲功T3FT4TSH:TSH 4.77mIU/L(0.27-4.20),肌酶全套:CK 6112.0U/L(50-310) CK-MB 160.70U/L(0-25) LDH 470.0U/L(120-250)HBDH 282.0U/L(72-182);ANA抗体谱:抗Ro 52抗体可疑阳性,Sm/RNP可疑阳性;ACA、CCP、ANCA、类风湿因子未见异常;血常规、尿常规、大便常规、凝血功能、乙肝、传染病三项未见异常。1周后复查肌酶全套:(CK)2949.0U/L(50-310U/L) CK-MB 84.7U/L(0-25) LDH54.0U/L(120-250)HBDH225.0U/L(72-182);神经电生理检查:NCV:上下肢所检神经均未见异常。F波:右正中神经、左胫神经潜伏期未见异常,出现率分别为90.0%、100%(正常参考值≥79.0%)。H反射:左胫神经、右正中神经未见异常。EMG:①右股四头肌安静时可见1+纤颤电位,小力收缩平均时限缩窄,波幅降低,肌肉轻度收缩时多相电位增多,大力收缩呈病理干扰相等典型肌源性损害改变。 ②左三角肌安靜时未见自发电位,小力收缩平均时限缩窄,波幅降低,大力收缩呈混合相。影像学检查:磁共振成像显示下肢肌肉不仅存在萎缩脂肪化,还存在明显水肿信号;小腿腓肠肌、比目鱼肌明显萎缩,胫骨后肌、拇长屈肌萎缩,且主要以小腿中下部明显,压脂像相应肌肉水肿信号,甚至胫前肌也可见水肿信号,大腿股四头肌、大收肌萎缩,而缝匠肌、股薄肌、半腱肌、股二头肌长头相对保留,压脂像相应肌肉水肿信号。(图3)。
肌肉病理学检查:经知情同意,患者自愿行右侧肥肠肌肌肉活体组织检查,结果示肌肉组织形态均呈肌营养不良改变,可见肌纤维大小不一,部分肌纤维萎缩、变性、坏死,结缔组织增生,可见炎性细胞浸润,未见镶边空泡,肌纤维糖原和脂肪滴含量正常。免疫组织化学染色显示,抗肌萎缩蛋白(dystrophin)肌纤维膜均匀、连续,表达.而dysferlin水平明显缺如(图2)。
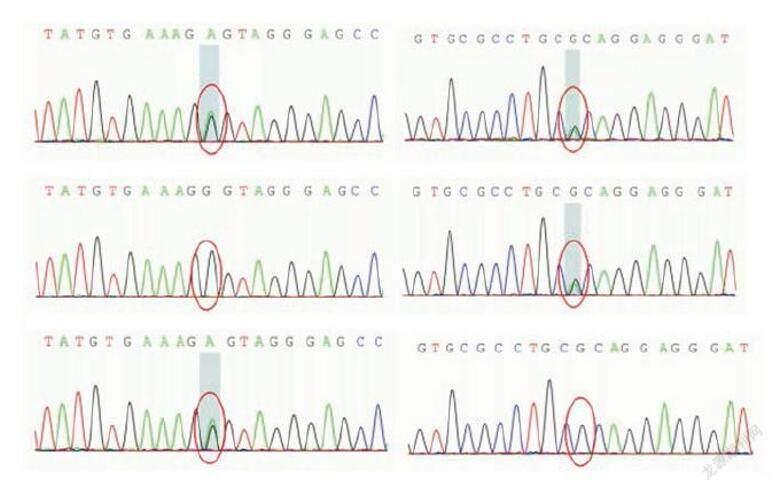
基因检查:二代测序显示为dysferlin基因的复合杂合突变,c.3137G>A(鸟嘌呤>腺嘌呤),导致氨基酸改 变p.R1046H(精氨酸>组氨酸)c.5525G>A(鸟嘌呤>腺嘌呤),导致氨基酸改变 p.G1842D(甘氨酸>天冬氨酸),家系验证显示分别来自父母双方,此两处杂合突变既往均被报道为dysferlin基因的致病突变(图4)。
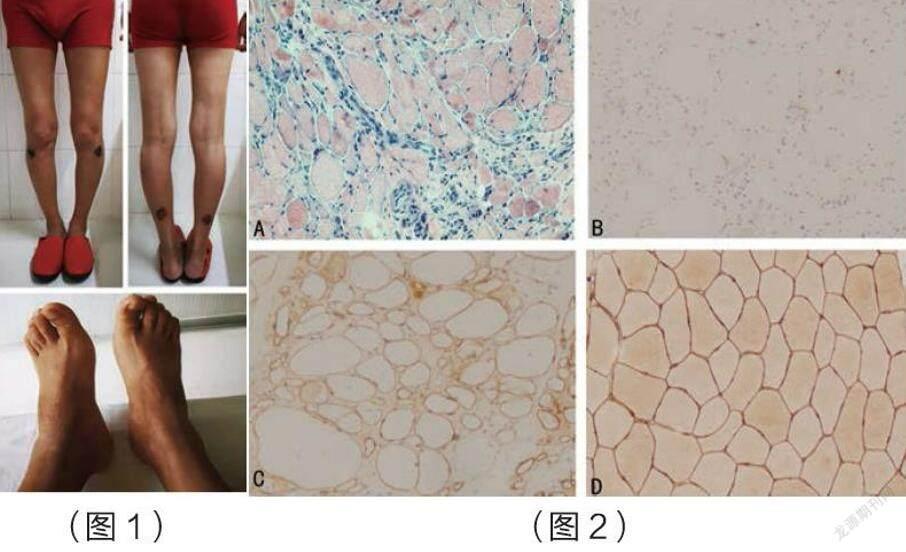
(图1)患者双下肢萎缩不仅仅累计双侧小腿,大腿肌肉也有轻度萎缩表现,足内肌萎缩不明显,未见明显足下垂,高足弓表现。
(图2)(A)苏木精和伊红染色:(1)肌细胞大小不等,结缔组织增生;(2)炎症细胞侵入坏死肌纤维;(3)肌间小血管炎症细胞浸润;
(B)患者dysferlin染色显示没有正常的dysferlin染色;
(C)患者dystrophin-R染色显示正常的dystrophin-R染色
(D)正常人dysferlin染色对照;
(图3)磁共振成像显示下肢肌肉不仅存在萎缩脂肪化,还存在明显水肿信号
(图4):(上:先症者)c.3137G>A(鸟嘌呤>腺嘌呤),导致氨基酸改变p.R1046H(精氨酸>组氨酸;c.5525G>A(鸟嘌呤>腺嘌呤),导致氨基酸改变 p.G1842D(甘氨酸>天冬氨酸);(中:父)c.3137G>A(鸟嘌呤>腺嘌呤),导致氨基酸改 变p.R1046H(精氨酸>组氨酸);(下:母)c.5525G>A(鸟嘌呤>腺嘌呤),导致氨基酸改变 p.G1842D(甘氨酸>天冬氨酸);
2 讨论
Dysferlin肌病系DYSF基因突变导致的常染色体隐性遗传性骨骼肌疾病,根据早期受累肌群不同,主要分为2种临床表型,即以四肢近端肌、盆带肌受累起源的肢带型肌营养不良症2B型(LGMD2B)[1-3]、以腓肠肌受累起源的Miyoshi远端型肌营养不良症(MM)[1, 3-5],其他少见临床表型包括以胫骨前肌受累起源的远端型肌病(DMAT),近端和远端同时受累的近远端型肌病、先天性肌病、腰肌无力型和无症状高肌酸激酶血症[1, 3-5]。不同临床分型反映同一疾病早期症状的差异,同时也造成临床诊断的复杂化。
MM型以腓肠肌无力发病,表现为足尖行走不能,病情进展相对迅速,发病10年后四肢肌肉广泛受累,丧失行走能力,晚期累及颈部和面部肌肉[7, 8];而本研究中患者总病程为4年,症状表现为下肢无力,行走能力尚存,但从影像学可以看出患者受累已不仅仅局限于下肢远端,进一步症状有待长期随访,LGMD2B型多以下肢近端肌无力发病,表现为蹲起困难,逐渐累及上肢近端,病情进展相对缓慢,常于40岁后仍保留行走能力,晚期四肢肌肉广泛受累,但不累及头部、面部、颈部肌肉和心肌,不影响认知功能和生存期[2, 8];在本研究中,患者首发症状是下肢远端进行性无力,肌肉萎缩以小腿后部肌群为主,故考虑为MM型,然而患者就诊时期肌肉MRI:小腿腓肠肌、比目鱼肌萎缩明显,胫骨后肌、拇长屈肌也同样萎缩,且主要以小腿中下部明显,压脂像相应肌肉水肿信号,甚至胫前肌也可见水肿高信号,大腿股四头肌、大收肌萎缩明显,而缝匠肌、股薄肌、半腱肌、股二头肌长头相对保留,压脂像相应肌肉水肿信号。与既往报道受累肌群基本一致[9],但患者双下肢受累肌群广泛,由此可见影像学无法区分各种亚型[10],这可能是dysferlinopathy具有统一的病理生理学,因此影像学表现类似,且Dysferlin肌病各亚型进展至晚期,由于广泛骨骼肌受累,分型诊断较为困难。
除肌营养不良改变外,Dysferlin肌病常表现为不同程度的炎性细胞浸润,且发病年龄、病程和病变程度均与炎性肌病相似。易误诊为多发性肌炎(PM)[11, 12],有些患者错误地长期应用糖皮质激素甚至免疫抑制剂治疗。因此,对于激素治疗效果欠佳的炎性肌病患者,应行免疫组织化学染色,以鉴别Dysferlin肌病与炎性肌病。
Dysferlin肌病的致病基因是DYSF基因,定位于染色体2p13,包含55个外显子,DYSF基因突变类型有多种,迄今尚未发现明显的突变热点,临床表型各异,目前尚未发现临床表型与基因型的关联性[11, 12]。同一个家系具有相同的遗传背景,可能有不同的表型[6]。因此,Dysferlin肌病临床和遗传具有高度异质性,本研究患者为散发病例,其基因为dysferlin基因的复合杂合突变,分别来自父母双方,此两处杂合突变既往均被报道为dysferlin基因的致病突变。结合患者临床及最先受累肌群考虑为MM型。
关于Miyoshi远端肌病的治疗目前尚无特效疗法,主要为对症治疗。 本例患者曾用激素治疗1月余,聯合辅酶Q10、艾地苯醌、复合维生素B等治疗后症状无缓解。
综上所述,我们报道了一例贵州地区散发型Miyoshi远端型肌营养不良症,其临床特征与既往报道基本一致,但Dysferlin肌病存在临床异质性,易误诊和漏诊。详细的病史询问、肌肉组织活检特异性dysferlin显著降低或缺如、DYSF基因突变,有助于明确诊断和分型诊断。
参考文献:
[1]Nguyen, K., et al., Dysferlin mutations in LGMD2B, Miyoshi myopathy, and atypical dysferlinopathies. Human Mutation, 2005. 26(2): p. 165-165.
[2]Mahjneh, I., et al., Dysferlinopathy (LGMD2B): A 23-year follow-up study of 10 patients homozygous for the same frameshifting dysferlin mutations. Neuromuscular Disorders, 2001. 11(1): p. 20-26.
[3]C, et al., Redefining dysferlinopathy phenotypes based on clinical findings and muscle imaging studies. Neurology, 2010.
[4]Cupler, E.J., et al., Miyoshi myopathy in Saudi Arabia: Clinical, electrophysiological, histopathological and radiological features. Neuromuscular Disorders Nmd, 1998. 8(5): p. 321-326.
[5]Cho, H.J., et al., Clinical and genetic analysis of Korean patients with Miyoshi myopathy: identification of three novel mutations in the DYSF gene. J Korean Med Sci, 2006. 21(4): p. 724-7.
[6]张惠丽等, Dysferlin肌病两家系三例临床表型及基因突变分析.中国现代神经疾病杂志, 2018. 18(07): 514-519.
[7]A novel compound heterozygous dysferlin mutation inMiyoshi myopathy.
[8]Omar, A.M.X.J., Limb-girdle muscular dystrophy subtypes First-reported cohort from northeastern China. 中国神经再生研究:英文版, 2013. 8(20): p. 1907-1918.
[9]Diaz-Manera, J., et al., Muscle MRI in patients with dysferlinopathy: Pattern recognition and implications for clinical trials. J Neurol Neurosurg Psychiatry, 2018. 89(10).
[10]金苏芹等, Muscle magnetic resonance imaging changes and relationship with clinical symptoms in patients with dysferlinopathy%dysferlinopathy 患者大腿骨骼肌 MRI 改变及其与临床表现的相关性.中华神经科杂志, 2014. 000(006): 412-417.
[11]胡静袁军辉李娜赵哲沈宏锐, dysferlinopathy患者八例临床及分子病理学特点. 中华神经科杂志, 2007. 40(12): 807-811.
[12]奚剑英等, Dysferlin肌病的临床和病理特点分析(附6例报道). 中国临床神经科学, 2007(03): 296-301.
[13]Bansal, D., et al., Defective membrane repair in dysferlin-deficient muscular dystrophy. Nature, 2003. 423(6936): p. p. 168-172.

