解淀粉芽孢杆菌高产纤维素酶菌株的筛选与鉴定
何深宏,程方俊,罗 干,张 耕,杜亚楠,康霞梅,王晓涵,赵自亮,任绍科,郭建华
(西南大学动物科学学院,重庆 402460)
0 引言
【研究意义】随着我国养牛业迅速发展,传统分散式养殖模式正逐渐被集约化养殖模式所代替。集约化养殖过程中产生的大量粪污对环境造成了巨大危害,并且随着我国环境保护力度的不断加大,牛粪的无害化处理已成为限制我国养牛业发展的重要因素[1]。牛粪由于纤维素、木质素等难降解物质含量高、发酵时间长等原因,导致其开发利用受到严重制约[2-3]。目前,我国牛粪无害化处理的主要方法包括生态还田法、沼气发酵法、堆肥化技术、垫料回用模式等,但由于土地资源、经济效应和安全性等因素,生态还田、沼气发酵、垫料回用模式等方法未能得到广泛应用[4]。近年来,堆肥化技术因其成本投入较低、肥效较高、安全、易于推广等优点,逐渐成为人们无害化处理牛粪的首要选择。【前人研究进展】堆肥化技术的主要原理是利用高产纤维素酶微生物对牛粪中纤维素的降解作用[5]。有关研究表明,从环境中分离得到的降解纤维素的微生物主要包括细菌、真菌和放线菌,其中真菌的降解能力较强,以木霉菌[6]和曲霉菌[7]产生和分泌的纤维素酶系最全面,效果也最佳。细菌降解纤维素的能力与真菌相比虽然稍逊一筹,但其具有繁殖速度快、培养条件简单、发酵周期短等特点。刘宇等[8]从玉米青贮饲料样品中筛选获得一株具有一定产纤维素酶能力的解淀粉芽孢杆菌。崔海洋等[9]从土壤中分离得到一株解淀粉芽孢杆菌,其羧甲基纤维素酶最高可达307.23 U·mL-1。刘锁珠等[10]从藏猪粪便中分离得到一株可高效降解纤维素的解淀粉芽孢杆菌。【本研究切入点】堆肥牛粪中具有较多能够降解纤维素的细菌,从牛粪堆肥样品中分离筛选纤维素酶活性高、繁殖速度快、培养条件简单的降解纤维素优势细菌对实际生产具有重要意义。【拟解决的关键问题】本研究以重庆三峡库区3 个牛粪堆肥厂的牛粪为研究对象,采用10 倍稀释法和平板划线相结合的方式分离纯化微生物,利用水解圈法作为初筛和羧甲基纤维素(Carboxymethyl cellulose, CMC)酶糖化力法作为复筛,以分离筛选出适合该地区地理气候条件的高效分解牛粪中纤维素的微生物,并且通过菌株形态特征观察、生理生化和分子生物学方法鉴定其种属,为重庆三峡库区牛粪的快速无害化降解提供优势菌种资源。
1 材料与方法
1.1 试验材料
1.1.1 试验样品 采用五点采样法分别从重庆三峡库区3 个牛粪堆肥厂采集发酵第5 d、第15 d、第25 d、第35 d、第45 d 牛粪样品,放入冰盒后立即送回实验室,4 ℃保存备用。
1.1.2 培养基 羧甲基纤维素钠培养基:羧甲基纤维素钠5.0 g,硝酸钾1.0 g,磷酸氢二钠1.2 g,磷酸二氢钾0.9 g,硫酸镁0.5 g,氯化钾0.5 g,酵母浸出粉0.5 g,酸水解酪蛋白0.5 g,琼脂15.0 g,蒸馏水1 000 mL,pH 6.9~7.1[11]。
发酵培养基:羧甲基纤维素钠5.0 g,氯化钠5.0 g,牛肉膏5.0 g,蛋白胨10.0 g,蒸馏水1 000 mL,pH 6.9~7.1[11]。
1.1.3 主要试剂 细菌基因组DNA 提取试剂盒购于大连宝生物有限公司;细菌生化鉴定管购于杭州滨和微生物试剂有限公司;琼脂糖购于生工生物工程(上海)股份有限公司;LB 培养基购于赛默飞世尔科技(中国)有限公司;普通营养琼脂培养基购于青岛海博生物技术有限公司。
1.2 试验方法
1.2.1 菌株分离纯化 称取1 g 样品悬浮于99 mL 无菌蒸馏水中,充分混合均匀。采用10 倍稀释法将样品稀释成10-4、10-5、10-6等3 个浓度梯度,吸取各浓度梯度稀释液200 μL 分别涂布于CMC 培养基,37 ℃恒温培养24 h。挑取生长良好的单菌落进行纯化培养,直至得到纯培养物。
1.2.2 产纤维素酶菌株初筛 参照文献[12],采用水解圈法进行初筛。将纯培养物37 ℃、160 r·min-1恒温震荡培养16 h 并通过麦氏比浊法将纯培养物混悬液稀释到0.5 个麦氏浓度后,取10 μL 纯培养物混悬液点种于CMC 培养基并置于37 ℃恒温培养4 d 后,采用0.2%刚果红染色30 min,用蒸馏水和生理盐水洗净染液,再用5%的醋酸固定颜色。每种纯培养物进行3 次重复试验。用游标卡尺测量纯培养物菌落直径(d)与水解圈直径(D),根据水解圈直径和纯培养物菌落直径比值(D/d)筛选出比值大的纯培养物进行复筛。
1.2.3 菌株16S rRNA 基因鉴定 以复筛所得纯培养物DNA 为模板,16S rRNA 基因通用引物(购于武汉金开瑞生物工程有限公司)进行PCR 扩增。反应体系为:上下游引物各2 μL(0.5 μmol·L-1)、模板DNA 1 μL(100 ng)、ddH2O 20 μL、2×Premix Taq 25 μL。反应程序为:94 ℃预变性2 min;94 ℃变性1 min,60 ℃退火1 min,72 ℃延伸2 min,共35 个循环;72 ℃延伸10 min。取PCR 扩增产物5 μL 进行1%琼脂糖凝胶电泳检测,将扩增所得产物切胶回收送重庆擎科生物公司测序。将测序结果通过生物信息学软件MEGA6.0 进行系统发育树的构建。
1.2.4 菌株复筛 参考DB33/T459-2003 标准,采用CMC 酶糖化力法进行测定。将纯培养物接种于LB液体培养基中培养16 h 后,按5%的接种量接种于发酵培养基中,37 ℃、160 r·min-1恒温震荡培养48 h。将培养后菌液置于4 ℃、4 000 r·min-1离心20 min,取上清液(即待测粗酶液)。
取4 支刻度试管(1 支为空白管,3 支为样品管),分别向4 支试管中准确加入0.5 mL 待测粗酶液(空白管加入粗酶液后沸水浴10 min)。向待测粗酶液样品管中加入1% CMC 溶液1.5 mL 和向空白管中加入3, 5-二硝基水杨酸(DNS)试剂3 mL,(40±0.2)℃准确水浴反应10 min 后取出,迅速向待测样品管中加入DNS 试剂3 mL、空白管中加入1% CMC溶液1.5 mL,混匀。沸水浴反应5 min,取出流水迅速冷却至室温后,向各试管中加入10 mL 蒸馏水,混匀。以空白管调分光光度计零点,在波长540 nm处测定各待测样品酶液吸光度,计算酶活。纤维素酶活力定义为在1 min 内水解羧甲基纤维素钠底物,产生相当于1 μg 葡萄糖的酶量即为1 个酶活力单位,每个样品做3 次重复试验。
1.2.5 菌株形态学观察及生化鉴定 菌体形态学及生理生化鉴定参照《伯杰细菌鉴定手册》[13]和《常见细菌系统鉴定手册》[14]进行鉴定。无菌条件下将复筛所得纯培养物接种于普通营养琼脂培养基中,37℃恒温培养24 h。挑取单个菌落进行革兰氏染色并且将纯培养物接种于生化反应管中,置于37 ℃恒温培养24 h 后观察记录结果。
1.2.6 菌株多重PCR 鉴定 参考Cao F M[15]种特异性引物(由重庆擎科兴业生物技术有限公司合成,具体引物序列见表1)。多重PCR 反应体系为:引物BSL72、BSR328、L100、R836、L168、R514、R 674 各0.8 μL(0.5 μmol·L-1)、引物L354 为1.2 μL(0.5 μmol·L-1)、模 板DNA 1 μL(100 ng)、ddH2O 2.2 μL、2×Premix Taq 10 μL。反应程序:94℃预变性3 min;94 ℃变性40 s,61.7 ℃退火40 s,72 ℃延伸25 s,共30 个循环;72 ℃延伸10 min[15]。将PCR 扩增产物进行2%琼脂糖凝胶电泳检测。
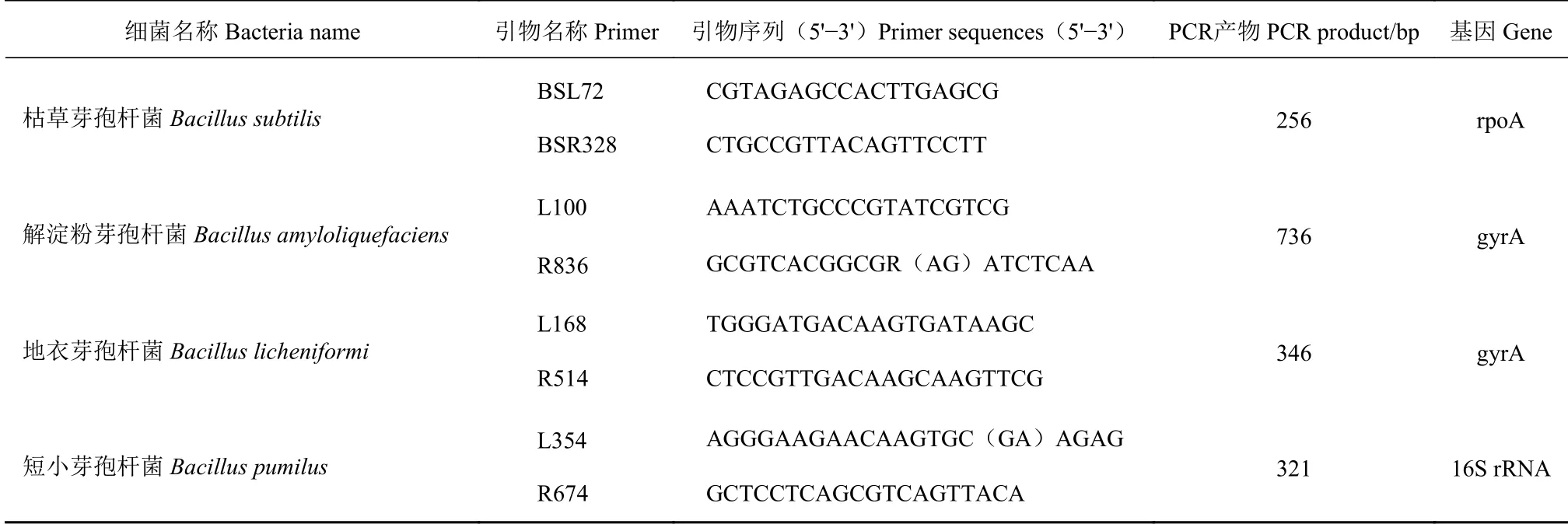
表1 种特异性引物Table 1 Species specific primers
2 结果与分析
2.1 产纤维素酶菌株的分离纯化与初筛结果
采用10 倍梯度稀释法与平板划线相结合,共分离纯化得到57 株纯培养物。通过点种于CMC 培养基培养,进行刚果红染色、醋酸固定后测量水解圈直径(D)与纯培养物菌落直径(d),共筛选出10株水解圈直径与菌落直径比值大于3 的菌株(表2)。水解圈直径与菌落直径的比值越大,表明菌株产纤维素酶能力越强,降解纤维素能力越强[16]。
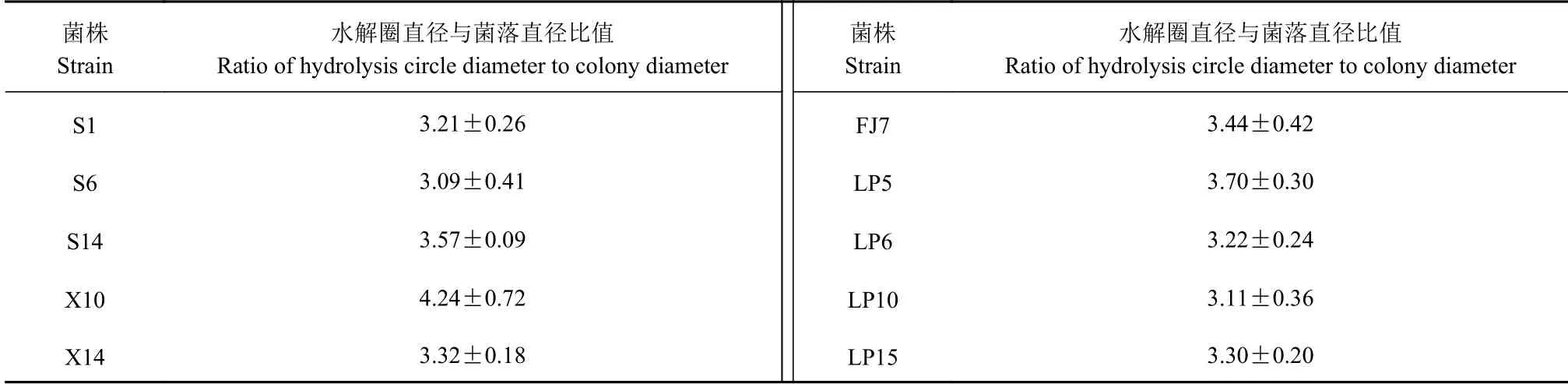
表2 水解圈直径与菌落直径Table 2 Hydrolysis circle and colony diameter tests
2.2 菌株16S rRNA 基因鉴定及系统发育树构建
分别提取初筛所得10 株菌株DNA 进行16S rRNA基因PCR 扩增,1%琼脂糖凝胶电泳检测获得10 条约1 500 bp 目的条带,与预期结果一致。将测序所得序列分别在NCBI 上进行BLAST 比对,结果显示菌株LP5 与赖氨酸芽孢杆菌属(Lysinibacillus sp.)16S rRNA 基因序列相似性最高,为99.86%,其属于赖氨酸芽孢杆菌属;其余9 株菌株与已知芽孢杆菌属(Bacillus sp.)16S rRNA 基因序列相似性均在98%以上,为芽孢杆菌属,其中菌株X10 的16S rRNA 基因序列与解淀粉芽孢杆菌(Bacillus amyloliquefaciens,MH934926.1)的相似性最高,相似性高达99.93%。
采用Neighbor-Joining(NJ)法,利用生物信息学软件MEGA6.0 对10 株菌株16S rRNA 基因进行系统发育树的构建,结果见图1。基于16S rRNA 基因系统发育分析结果显示,菌株X10 与解淀粉芽孢杆菌(KF689544.1、JX907998.1、MH934926.1 等)位于同一簇内,相似性最高。

图1 基于16S rRNA 基因序列构建的系统发育树Fig.1 Phylogenetic tree based on 16S rRNA gene sequence
2.3 初筛所得10 株菌株的复筛结果
将初筛得到的10 株菌株进行酶活测定,结果显示,菌株X10 的CMC 酶活力最高,为31.9 U·mL-1(表3)。
2.4 高产纤维素酶菌株X10 形态学观察及水解圈结果
高产纤维素酶菌株X10 在普通营养琼脂平板上培养24 h 后,形成白色、凸起、表面褶皱无光泽、湿润、黏稠、不透明、直径3~4 mm 圆形的菌落(图2);革兰氏染色镜检为革兰氏阳性菌,菌体呈短杆状,芽孢中生或端生、孢囊不膨大(图3);菌株X10 水解圈见图4。
2.5 高产纤维素酶菌株X10 生化鉴定结果
高产纤维素酶菌株X10 生化试验结果由表4 可知,高产纤维素酶菌株X10 七叶苷、VP 试验、水杨酸试验为阳性,发酵葡萄糖、蔗糖、不发酵乳糖、麦芽糖、甘露醇、MR(甲基红)、硫化氢、靛基质试验为阴性,符合解淀粉芽孢杆菌生理生化特性[13-14]。

表3 CMC 酶活测定结果Table 3 CMC enzyme activity assay results

图2 菌株X10 普通营养琼脂培养基上的生长特性Fig.2 Growth of strain X10 on general nutrient agar medium

图3 菌株X10 革兰氏染色(10×100 倍)Fig.3 Gram stained strain X10(10×100 times)
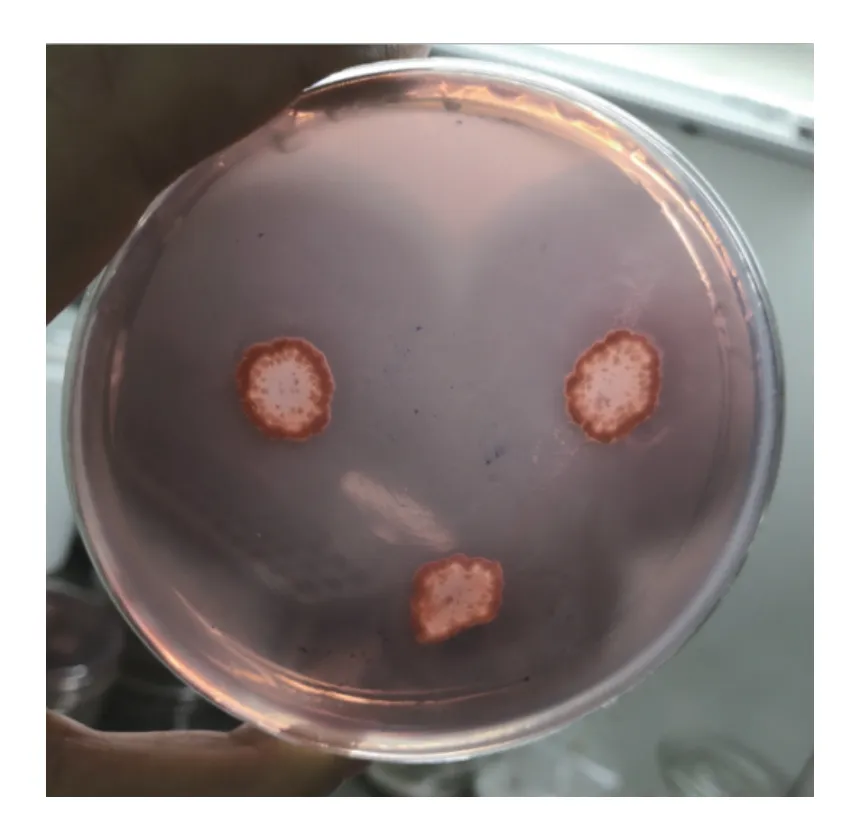
图4 菌株X10 纤维素酶水解圈Fig.4 Cellulase hydrolysis circle by strain X10
2.6 高产纤维素酶菌株X10 多重PCR 扩增结果
提取菌株X10 基因组进行多重PCR 扩增。2%琼脂糖凝胶电泳检测,获得大小约736 bp 目的条带,目的条带基因片段大小与预期片段大小一致(图5)。
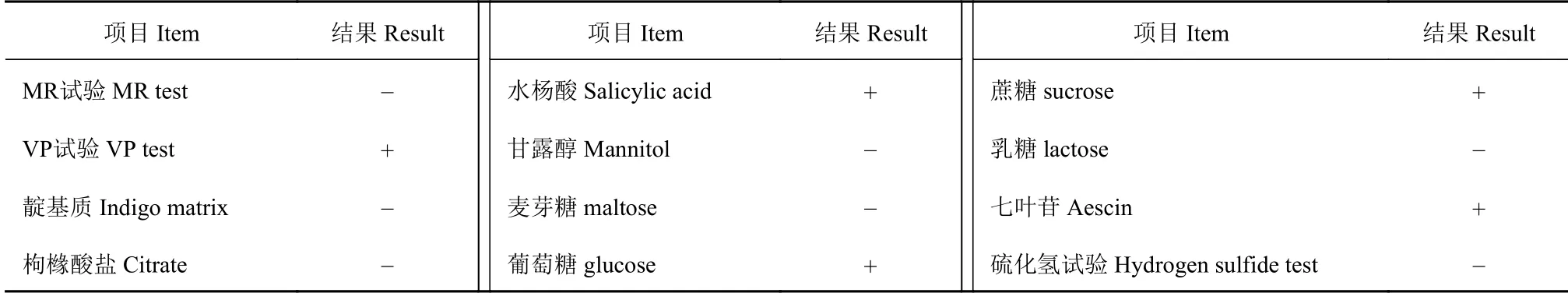
表4 高产纤维素酶菌株X10 生化鉴定结果Table 4 Biochemical identification of cellulase-producing strain X10

图5 高产纤维素酶菌株X10 多重PCR 扩增结果Fig.5 Multiplex PCR amplifications of cellulase-producing strain X10
3 讨论
牛粪发酵过程中优势菌株具有一定的地理气候差异性。本研究从重庆三峡库区3 个牛粪堆肥厂样品中共分离得到57 株细菌,其中菌株X10 纤维素酶活最高,达31.9 U·mL-1。通过菌株形态特征观察、生理生化试验和16S rRNA 基因鉴定,确定菌株X10 为芽孢杆菌属细菌,革兰氏染色阳性。由于16S rRNA 基因鉴定方法只能确定到该菌所在的属,无法精确到该菌的种。本研究利用Cao F M[15]学者于2008年建立的用于快速鉴定解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、枯草芽孢杆菌(Bacillus subtilis)、地衣芽孢杆菌(Bacillus licheniformis)和短小芽孢杆菌(Bacillus pumilus)的多重PCR 方法对分离菌株X10 进行多重PCR 鉴定,最终确定菌株X10 为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。
纤维素酶是一种复合酶,主要包括内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶。内切葡聚糖酶能够切割纤维素中β-1,4 糖苷键并且具有碳水化合物的结合位点,因此被认为是主要的纤维素酶[17]。近些年来对产纤维素酶微生物的研究报道越来越多。杨丽娜等[18]从腐烂秸秆和腐木分离筛选得到一株产耐热性纤维素酶菌株NP29,其纤维素酶活为1.8 U·mL-1。姜军坡等[19]以CMC 酶活力为指标,对解淀粉芽孢杆菌Tu-ll5 菌株产纤维素酶液体发酵条件进行优化,酶活力达到(18.43±0.91)U·mL-1,比优化前提高了26.5 倍。黄玉兰等[20]从若尔盖高寒湿地土壤中筛选出一株纤维素酶高产菌株XW-1,CMC 酶活达到15.6 U·mL-1。王凯等[21]从140 株芽胞杆菌中筛选出一株具有较高纤维素酶活力的解淀粉芽胞杆菌FJAT-8 754,该菌株初始的纤维素酶活力为15.69 U·mL-1,经均匀设计法优化后纤维素酶活力高达202.9 U·mL-1。本研究通过水解圈法和CMC 酶糖化力法对分离菌株进行纤维素酶活性初筛和复筛,最终获得一株CMC 酶活达31.9 U·mL-1的解淀粉芽孢杆菌X10,与上述学者分离所得的产纤维素酶菌株相比处于较高水平,其具有较好的产纤维素酶菌株初始条件,有望在纤维素酶活力优化的进一步研究中发挥积极作用。
不同地理气候特征和来源的产纤维素酶解淀粉芽孢杆菌具有一定差异性。重庆三峡库区属亚热带湿润季风气候,并具有河谷气候特点为夏季高温、降水充沛,与长江以南同纬度或纬度偏低的临近地区相比,具有明显的热量优势[22]。本研究从重庆三峡库区3 个牛粪堆肥发酵场不同发酵时期的样品中共分离得到57 株细菌,并筛选出1 株纤维素酶活力较高的解淀粉芽孢杆菌X10。解淀粉芽孢杆菌X10 在重庆三峡库区高效降解纤维素菌剂的研发方面具有积极作用,同时有望为该地区牛粪的快速无害化降解提供优势菌种资源。

