水淹胁迫对小蓬草(Conyza canadensis)的形态结构与生理生化特性的影响
杨玲,刘玲,胡馨月,甘丽萍
重庆三峡学院生物与食品工程学院,重庆 404000
0 前言
三峡工程采取“冬蓄夏排”的水库调水方式,年水位在145—175 m之间,形成了30米高程的消落带,该区植被物种多样性呈现下降趋势[1],水土流失严重,进而导致消落带生态系统结构和功能受损[2]。近年,消落带植被的修复及库区生态系统恢复广受社会各界的重视,恢复消落带植被的有效方法之一是人工植被的筛选与重建,特别是那些能够适应水淹和干旱的植物的选择[3]。水淹现象是自然界中常见的一种植物逆境生长环境。水淹胁迫下,植物为了减缓由胁迫造成的压力,光合参数、生长特性和解剖结构会做出相应的调整,启动各自的生理生态防御机制[4-5]。研究表明三峡库区消落带共生长着58科 175种植物,5个灌丛群落,49个草本植物群落,一年生植物是优势群落[6]。狗牙根(Cynodon dactylon)[7-8]、牛鞭草(Hemarthria altissima)[9]、狗尾草(Setaria viridis)、马唐(Digitaria sanguinalis)、野生香根草(Vetiveria zizanioides)[10]、野古草(Arundinella anomala)[11]、水芹(Oenanthe javanica)[12]等植物在三峡库区消落带水旱环境的交替过程中能保持较高存活率,它们通过形态学发育及丙二醛(MDA)、渗透调节物质的动态平衡以及抗氧化酶系活力的调整维持活性氧ROS代谢内稳态,表现出对水淹环境不同程度的适应性。
经历 8 次水位涨落周期后,消落带植物种间生态位重叠值较高,种间竞争强烈,该区植被仍处于群落演替的初级阶段[4]。探究更多的对水淹有适应性的植物以及对生态恢复影响的研究是消落带植被恢复的重要基础。小蓬草(Conyza canadensis)是菊科一年生草本,是我国分布最广的入侵物种之一。调查显示小蓬草是海拔 165—175 m 段的主要草本物种[13],并且有局地爆发现象,作为外来入侵植物,当前对小蓬草的研究主要集中在它的化感作用及生物活性方面[14-15],小蓬草较耐低温,在三峡水库冬季蓄水时间段,在消落带无水处一直存活,但在水淹环境中能存活多久?水淹胁迫对小蓬草生理生化特性的影响如何?这方面都没有报道。本研究选择小蓬草进行水淹胁迫,测定相关的光合指标与生理指标,来探讨其耐淹机理,为库区消落带入侵物种的适应性及生态植被恢复提供参考数据。
1 材料与方法
1.1 试验材料与设计
试验于2018年10月在三峡库区万州消落区挖取生长良好且长势基本一致的小蓬草幼苗株高(20±2) cm作为实验样本,栽植于(直径25 cm,高18 cm)塑料花盆中,每盆1株(栽种土壤为当地消落带沙壤土),放置于重庆三峡学院生物与食品工程学院遮阴棚里,待植株生长稳定后转移到露天天台上,将生长均等的植株设置为3个水淹处理组,即对照组(CK,全程不淹水,自然环境)、半淹组(Semi-submerge Group,SsG,水淹没植株根茎,在第一片叶以下)和全淹组(Submerge Group,SG,水分淹没植株最顶端叶片),测量植株做好标记。
1.2 测定项目与方法
1.2.1 形态指标
试验采用直尺进行小蓬草叶宽(最宽处)、叶长、根系主根长、平均茎高的测定,其中叶片相对面积用叶宽乘以叶长表示,测根数人工数数统计数量。水淹当天(0 d),水淹后 7 d,30 d,50 d 分别进行标记植株各生长指标的测定,每种处理测量 3株各数据取平均值。
1.2.2 生理指标测定
分别测定水淹0 d、7 d、30 d和50 d不同处理小蓬草植物以下生理指标: 叶绿素含量测定参照Grace等的方法[16];可溶性还原糖含量测定采用蒽酮-硫酸法[17]。丙二醛(MDA)含量测定采用硫代巴比妥酸比色法[17];游离脯氨酸含量测定采用酸性茚三酮法[17];超氧化物歧化酶(SOD)活性测定参照Knrzer[18]的方法;根系活力测定采用氯化三苯基四氮唑(TTC)法[16]。
1.3 根系切片方法
参照李和平[19]的方法,在小蓬草淹水第30 d和50 d选取三个处理主根,制作根毛区横切面石蜡切片。用蒸馏水冲洗根系样品,滤纸吸干表面水分后以福尔马林-乙酸-乙醇固定液固定。采用 LERCA(GERMANY)全自动切片机制作高精度切片,番红染色,使用生物光学显微镜观察石蜡切片中根系解剖结构并实行同期拍照,本部分委托河南风桦教学仪器有限公司完成。
1.4 数据处理与分析
用Microsoft Excel2010及SPSS19.0软件对实验数据进行分析处理和作图,采用单因素方差分析(one-way ANOVA),并用 Tukey多重比较检验各指标的差异显著性,显著水平为 0.05和0.01。
2 结果与分析
2.1 形态指标
与对照组相比,半淹组和全淹组在水淹30 d后,小蓬草侧根数和主根长明显增加,地上开始有叶片坏死腐烂(图 1);淹水 50 d 后,半淹组心部叶片残留,边缘叶片坏死,全淹组叶片全部坏死,两者根系韧皮部易脱落,木质部残存。
不同水淹处理7 d、30 d和50 d小蓬草地上和地下形态指标结果如表1所示。在水淹7 d时,半淹组和全淹组各调查指标与对照组相比没有显著变化。水淹处理30 d后,淹水组地上和地下部分发生了显著的变化。半淹组和全淹组由于部分叶片坏死,两组相对叶面积和平均茎高与对照相比都显著降低,而主根长度和侧根数则呈现较明显的增加趋势。随着水淹时间增加至 50 d,半淹组地上部分只有心部部分叶片存活,因此单叶叶面积和平均茎高极显著降低与淹水 30天相比,主根长度没有变化,但根毛数量显著减少。全淹组地上部分全部坏死,没有数值主根坏死回缩,较30 d时显著变短,侧根数也明显减少。
2.2 生理生化指标
2.2.1 叶绿色含量

图1 小蓬草水淹处理(对照组:CK; 半淹组:SsG; 全淹组:SG, 下同)Figure 1 Flooding treatment of Pennisetum canadensis (control group:CK; semi- submerge group:SsG; submerge group:SG, the same below)
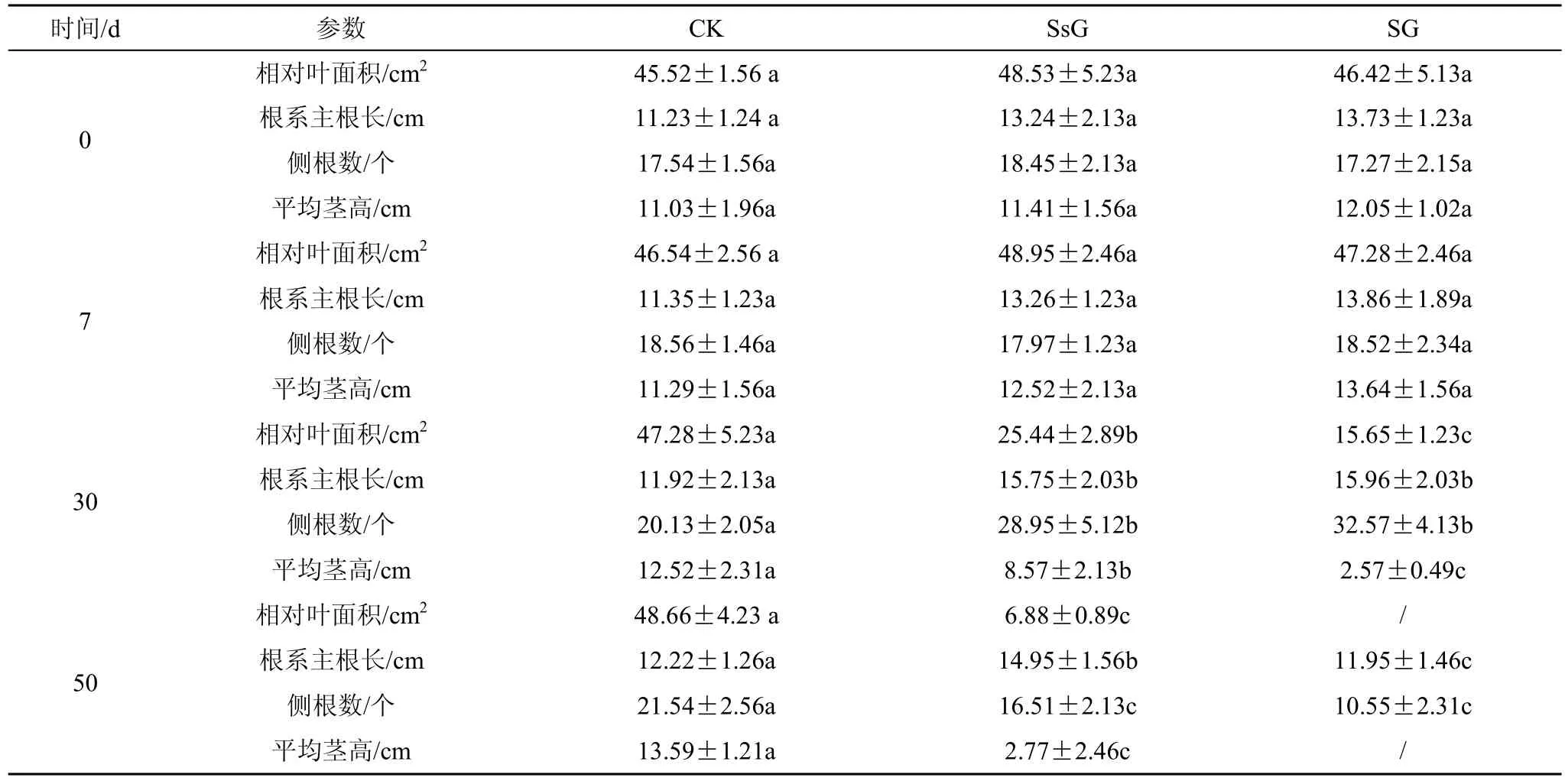
表1 不同水淹处理下小蓬草形态学特征变化Table 1 Changes of morphological characteristics of Conyza canadensis under different flooding treatments
小蓬草水淹胁迫后叶绿素含量变化如图 2所示。与对照组相比,水淹胁迫7 d后,半淹组和全淹组叶绿素含量无显著差异。随着水淹时间的增加,水淹至30 d时,淹水组叶绿素含量显著下降,全淹组与对照及半淹组之间都达到了显著差异,水淹至50 d时,半淹组叶片叶绿素极显著降低,全淹组在50 d时地上部分全部坏死,没有叶片相应数据,下同。
2.2.2 可溶性糖含量

图2 水淹胁迫对小蓬草叶绿素含量的影响Figure 2 Effects of flooding stress on chlorophyll content of Conyza canadensis
小蓬草水淹胁迫后可溶性糖含量变化如图3所示。与对照组相比,水淹胁迫7 d后,淹水组可溶性糖含量于对照之间没有达到显著差异;随着水淹时间的增加,至30 d时,全淹组可溶性糖含量迅速上升,与对照相比达到了显著差异;水淹至 50 d时,半淹组可溶性糖含量与对照相比达到显著差异。
2.2.3 丙二醛含量
小蓬草水淹胁迫后丙二醛含量变化如图 4所示。与对照组相比,水淹胁迫7 d后,半淹组和全淹组丙二醛含量与对照相比无显著差异。随着水淹时间增加至30 d时,半淹组和全淹组丙二醛含量均增加,与对照之间的差异都达到了显著水平;水淹胁迫至50 d时,半淹组丙二醛含量仍然增长显著,极显著高于对照组。

图3 水淹胁迫对小蓬草可溶性还原糖含量的影响Figure 3 Effects of flooding stress on soluble reducing sugar content of Conyza canadensis

图4 水淹胁迫对小蓬草丙二醛含量的影响Figure 4 Effects of flooding stress on malondialdehyde content of Conyza canadensis
2.2.4 游离脯氨酸含量
小蓬草水淹胁迫后游离脯氨酸含量变化如图 5所示。水淹胁迫至30 d时,半淹组和全淹组游离脯氨酸含量都增加,与对照组相比都达到了显著差异;水淹胁迫至50 d时,半淹组游离脯氨酸含量继续上升,与对照达到了显著差异。
2.2.5 超氧化物歧化酶活性
小蓬草水淹胁迫后超氧化物歧化酶(SOD)活性变化如图6所示。水淹胁迫至30 d时,半淹组和全淹组SOD含量都增加,与对照组相比都达到了显著差异;水淹胁迫至50 d时,半淹组SOD含量继续增加,与对照达到了极显著差异。
2.2.6 根系活力变化
小蓬草水淹胁迫后根系活力变化(TTC含量)如图7所示。水淹胁迫至30 d时,半淹组和全淹组根系活力增强,与对照组相比都达显著水平;水淹胁迫至 50 d时,半淹组和全淹组根系活力均降低,其中全淹组与对照相比达到了显著差异。

图5 水淹胁迫对小蓬草游离脯氨酸浓度的影响Figure 5 Effects of flooding stress on free proline content of Conyza canadensis

图6 水淹胁迫对小蓬草超氧化物歧化酶活性的影响Figure 6 Effects of flooding stress on superoxide dismutase activity of Conyza canadensis

图7 水淹胁迫对小蓬草根系活力的影响Figure 7 Effects of flooding stress on root activity of Conyza canadensis
2.3 根系细胞组织变化
半淹组和全淹组在第30 d的时候,小蓬草主根成熟区横切片结构显示,淹水组根系整个结构基本完整,局部来看,周皮细胞变得松散,气腔面积扩大(图8 B和C黄色箭头处),木质部出现出现溶生型气腔(图8 B和C红色箭头处),全淹组有部分木质射线连接中断,细胞开始瓦解(图 8C 绿色箭头处);到第 50 d时,与对照相比,淹水组根系维管形成层以内细胞发生破裂,呈崩溃状,全淹组破裂更为明显(图8 E和F绿色箭头处)。
3 讨论
3.1 形态变化

图8 水淹胁迫对小蓬草根系结构的影响(20X)(A、D:对照组; B、E:半淹组:C、F:全淹组)Figure 8 Effects of flooding stress on root anatomical structure of Conyza canadensis
缺氧是水淹环境对植物的主要危害之一。为了缓解缺氧对植物造成的伤害,不同植物会采用不同的方式来逃避或适应这种环境。本实验中,不同处理的小蓬草在30 d的各调查指标增长量的顺序为根系长>侧根数>茎高>相对叶面积,当水淹胁迫发生初期时,小蓬草地上部分叶面积逐渐减小,主茎高度降低,地上部分消耗降低,根系生长量增加,当逆境胁迫持续存在,地上部分逐渐死亡,而地下通过减少侧根的数量和主根逐渐回缩来维持生命,延续植物存活的时间。很明显,地下部的生长更为积极,在水淹胁迫中根系的存活时间大于地上部分存活的时间。前期研究结果也表明植物在水淹环境中可采取“静默策略”[20],即通过增加根表面积和侧根数量增强地下部分生长,来吸收氧,减缓地上部分生长,减少养分消耗,提高自身对水淹的耐受性[21-22]。说明植物在逆境环境中有一种共同的抵抗基础。
3.2 生理指标变化
小蓬草在水淹30 d后,部分叶片坏死,到50 d只有半淹组的心叶存活,叶绿素含量显著下降,研究表明水淹造成厌氧或缺氧的生长环境,造成地上部分营养不良,叶片发黄,叶绿素含量下降[23],同时,水淹植物的叶绿体膜结构受到了损害,加快了叶绿素的降解[24]。
水淹胁迫不同程度地提升了小蓬草叶片中的可溶性糖含量,植物在水淹环境下可以通过调节可溶性糖和可溶性蛋白的含量来保持细胞渗透势的平衡,以此抵抗水分胁迫带来的伤害[25-26]。淹水 30 d时,胁迫已超过小蓬草细胞的耐受极限,蛋白酶的活性迅速提高,加快了蛋白质的水解,促使蛋白质大量降解成可溶性糖等物质。小蓬草在半淹处理后在7 d时,丙二醛含量与对照没有显著变化,到 30 d时,与对照组相比,丙二醛含量显著升高,表明 MDA的含量随淹水时间的增加而增加,来清除细胞内过多氧自由基,来提高植物的逆境适应性和存活能力[27]。随着水淹时间的延长,无论是半淹组还是全淹组植物体内脯氨酸含量都相应增多。逆境条件下,脯氨酸不仅可以调节细胞质的渗透势,而且可以保护蛋白质分子,增加其水合度等[28]。植物体内可溶性糖含量与植物的再生相关[29],可溶性糖的增加,还能为脯氨酸的合成提供碳骨架和能量来源,同时植物体内脯氨酸和可溶性糖含量都存在一定的季节性变化规律[30],因此为了全面评估其抗逆性,还需要结合植物的生长规律和气象气候等环境因子来开展研究,以期更全面的评价对不同水分压力的响应和适应。
水淹30 d时,2 种处理下的小蓬草叶片SOD 活性均显著大于对照,说明小蓬草通过提高抗氧化酶系的活性来减轻水淹胁迫下活性氧积累对植物细胞的伤害。需要注意的是植物抗氧化酶的活性并不会随着胁迫程度的增强而无限的增大[31]。当超过一定程度的胁迫后,抗氧化酶也会失衡。
3.3 根系结构变化
经水淹处理的小蓬草根细胞受到伤害,皮层破裂明显,形成层处细胞呈崩溃状。但同时在淹水组木质部细胞形成了溶生型组织,更有利于通气。不定根形成发达的通气组织以及丰富稳定的线粒体等细胞器是耐淹水植物适应淹水胁迫的重要改变之一[32]。本研究小蓬草根系能存活50 d,在30 d时根系结构基本完整,木质部也通过细胞融合来适应通气,此时的根系活力与对照相比,都显著增加,说明根系通过加强自身的代谢能力来提高对淹水胁迫的适应能力。
小蓬草在短期淹水环境下,通过降低地上部分叶片面积和茎高来降低蒸腾消耗,叶片丙二醛(MDA)、脯氨酸、超氧化物歧化酶(SOD)活性都升高来维持代谢平衡,而同时根系生长积极主动,主根长和侧根数都增加,根系活力也增强,通过皮层细胞变松散和木质部细胞形成的溶生型组织来应增加氧气通道,适应缺氧环境。消落带草本植物在淹水生境中表现出“低投入-快速回收”的生长策略,植物性状通过各个性状间的相互权衡来调节物质能量平衡[33]。
三峡水库冬夏高水位的落差循环使得能完全适合消落带水陆两栖环境的植物稀少[13],小蓬草在人工模拟水淹环境中,半水淹条件下叶片能存活的时间不超过50d,全水淹环境下不超过30 d,具备短期耐水淹能力。消落区存在的很多草本植物虽然不能全程适应淹水与干旱的环境,都将通过不同生态位的水淹时间和落退水后恢复时间的早晚,来完成消落带区不同生态位的短时配置,为整个库区生态植被的修复贡献不同的力量。另外,从外来种对自然生态系统的生物多样性和生态系统服务功能开展研究相对较少[34],小蓬草这类植物除了关注其本身的生长对库区的适应性以外,还需要进一步研究与其他植物的互作关系,本文的研究结果为今后研究小蓬草在自然长江水淹条件下的存活及对其他植物和生态的影响提供基础数据。

