心腔内超声指导下零射线或极低量射线心房颤动消融单中心经验
昃峰 周旭 杨丹丹 苑翠珍 李学斌 李鼎
近年来,随着导管介入技术的进步,心房颤动(简称房颤)的导管消融成功率及安全性大大提高。目前已经成为症状明显的房颤患者最主要的治疗方法之一[1]。房颤的导管消融需要完成房间隔穿刺、心房模型建立、肺静脉隔离及三尖瓣峡部等解剖位置的电学消融及隔离[2-3]。传统的手术方式需要患者及术者在X 线曝光下进行上述操作和治疗。另外,肺静脉的隔离是房颤导管消融最主要的治疗基石,为了更好地显示肺静脉的解剖结构及变异,通常需要进行肺静脉造影的检查,术中大量的造影剂应用,造成了进一步肾脏功能损害的风险[4]。心腔内超声作为一项新技术,能很好地显示心脏内特殊解剖结构,在心脏介入治疗和电生理检查中,显示出其良好的应用前景。目前心腔内超声不仅可以显示心脏的所有结构及解剖位置,并且可以在导管操作的过程中实现三维模型的建立,大大优化了手术流程,提高了手术的安全性。目前结合三维技术,心腔内超声指导可以实现零射线或极低射线量的房颤血栓筛查、导管放置、房间隔穿刺及消融等一系列的操作。
目前在超声指导下房颤消融手术在国外已经相对成熟,部分中心也报道了相关的安全性及有效性的分析,但国内目前开展相对较少,术式各不相同,本研究主要总结北京大学人民医院超声指导下零射线或极低射线量的房颤消融手术的安全性、有效性的单中心经验。
1 资料与方法
1.1 病例资料 回顾性分析2018 年9 月至2020年6月就诊于北京大学人民医院,应用心腔内超声导管(Soundstar®;Biosense Webster,Diamond Bar,CA,USA)指导下的零射线或极低射线房颤消融患者103例。所有患者均签署知情同意书,并且按照美国心律学会2017年《心房颤动导管及外科消融专家共识》中房颤消融适应证的定义,所有患者均符合I类或IIa类指证[5]。患者的基本资料、房颤类型、手术相关情况及结果均记录及分析。所有患者均应用强生三维系统(Carto®;Biosense Webster,Diamond Bar,CA,USA)行标测、建模、消融手术。
1.2 应用心腔内超声指导房颤消融手术步骤 血栓筛查:①既往脑梗死病史、CHA2DS2-VAS 评分≥3,持续性房颤患者,具备以上任意一条均在术前行食管超声检查。②阵发性房颤、CHA2DS2-VAS评分<3分,术前抗凝3周以上,术中应用心腔内超声导管进行血栓筛查(图1)。③阵发性房颤、患者不耐受或拒绝食管超声检查,应用心腔内超声导管进行血栓筛查。
手术步骤:①局部麻醉,消毒,右侧股静脉穿刺首先放置超声导管,如图1所示导管到达右房后进行快速的右房、左房及关键解剖位置标记(三尖瓣环、冠状窦口位置、上腔静脉、房间隔等)。血栓筛查:右房左心耳短轴切面筛查(图1-A)、超声导管跨三尖瓣进入流出道及肺动脉瓣上长轴切面筛查(图1-B、C、D)。如有血栓终止手术。②穿左侧锁骨下静脉放置十极冠状窦电极导管。穿刺左侧锁骨下静脉后应用超声扇面确认钢丝进入静脉系统,植入鞘管。右侧股静脉穿刺大头导管(Themo Cool Smart Touch,Biosense Webster,Diamond Bar,CA,USA)进行简单右房建模及矩阵建立。矩阵建立的前提下,可以完成零射线十极冠状窦电极导管放置(图2)。③超声指导下双鞘房间隔穿刺(右侧股静脉及左侧静脉入路),如图3所示超声扇面指导下全程可视,房间隔穿刺。④房间隔穿刺成功后放置大头导管及磁电双定位星形标测导管(PentaRay NAV eco High-Density Mapping Catheter,Biosense Webster,Diamond Bar,CA,USA),应用磁电双定位星形标测导管进行左房模型的补建。⑤在压力导管及消融指数(AI:ablation index)的指导下进行房颤消融,消融功率35~45W,盐水灌注15ml/min(前壁AI值在450~550,后壁AI值在350~450)。⑥主要术式:所有患者行肺静脉隔离并起搏验证,阵发性房颤仅行肺静脉隔离,术前合并心房扑动(简称房扑)则消融三尖瓣峡部。持续性房颤,肺静脉隔离后左房基质标测,行顶部线消融或根据左房基质行基质改良的线性消融(图4)。
1.3 手术成功、复发定义及研究目的 按照美国心律学会2017年《心房颤动导管及外科消融专家共识》中的定义,房颤导管消融3个月定义为空白期。导管消融复发定义为3个月空白期后发作30 s以上的房颤、房扑或房性心动过速(简称房速)。一年成功率定义为3个月空白期后未发现30 s以上的房颤、房扑或房性心动过速。
主要研究终点:应用心腔内超声指导下的零射线或极低射线量房颤消融手术安全性、有效性,围手术期严重并发症发生率,长期随访手术成功率。
1.4 术后随访 所有患者消融后抗凝(华法林或新型抗凝药物)及抗心律失常药物继续应用3个月,3个月后抗凝药物是否停用根据患者CHA2DS2-VAS评分及卒中风险进行评估。术后1、3以及6个月行门诊或电话随访,随访内容包括症状、心电图、动态心电图及超声心动图。
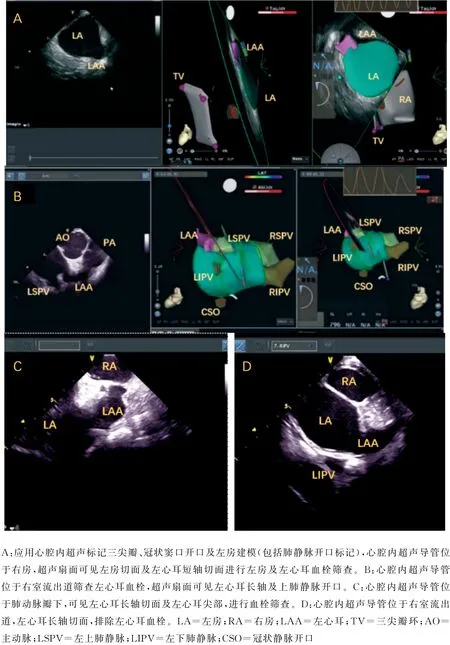
图1 心腔内超声快速建模及血栓筛查
1.5 统计学分析 采用SPSSl7.0统计软件进行数据分析。连续性变量用均数士标准差对计量资料进行描述,用例数(%)对计数资料进行描述。
2 结果
2.1 基线资料 本研究共入选应用超声导管行房颤消融患者103例(表1),行二次消融手术患者5(4.9%)例,4例为房颤后房扑患者。
2.2 零射线或极低射线房颤消融围手术期情况 手术情况如表2 所示。术前行食管超声检查患者31例(30.1%),3例(0.29%)发现左房血栓,后在抗凝后4周复查血栓消失,排除血栓后行消融治疗。心腔内超声筛查71例(68.9%),其中1例发现左心耳血栓,终止手术,后该例患者未再行介入治疗。入选103例房颤患者,共行102例心腔内超声指导下的房颤手术,1例行房颤消融加左心耳封堵一站式手术。
所有患者均在心腔内超声指导下行两次房间隔穿刺(图3),81例(79.4%)患者完成心腔内超声指导下全零射线下的房间隔穿刺及房颤消融手术。21例(20.1%)患者由于静脉迂曲或者房间隔穿刺困难,需要应用X 线。
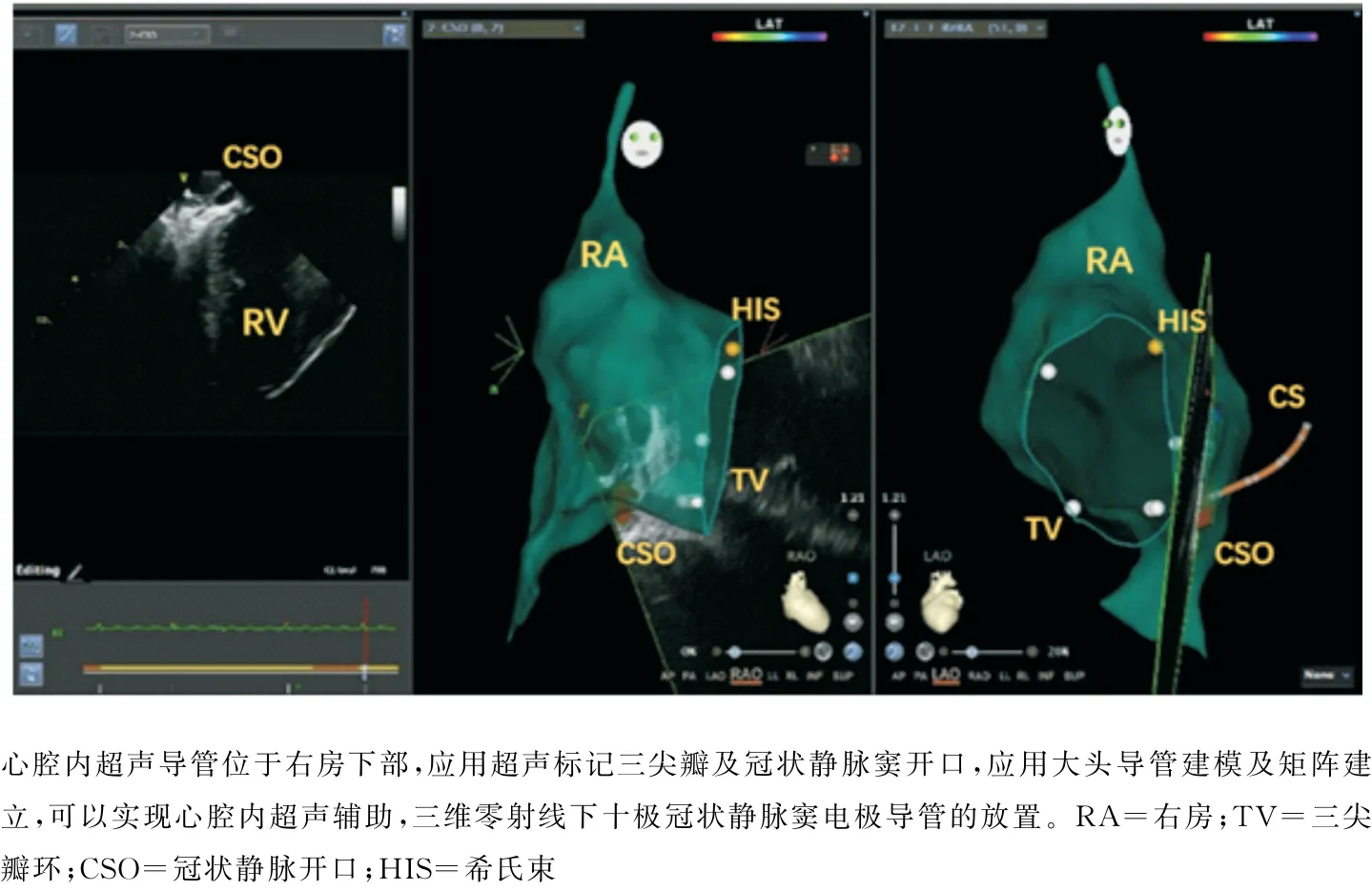
图2 右房建模及冠状窦电极导管放置
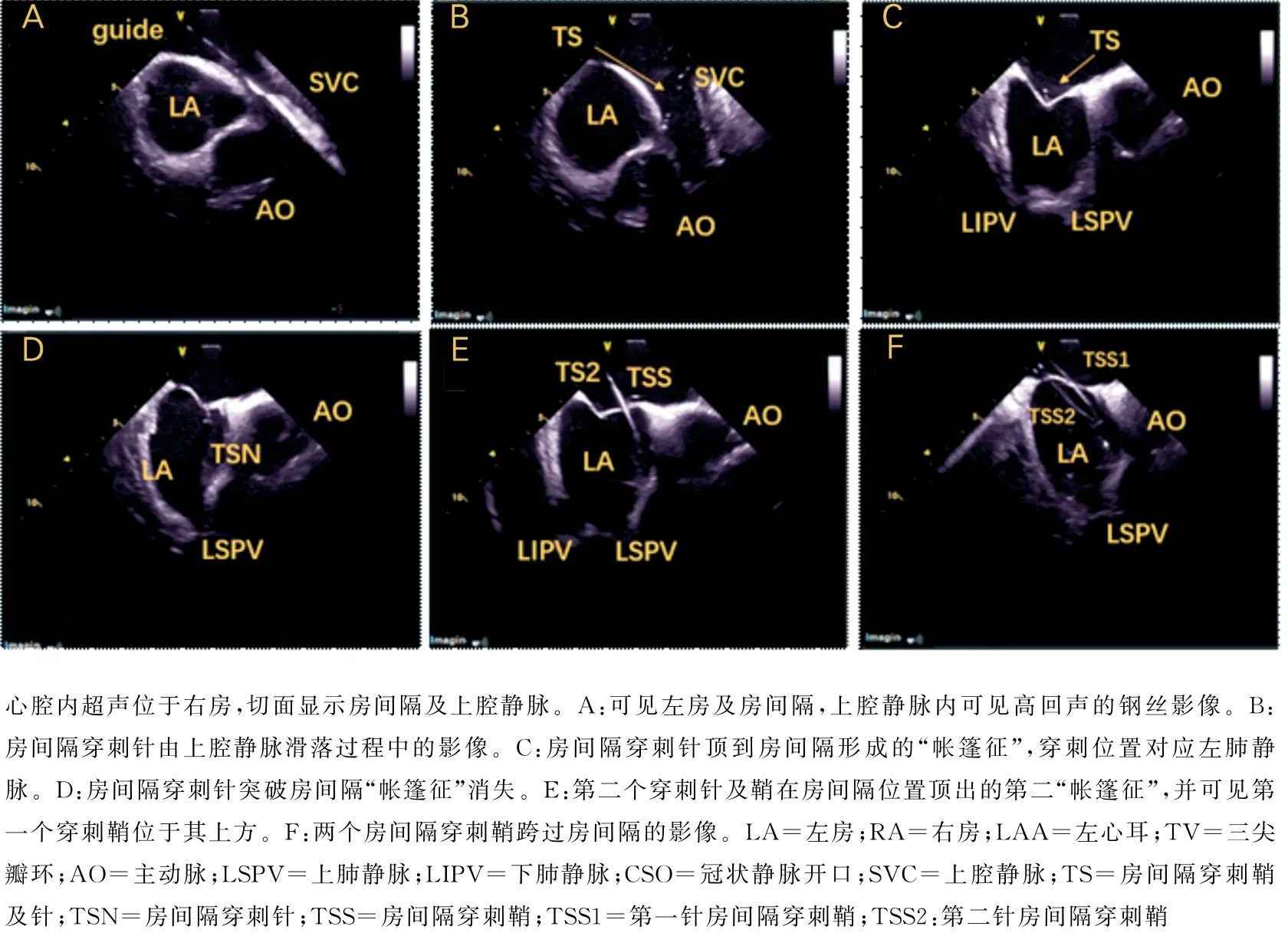
图3 心腔内超声全程可视下双鞘房间隔穿刺
102例行房颤消融患者,1例(0.98%)心腔内超声发现心包积液,给予心包穿刺引流后患者好转。术中术后3例(2.9%)出现静脉出血,1例(0.98%)出现言语不利,2例(2.0%)出现发热,无严重并发症发生。
2.3 病例随访 102例患者均完成门诊或电话随访。随访时间[7.3±4.5(0.5~20)]个月。
3个月空白期内心电图或动态心电图发现30 s以上房速、房扑或房颤患者8例(7.8%),其中6例药物治疗转复,2例电复律治疗。非空白期发生30 s以上房速、房扑或房颤患者9例(8.8%),2例房颤后房扑行二次房颤消融手术,1例电复律后药物治疗,6例药物治疗。
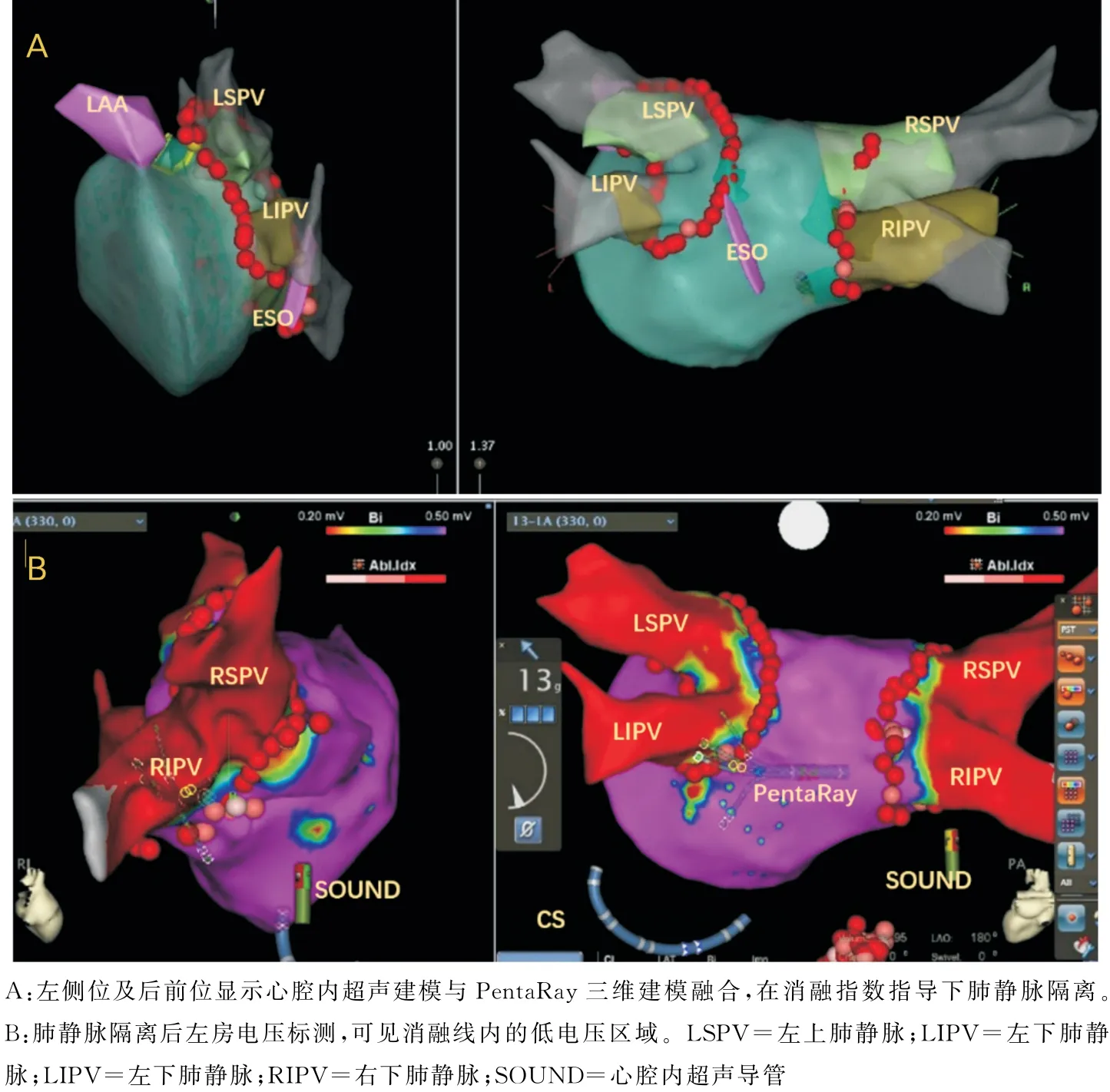
图4 左房模型及消融
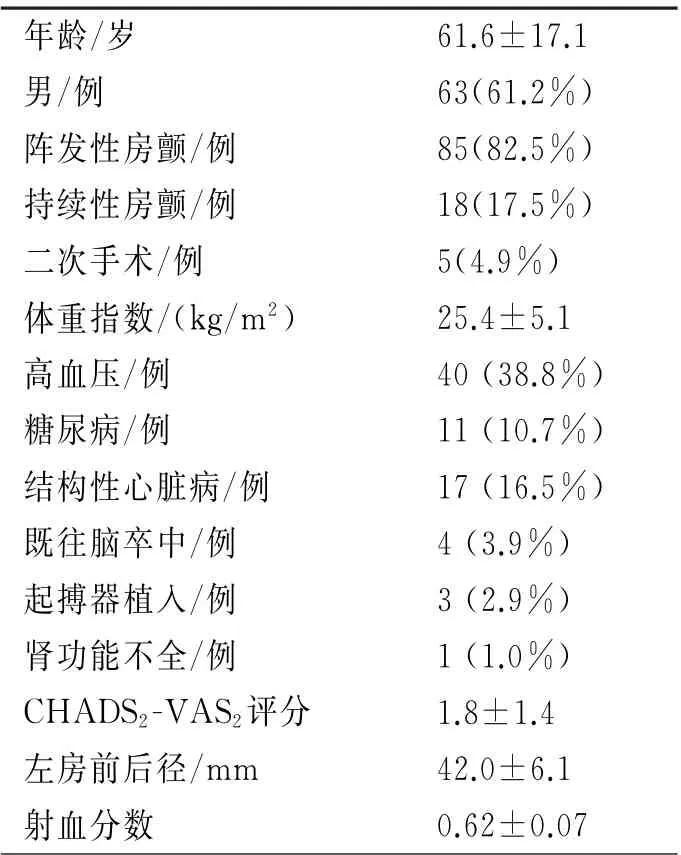
表1 患者基线资料(n=103)
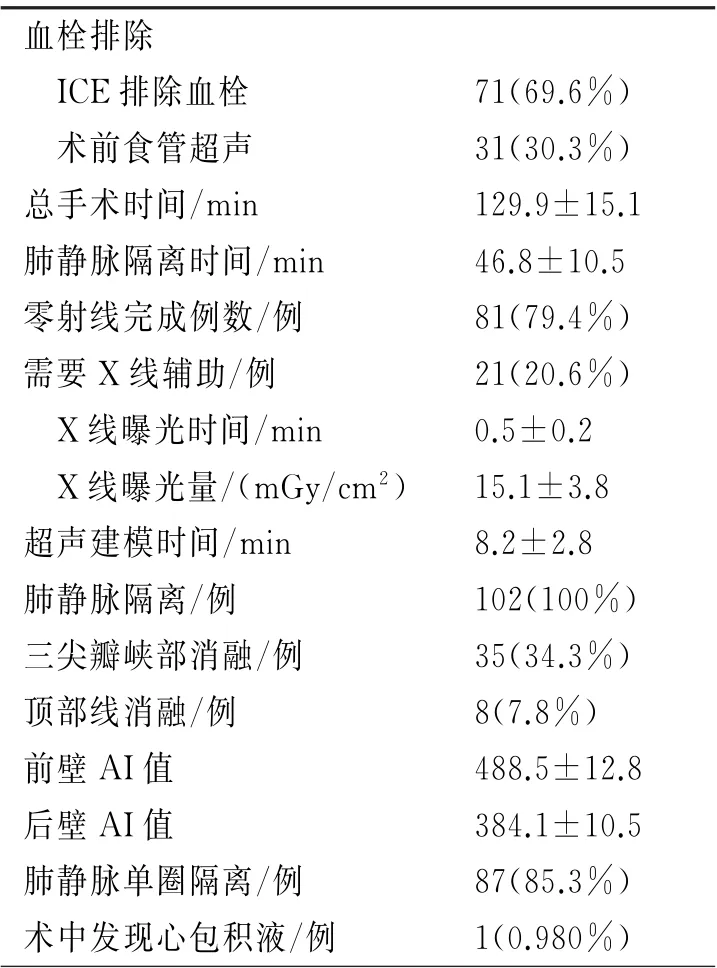
表2 手术相关情况(n=102*)
阵发性房颤患者85 例,非空白期内发生30 s以上房颤/房扑/房速患者5例(5.9%),阵发性房颤随访手术成功率为94.1%。阵发性房颤空白期内发生30 s以上房颤、房扑、房速患者9例(10.6%)。
持续性房颤患者17例,2例(11.8%)空白期内出现房颤后房扑给予电复律及药物维持。3例(17.6%)非空白期内出现房颤。持续性房颤随访手术成功率为14/17例(82.3%)。
3 讨论
本研究是国内首次报道大样本量心腔内超声指导房颤消融的单中心经验。本研究回顾性分析了北京大学人民医院103例心腔内超声指导下零射线或极低射线量房颤消融手术,其中阵发性房颤85 例(82.5%),1例持续性房颤术中心腔内超声发现血栓。所有患者均行两次房间隔穿刺,急性期肺静脉隔离率100%,无严重并发症发生。79.4%患者完成心腔内超声指导下全零射线下的房间隔穿刺及房颤消融手术。平均随访(7.3±4.5)个月,阵发性房颤手术成功率为94.1%(80/85例),持续性房颤手术成功率为82.3%(14/17例)。该研究显示,心腔内超声指导下房颤消融安全有效,减少X 线曝光量的同时并未降低手术的成功率。
3.1 应用心腔内超声排除左房血栓的探索 房颤射频消融前需要排除心耳血栓,通常需要食管超声检查,但食管超声检查相对比较痛苦,另外食管疾病患者检查受限。心腔内超声的出现是否可以替代食管超声,部分研究结果给出了肯定的答案[6]。2014年一项来自美国的随机双盲对照研究[7]显示心腔内超声可以清楚地排除右心耳及左心耳的血栓,该研究入选71例房颤患者,心腔内超声发现4例血栓,而对照组食管超声仅发现一例血栓。Baran等[8]研究发现,心腔内超声排除左房血栓安全有效,右室流出道及肺动脉瓣上的位置可以更清晰地查看左心耳血栓。本研究69.6%患者行心腔内超声筛查左房血栓,超声切面同文献报道一致,为右房短轴切面,右室流出道/肺动脉瓣上长轴切面(图1),1例持续性房颤(该例患者术前抗凝达标3周)术中发现左心耳血栓,终止手术。消融术后1例发生言语不利,后对症治疗好转,且该例患者术前食管超声筛查,术中再次心腔内超声检查后左心耳无血栓。
虽然文献报道了心腔内超声应用筛查血栓的安全性及有效性,但对于初学者或者操作例数较少的术者排除左心耳血栓还需要积累一定的经验。本研究入选心腔内超声筛查血栓患者,均为阵发性房颤、CHA2DS2-VAS评分低,术前抗凝3 周以上的患者,并且术中多角度及切面进行筛查。
3.2 心腔内超声指导下双鞘房间隔穿刺及冠状窦电极导管放置 本研究所有房颤患者均在心腔内超声指导下行两次房间隔穿刺,保证肺静脉隔离成功率。由于超声伪影及超声扇面的学习曲线等因素,两次房间隔穿刺是手术的难点及要点。Reddy等[9]研究报道了20例阵发性房颤,零射线下超声引导单次房间隔穿刺及房颤消融安全有效。Ferguson等[10]研究报道了21例房颤患者,心腔内超声指导下零射线两次房间隔穿刺及消融,安全有效。在另一项无射线心腔内超声指导房颤与有射线房颤消融的大样本研究中,同样采用了双穿房间隔的策略,证实该方法安全有效[11]。在超声扇面稳定的情况下,完全可以完成全程直视下的穿刺针及穿刺鞘管的追踪,安全有效地完成房间隔穿刺,并且避免造影剂的应用。双房间隔穿刺,可以观察到肺静脉电位的延迟及消失,保证肺静脉隔离率。
术中应用心腔内超声指导十极冠状静脉电极导管放置,在模型建立之初,首先应当标记右房关键位置,比如三尖瓣环、冠状静脉窦的开口及走行。右房模型建立后才能在三维图像中显示十极电极导线的实时位置(图2)。本研究的102例手术患者均安全地应用上述方法完成了十极冠状静脉电极的放置,仅2例由于右房增大需要借助X 线影像。
3.3 心腔内超声指导下零射线或极低剂量射线房颤消融新术式的探索 肺静脉隔离是房颤消融手术的基石。如何能精确定位肺静脉前庭是手术的关键步骤,定位不准确会增加手术的风险,例如肺静脉内消融会导致肺静脉狭窄的发生率大大增加[12]。部分研究应用CT 及核磁共振与三维模型融合技术来定位肺静脉开口,但融合技术也并不完美,而且CT检查要让患者暴露在大剂量X 射线下。本研究采用心腔内超声三维建模及PentaRay(磁电双定位星形标测导管)三维建模标测相结合的技术(图4),保证了肺静脉建模、解剖、电学定位的准确性。
3.4 心腔内超声指导下房颤消融的安全性及有效性 Friedman等[13]研究发现,房颤消融过程中未使用心腔内超声是术中出现心包积液主要危险因素之一。因此,在房颤射频消融手术应用心腔内超声指导是非常有必要的。目前已经有多项研究表明心腔内超声指导下的零射线消融手术安全有效。最近一项研究[14]发现,心腔内超声零射线房颤消融组,与应用X 线消融组相比,两组手术时间、成功率相似,心腔内超声组未出现严重并发症。另一项多中心腔内超声指导下房颤消融研究显示,零射线心腔内超声指导下的消融治疗并未延长手术时间,也并未影响远期的手术成功率。一项关于消融指数的研究入选130 例阵发性房颤患者,手术平均时间为(155±28)min,12个月随访单次手术成功率为91.3%[15]。本研究入选102例心腔内超声指导下的房颤消融,总手术时间(129.9±15.1)min,肺静脉隔离时间(46.8±10.5)min,与上述研究相似,表明心腔内超声并未增加手术的时间。
本研究共102例手术患者,其中79.4%患者完成心腔内超声指导下全零射线下的房间隔穿刺及房颤消融手术。20.6%患者需要X 线的辅助,平均X线曝光时间(0.5±0.2)min,平均X 线曝光量(15.1±3.8)mGy/cm2。由于学习曲线问题、静脉狭窄迂曲、房间隔穿刺困难等原因,早期应用心腔内超声需要X 线辅助。另外,左心耳血栓筛查需要心腔内超声导管进入右室流出道甚至肺动脉瓣上,早期应用操作不熟练,通常需要X 线的指引下安全进入理想位置。21例要X 线手术的患者,早期(前30例)手术占比17/21(81.0%),也表明心腔内超声应用之初,需要结合X 线应用保证手术安全,后期学习曲线完善后X 线应用比例明显减少。笔者认为不能一味追求零射线,应当在保证手术安全的情况尽量减少X 线的应用。
本研究所有患者行心腔内超声指导下房颤消融,肺静脉隔离率100%,应用AI消融单圈隔离率85.3%,手术过程中无一例出现严重并发症,仅一例出现心包积液,心包穿刺引流后好转。平均随访(7.3±4.5)个月,阵发性房颤临床成功率约为94.1%,持续性房颤临床成功率为82.3%。上述数据与文献报道基本一致,表明心腔内超声指导下的房颤消融安全有效。
本研究主要术式国内领先,心腔内超声三维建模,双鞘管房间隔穿刺,AI指导下的房颤消融,术中心腔内超声实时监测心包。上述技术的应用保证了手术的成功率及安全性。
4 研究的局限性
本研究为回顾性分析,房颤消融安全性及有效性可能会受到不同术者经验的影响。另外本研究持续性房颤患者比例相对较少。

