基于BMP/Runx2/Osx信号通路研究淫羊藿总黄酮改善绝经后骨质疏松模型大鼠的作用机制
徐众华 莫雨晴 周驰


摘 要 目的:基于骨形态发生蛋白(BMP)/Runt相关转录因子2(Runx2)/成骨细胞特异性转录因子(Osx)信号通路研究淫羊藿总黄酮对绝经后骨质疏松(PMOP)模型大鼠的影响,从而明确其防治骨质疏松症(OP)的作用机制。方法:将50只大鼠按体质量分层法随机分为假手术组,模型组,淫羊藿总黄酮低、高剂量组[265、530 mg/(kg·d)]和雌二醇组[0.09 mg/(kg·d)],每组10只。除假手术组大鼠行假手术外,其余各组大鼠均采用卵巢摘除去势法建立PMOP模型。大鼠造模成功并进行正常饲养2个月后开始灌胃给药,每天给药1次,连续给药84 d;假手术组和模型组大鼠灌胃等量生理盐水。末次给药结束后,测定各组大鼠右侧下肢股骨和椎骨的骨密度(BMD)以及股骨骨小梁数量(Tb.N)、骨小梁厚度(Tb.Th)、骨小梁分离度(Tb.Sp);采用酶联免疫吸附法测定大鼠血清中钙离子、骨钙素、Ⅰ型原胶原N端前肽(P1NP)的水平;采用苏木精-伊红染色法观察股骨的病理学变化;分别采用实时荧光定量-聚合酶链式反应法和Western blotting法检测大鼠骨组织中BMP、Runx2、Osx的mRNA及蛋白的表达水平。結果:与假手术组比较,模型组大鼠股骨、椎骨BMD,血清中钙离子、骨钙素、P1NP水平,股骨Tb.N和Tb.Th以及股骨组织中 BMP、Runx2、Osx mRNA及蛋白表达水平均显著降低(P<0.01),股骨Tb.Sp显著升高(P<0.01);骨小梁组织结构紊乱,断裂明显。与模型组比较,各给药组大鼠上述指标均显著改善(P<0.05或P<0.01),并且淫羊藿总黄酮的作用具有剂量依赖性(P<0.05);骨小梁数目增多,排列整齐,结构较为完整。结论:淫羊藿总黄酮改善OP的作用机制可能与促进BMP/Runx2/Osx信号通路活性有关。
关键词 淫羊藿总黄酮;骨质疏松症;骨形态发生蛋白;Runt相关转录因子2;成骨细胞特异性转录因子;大鼠
ABSTRACT OBJECTIVE: To study the effect of total flavonoids of Epimedium brevicornu on postmenopausal osteoporosis (PMOP) model rats based on BMP/Runx2/Osx signaling pathway so as to confirm the mechanism of preventing and treating osteoporosis (OP). METHODS: By body mass stratification, 50 rats were randomly divided into sham operation group, model group, E. brevicornu total flavonoids low-dose and high-dose groups [265, 530 mg/(kg·d)], estradiol group [0.09 mg/(kg·d)], with 10 rats in each group. Except that sham operation group underwent sham operation, PMOP model was established by ovariectomy and castration in other groups. After modeling, they were given normal diet for 2 months and then given relevant medicine intragastrically for consecutive 84 d,once a day; rats in sham operation group and model group were given equal volume of normal saline. After last medication,bone mineral density (BMD) of femur and vertebrae of the right lower limb,the number of trabecular bone (Tb.N), trabecular bone thickness (Tb.Th) and trabecular separation (Tb.Sp) of femur were determined in each group. The serum levels of Ca2+, OC and P1NP in serum were detected by ELISA. HE staining was used to observe pathological changes of femur. mRNA and protein expressions of BMP, Runx2 and OSX in bone tissue were detected by RT-PCR and Western blotting. RESULTS: Compared with sham operation group, BMD of femur and vertebrae, serum levels of Ca2 +, OC and P1NP, Tb.N and Tb.Th of femur, mRNA and protein expression of BMP, Runx2 and Osx in femur were decreased significantly in model group, while Tb.Sp of femur was increased significantly (P<0.01); the structure of trabecular bone was disordered and the fracture was obvious. Compared with model group, above indexes of rats in administration groups were improved significantly (P<0.05 or P<0.01), and the effect of E. brevicornu total flavonoids was dose-dependent (P<0.05); the number of trabecular bone increased, arranged orderly and the structure was more complete. CONCLUSIONS: E. brevicornu total flavonoids can improve OP, the mechanism of which may be associated with promoting the activity of BMP/Runx2/Osx signaling pathway.
KEYWORDS Epimedium brevicornu total flavonoids; Osteoporosis; BMP; Runx2; OSX; Rats
骨质疏松症(OP)是以骨量低下、骨组织微结构损坏,导致骨脆性增加、易发生骨折为特征的全身性骨病。随着我国人口的老龄化,OP患病率逐年增加,最新调查显示,我国40岁以上人群的OP发病率高达24.62%[1],其中绝经后骨质疏松症(PMOP)占比最大[2]。目前,西医治疗OP的基础用药有钙剂、维生素D以及雌激素等[2],但长期使用副作用较多[3-4]。
中医药在防治OP上具有独特优势,但其多成分、多靶点的作用机制复杂,尚未完全阐明。淫羊藿具有补肾、健骨等功效,临床常用于治疗肾虚、筋骨萎软等症[5]。现有研究已明确,淫羊藿抗OP的主要有效成分是以淫羊藿苷为代表的黄酮类化合物[6],其中淫羊藿总黄酮可促进骨髓间充质干细胞(BMSCs)的成骨性分化[7],并具有促进骨形成和抑制骨吸收的双重活性[8-9],但其信号转导机制尚未明确。
相关研究显示,由骨形态发生蛋白(BMP)、Runt相关转录因子2(Runx2)、成骨细胞特异性转录因子(Osx)组成的BMP/RunX2/Osx信号通路与骨形成密切相关[10-12],基于对淫羊藿的相关药理机制的研究[13],笔者推测淫羊藿总黄酮可能是通过BMP/Runx2/Osx通路防治OP。本研究通过建立PMOP大鼠模型,探索淫羊藿总黄酮对其骨组织学和BMP/Runx2/Osx信号通路的影响,从而明确淫羊藿总黄酮防治OP的作用机制。
1 材料
1.1 仪器
MK3型酶标仪(美国Bio-Rad公司);ZF-208型凝胶成像系统(上海恒勤仪器设备有限公司);PIDRed 96型聚合酶链式反应(PCR)仪(美国Thermo Fisher Scientific公司);RM2245型冰冻切片機(北京世贸远东科学仪器有限公司);EG1150型包埋机、SM2000R石蜡滑动式切片机(德国Leica 公司);BX-2型光学显微镜(日本Olympus公司);Allegra X-15R型医用离心机(美国Beckman公司);Dexa Pro-1型双能X射线骨密度仪(美国GE公司);JS-Power300型电泳仪(上海迪奥生物科技有限公司);SkyScan1272型超高分辨率microCT系统(比利时Bruker公司)。
1.2 药品与试剂
淫羊藿总黄酮(江苏康缘阳光药业有限公司,批号:20198954,纯度:>90%);戊酸雌二醇片(廊坊高博京邦制药有限公司,批号:20191125,规格:2 mg/片);血清钙离子、骨钙素、Ⅰ型原胶原N端前肽(P1NP)酶联免疫吸附(ELISA)检测试剂盒(北京百奥莱博科技有限公司,批号:ZN2797349、ZN27840113、ZN27528941);十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶试剂盒(批号:ED2036r)、羊抗鼠BMP多克隆抗体(批号:jx-2350)、羊抗鼠Runx2多克隆抗体(批号:jx-2056)、羊抗鼠Osx多克隆抗体(批号:jx-2752)、羊抗鼠甘油醛-3-磷酸脱氢酶(GAPDH)多克隆抗体(批号:jx-1379)、辣根过氧化物酶(HRP)标记羊抗鼠免疫球蛋白G(IgG)二抗(批号:jx-1943)、二喹啉甲酸(BCA)蛋白定量试剂盒(批号:ED2582r)、实时荧光定量-PCR试剂盒(批号:ED37945r)均购自广州晶欣生物科技有限公司;苏木精、伊红染液(武汉科诺生物科技有限公司);其余试剂均为分析纯或实验室常用试剂,水为蒸馏水。
1.3 动物
50只健康成年SD大鼠,SPF级,雌性,6月龄,体质量为170~210 g,由广州中医药大学实验动物中心提供[实验动物生产合格证号:SCXK(粤)2018-0034]。饲养环境温度为(22±2) ℃、相对湿度为50%。本研究通过广州中医药大学动物实验中心伦理委员会批准。
2 方法
2.1 分组、造模与给药
选取50只SD大鼠,适应性喂养1周后,按体质量分层法随机分为5组:假手术组,模型组,淫羊藿总黄酮低、高剂量组和雌二醇组,每组10只。除假手术组外,其余4组大鼠均采用卵巢摘除去势法建立PMOP模型[14],具体操作为:用10%水合氯醛将大鼠麻醉后,在其腰椎棘突旁开1 cm处,沿着皮肤和肌肉纵向剖离1.5 cm左右的深度,在脂肪团中找到双侧卵巢并切除双侧卵巢;假手术组大鼠采用同样的手术操作暴露卵巢,但不摘除。术后腹腔注射青霉素(10万单位/d),连续3 d。术后大鼠正常饲养,2个月后开始灌胃给药,每天给药1次,连续给药84 d(12周)。其中,淫羊藿总黄酮低、高剂量组大鼠的给药剂量分别为265、530 mg/(kg·d)[分别为成人(体质量以50 kg计)临床用量的1、2倍等效剂量],雌二醇组大鼠的给药剂量为0.09 mg/kg[15],假手术组和模型组大鼠均灌胃等量生理盐水,给药体积均为1 mL/100 g。
2.2 大鼠股骨、椎骨骨密度(BMD)和股骨微结构检测
末次给药结束后24 h,各组大鼠腹腔注射10%水合氯醛麻醉,将其右股骨、椎骨部位置于双能X线密度仪上检测BMD。将各组大鼠完整的股骨置于microCT系统上进行扫描,扫描完成后,通过Evaluation V6.5.3软件建模采集图像并对股骨微结构进行分析,采集骨小梁数量(Tb.N)、骨小梁厚度(Tb.Th)、骨小梁分离度(Tb.Sp)等数据。
2.3 大鼠血清中钙离子、骨钙素、P1NP水平检测
采用ELISA法进行检测。末次给药后1 h从大鼠的腹主动脉取血5 mL,放置1 h后,以3 000 r/min离心10 min,分离上层血清。分别按照ELISA试剂盒说明书操作,检测血清中钙离子 、骨钙素、P1NP水平。
2.4 大鼠股骨组织的病理学观察
采用苏木精-伊红(HE)染色法进行观察。取血后,将各组大鼠处死,取其左侧股骨,以10%甲醛固定,再用20%EDTA脱钙液进行脱钙,然后进行脱水(60 min);用二甲苯Ⅰ和Ⅱ进行透明(分别处理60 min),常规浸蜡、包埋后进行组织切片(4 ?m)。行HE染色后,在光学显微镜下观察股骨的病理学变化。
2.5 大鼠骨组织中BMP、Runx2、Osx mRNA表达情况检测
采用实时荧光定量-PCR法进行检测。取大鼠右侧股骨洗净,取部分骨片(另一部分保存于-80 ℃)。采用Trizol法提取其总RNA,确定其纯度和浓度后,将总RNA反转录合成cDNA,并以cDNA为模板进行PCR扩增。反应体系(共20 ?L):SYBR荧光染料10 μL,上、下游引物各2 μL,cDNA模板4 μL,无核酸酶水2 μL。反应条件:94 ℃预变性5 min; 95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min ,共40个循环。以GAPDH作为内参,采用2-ΔΔCt法计算各目标基因mRNA的表达水平(式中Ct表示荧光信号强度达到设定阈值时经历的循环次数)。引物由武汉擎科生物公司设计并提供,其引物序列及产物大小见表1。
2.6 大鼠骨组织中BMP、Runx2、Osx蛋白表达情况检测
采用Western blotting法进行检测。取冷冻保存的大鼠右股骨组织,每组随机取3个样本,用无菌眼科剪刀将其尽可能剪碎,置于研钵内研磨,加入裂解液使其充分裂解。裂解完毕后,以12 000 r/min离心15 min,取上清液,用BCA蛋白检测试剂盒测定蛋白浓度。蛋白经变性后,取50 ?g进行SDS-PAGE电泳(140 V),然后在300 mA下转膜1 h至聚偏二氟乙烯(PVDF)膜上;TBST缓冲液洗膜5 min×3次;将膜放入5%的脱脂奶粉中,室温条件下封闭孵育2 h;将膜取出后,用TBST 缓冲液洗膜5 min×3次;分别加入BMP、Runx2和Osx一抗 (稀释度均为1 ∶ 1 000),4 ℃孵育過夜;加入二抗(稀释度为 1 ∶ 200),室温孵育1h;以ECL试剂盒显色后,置于凝胶成像系统上成像。采用Image J v1.5.1软件进行分析,以目标蛋白条带灰度值与内参蛋白(GAPDH)条带灰度值的比值表示目标蛋白的表达水平。
2.7 统计学方法
采用SPSS 22.0统计学软件对数据进行统计分析。符合正态分布的计量资料以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验;若不符合正态分布,则采用非参数检验进行组间比较。P<0.05表示差异具有统计学意义。
3 结果
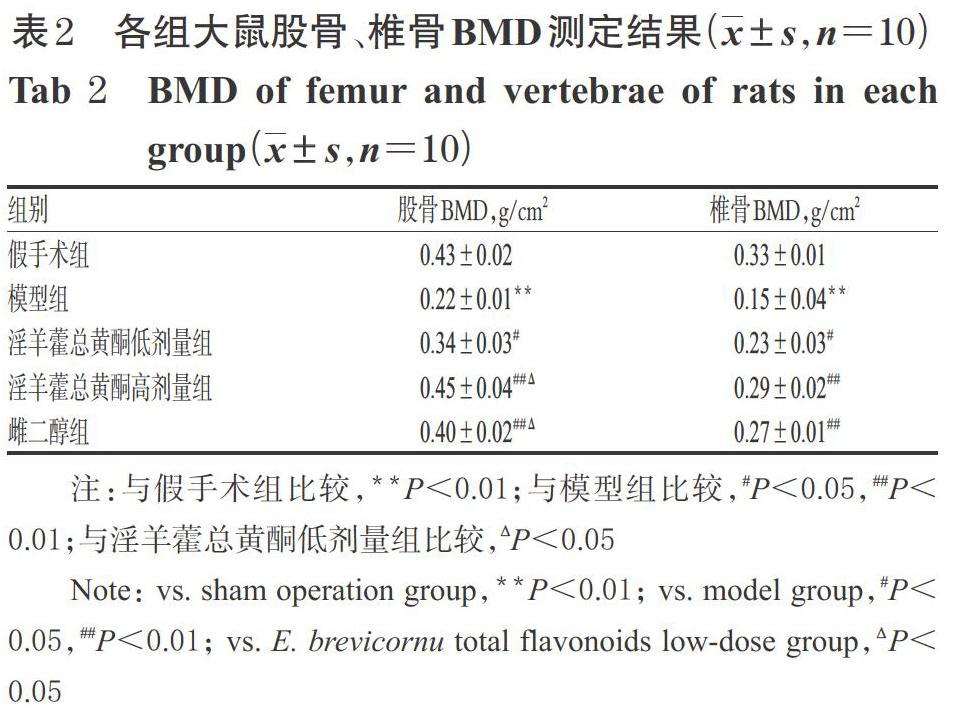
3.1 淫羊藿总黄酮对PMOP模型大鼠股骨、椎骨BMD的影响
与假手术组比较,模型组大鼠股骨、椎骨BMD显著降低(P<0.01);与模型组比较,淫羊藿总黄酮低、高剂量组和雌二醇组大鼠股骨、椎骨BMD均显著升高(P<0.05或P<0.01);与淫羊藿总黄酮低剂量组比较,淫羊藿总黄酮高剂量组和雌二醇组大鼠股骨BMD显著升高(P<0.05);与雌二醇组比较,淫羊藿总黄酮高剂量组大鼠股骨、椎骨BMD差异均无统计学意义(P>0.05)。各组大鼠股骨、椎骨BMD测定结果见表2。
3.2 淫羊藿总黄酮对PMOP模型大鼠股骨微结构的影响
与假手术组比较,模型组大鼠股骨Tb.N、Tb.Th显著降低(P<0.01),Tb.Sp显著升高(P<0.01);与模型组比较,淫羊藿总黄酮低、高剂量组和雌二醇组大鼠股骨 Tb.N、Tb.Th显著升高(P<0.05或P<0.01),Tb.Sp显著降低(P<0.05或P<0.01);与淫羊藿总黄酮低剂量组比较,淫羊藿总黄酮高剂量组和雌二醇组大鼠股骨Tb.N、Tb.Th显著升高(P<0.05),Tb.Sp显著降低(P<0.05);与雌二醇组比较,淫羊藿总黄酮高剂量组大鼠股骨Tb.N、Tb.Th显著升高(P<0.05),Tb.Sp差异无统计学意义(P>0.05)。各组大鼠股骨微结构microCT扫描图见图1,Tb.N、Tb.Th、Tb.Sp测定结果见表3。
3.3 淫羊藿总黄酮对PMOP模型大鼠血清中钙离子、骨钙素、P1NP水平的影响
与假手术组比较,模型组大鼠血清中钙离子、骨钙素、P1NP水平显著降低(P<0.01);与模型组比较,淫羊藿总黄酮低、高剂量组和雌二醇组大鼠血清中钙离子、骨钙素、P1NP水平均显著升高(P<0.05或P<0.01);与淫羊藿总黄酮低剂量组比较,淫羊藿总黄酮高剂量组和雌二醇组大鼠血清中钙离子、骨钙素、P1NP水平均显著升高(P<0.05);与雌二醇组比较,淫羊藿总黄酮高剂量组大鼠血清中P1NP水平显著升高(P<0.05),血清中钙离子、骨钙素水平差异无统计学意义(P>0.05)。各组大鼠血清中钙离子、骨钙素、P1NP水平测定结果见表4。
3.4 淫羊藿总黄酮对PMOP模型大鼠股骨组织病理学的影响
与假手术组比较,模型组大鼠骨小梁组织结构紊乱,断裂明显,骨髓腔内部空洞较多;与模型组比较,淫羊藿总黄酮低、高剂量组和雌二醇组大鼠骨小梁数目增多、排列整齐,结构较为完整,其中以淫羊藿总黄酮高剂量组和雌二醇组改善较为明显。各组大鼠股骨组织病理学观察显微图见图2。
3.5 淫羊藿总黄酮对PMOP大鼠骨组织中BMP、Runx2、Osx mRNA表达的影响
与假手术组比较,模型组大鼠骨组织中BMP、Runx2、Osx mRNA的表达水平显著降低(P<0.01);与模型组比较,淫羊藿总黄酮低、高剂量组和雌二醇组大鼠骨组织BMP、Runx2、Osx mRNA表达水平均显著降低(P<0.05或P<0.01);与淫羊藿总黄酮低剂量组比较,淫羊藿总黄酮高剂量组和雌二醇组大鼠骨组织中BMP、Runx2、Osx mRNA表达水平均显著升高(P<0.05);与雌二醇组比较,淫羊藿总黄酮高剂量组大鼠骨组织中Runx2、Osx mRNA表达水平均显著升高(P<0.05),但BMP mRNA表达水平差异无统计学意义(P>0.05)。各组大鼠骨组织BMP、Runx2、Osx mRNA的表达水平测定结果见表5。
3.6 淫羊藿總黄酮对PMOP模型大鼠骨组织BMP、Runx2和Osx蛋白表达的影响
与假手术组比较,模型组大鼠骨组织中BMP、Runx2、Osx蛋白表达水平均显著降低(P<0.01);与模型组比较,淫羊藿总黄酮低、高剂量组和雌二醇组大鼠骨组织中BMP、Runx2、Osx蛋白表达水平显著升高(P<0.05或P<0.01);与淫羊藿总黄酮低剂量组比较,淫羊藿总黄酮高剂量组和雌二醇组大鼠骨组织中BMP、Runx2、Osx蛋白的表达水平均上升(P<0.05);与雌二醇组比较,淫羊藿总黄酮高剂量组骨组织中BMP、Runx2、Osx蛋白表达水平差异均无统计学意义(P>0.05)。各组大鼠骨组织中BMP、Runx2、Osx的蛋白表达电泳图见图3,蛋白表达水平测定结果见表6。
4 讨论
中医虽无OP的直接记载,但据OP的病因病机及临床症状可知,其与中医学的“骨痹”“骨痿”非常相似[16]。根据中医“肾主骨”的理论,肾精盛衰是诱发OP的重要因素[17],故中医治疗多以补肾益精为主。西医治疗OP的方式主要包括给予雌二醇等骨吸收抑制剂[2],故本研究以其为阳性药对照。淫羊藿总黄酮是补肾中药淫羊藿中的一种有效成分,以其为主要成分的制剂(如淫羊藿总黄酮胶囊)在临床上已用于OP的治疗。虽然有研究表明,淫羊藿总黄酮可以促进BMSCs的表达以及骨愈合和骨吸收[18],但是具体相关药理机制尚未明确。
BMP/Runx2/Osx信号通路与骨形成密切相关,参与调控成骨细胞的分化[19-20]。BMPs属于转化生长因子 (TGF-β) 超家族,可诱导BMSCs向成软骨细胞、成骨细胞等分化,促进成骨细胞功能。其中,BMP能通过与细胞膜表面的异二聚体受体特异性结合,调节Runx2及其下游Osx基因的转录和表达[21]。作为特异性成骨细胞转录因子和成骨细胞分化的关键调节因子,Runx2通过结合成骨细胞特异性顺式作用元件(OSE),激活骨桥素、骨钙蛋白、骨涎蛋白和Ⅰ型胶原基因等多种成骨细胞增殖、分化特异性标志物的转录和表达,促进膜内和软骨内骨化成骨[22]。而Osx属于锌指蛋白,是Runx2的下游关键性转录因子,通过调控许多成骨细胞重要晚期表型和功能蛋白的表达,促进BMSCs的成骨转化[23-26]。而在骨组织构建过程中,骨质的形成和吸收是同时发生的,骨构建过程处于失衡状态时,骨吸收显著高于骨形成,进而导致OP[27]。有细胞试验证实,BMP/Runx2/Osx信号通路参与了淫羊藿总黄酮促BMSCs定向成骨分化的进程,淫羊藿总黄酮能明显上调BMP-2的转录和表达[10]。
本研究结果显示,淫羊藿总黄酮可以升高PMOP模型大鼠股骨BMD、血清钙离子,股骨Tb.N和Tb.Th,降低股骨Tb.Sp,增多且增宽骨小梁,上调骨组织中BMP、Runx2、Osx的mRNA及其蛋白的表达。以上结果提示,淫羊藿总黄酮可以通过对BMP/Runx2/Osx信号通路的调控,从而升高骨骼BMD,增加骨形成,减少钙丢失以及改善骨小梁形态排列,从而降低或延缓OP的发生发展。
综上所述,淫羊藿总黄酮可通过上调股骨中BMP、Runx2、Osx的mRNA和蛋白表达,增加BMD和骨小梁的数量,改善股骨微结构,提高血清中钙离子、骨钙、P1NP的水平,从而修复骨构建失衡,起到防治OP的作用。但由于中药对机体或者细胞具有多途径、多靶点作用的特点,BMP/Runx2/Osx信号通路未必是淫羊藿总黄酮防治OP的唯一途径,此过程中还可能有其他信号转导通路的参与,故其具体的分子机制仍需进一步深入研究。
参考文献
[ 1 ] 张智海,张智若,刘忠厚,等.中国大陆地区以-2.0SD为诊断标准的骨质疏松症发病率文献回顾性研究[J].中国骨质疏松杂志,2016,22(1):1-8.
[ 2 ] 中华中医药学会.绝经后骨质疏松症(骨痿)中医药诊疗指南:2019年版[J].中医正骨,2020,32(2):1-13.
[ 3 ] 吴继云,陈伟南,蒋春华.仙灵骨葆胶囊对老年大鼠骨质疏松性骨折愈合过程 PDGF、TGF-β和VEGF表达的影响[J].贵州医科大学学报,2019,11( 5):541-546.
[ 4 ] WAJANVISI W,SUPPACHOKMONGKORN S,WORA- TANAAT P,et al. The association of bone mineral density and G2014A polymorphism in the estrogen receptor alpha gene in osteoporotic hip fracture in Thai population[J]. J Med Assoc Thai,2015,98( 8):82-87.
[ 5 ] 陈克明.淫羊藿总黄酮的抗骨质疏松作用机制[J].中华中医药杂志,2017,32(12):5485-5489.
[ 6 ] MING LG,XIAN CJ,CHEN KM,et al. Function and action mechanism of flavoidsgenistein and icariin in regula- ting bone remodeling[J]. J Cell Physiol,2013,228(3):513-521.
[ 7 ] 葸慧荣,马慧萍,高玉海,等.淫羊藿苷是一种植物雌激素吗?[J].中华骨质疏松和骨矿盐疾病杂志,2016,9(4):421-427.
[ 8 ] MA HP,MING LG,GE BF,et al. Icariin is more potent than genistein in promoting osteoblast differentiation and mineralization in vitro[J]. J Cellular Biochemistry,2015,112(3):916-923.
[ 9 ] 孟宁,孔凯,李时翁,等.淫羊藿属植物化学成分及药理活性研究进展[J].西北植物学报,2010,30(5):209-219.
[10] 梁广胜,陈伟才,殷嫦嫦,等.淫羊藿总黄酮对大鼠骨髓间充质干细胞成骨分化过程BMP-2/RunX2/Osx通路的影响[J].中国中西医结合杂志,2016,36(5):614-618.
[11] 乔虎军,王国祥,郝鑫,等.转化生长因子β/Smad信号通路和骨关节炎研究进展[J].中国运动医学杂志,2019,38(2):143-151.
[12] 余翔,姜自伟,郑晓辉,等.补肾中药调控BMP-Smad信号通路促进牵张成骨的研究进展[J].辽宁中医杂志,2017,44(9):1991-1994.
[13] 王宥涵,孔令擘,贺宝荣.淫羊藿苷调控破骨细胞分化治疗骨质疏松症的机制研究进展[J].中华创伤杂志,2020,36(4):377-382.
[14] 巢传琦,蔡君,吕俊华.补骨方对去卵巢大鼠骨质疏松的防治作用研究[J].中药材,2015,38(4):807-809.
[15] 颜春鲁,王琳,安方玉,等.地黄饮子水煎剂对去势骨质疏松大鼠生物力学及OPG/RANKL/RANK含量的影响[J].中华中医药杂志,2018,33(10):4642-4645.
[16] 谭英华,杨茂伟.补脾益肾方药治疗老年性骨质疏松症30例[J].中国中医药现代远程教育,2016,14(3):85-86.
[17] LIU T,GAO Y,SAKAMOTO K,et al. BMP-2 promotes differentiation of osteoblasts and chondroblasts in Runx2-deficient cell lines[J]. J Cell Physiol,2007,211(3):728-735.
[18] 李烨,童杰,周衍晶,等.补肾壮骨中药抗骨质疏松有效成分及其药理作用研究进展[J].中国中药杂志,2015,40(6):1038-1043.
[19] 任格,聂利,杨霞,等. Smad信号通路在骨形成蛋白9 促进牙囊干细胞成骨向分化中的研究[J].第三军医大学学报,2018,40(12):1066-1072.
[20] 吉彩霞,刘晓骅,徐丽,等. Runx1促进BMP9诱导的间充质干细胞MEFs的成骨分化[J].中国生物工程杂志,2017,37(3):10-17.
[21] 徐练,孔清泉.调控成骨细胞分化及骨形成关键信号通路的研究进展[J].中国修复重建外科杂志,2014,28(12):1484-1489.
[22] 高璐.补肾复方对绝经后骨质疏松症大鼠BMP2/RUNX2/ MEK1相关信号网络的调控作用[D].沈阳:遼宁中医药大学,2014.
[23] NEUSS S,SCHNEIDER RK,TIETZE L,et al. Secretion of fibrinolytic enzymes facilitates human mesenchymal stem cell invasion into fibrin clots[J]. Cells Tissues Organs,2010,191(1):36-46.
[24] LIU H,XUE W,GE G,et al. Hypoxic preconditioning advances CXCR4 and CXCR7 expression by activating HIF-1α in MSCs[J]. Biochem Biophys Res Commun,2010,401(4):509-515.
[25] 訾慧,郑洪新,蒋宁,等.淫羊藿素通过BMP/Runx2/Osx信号通路促进大鼠骨髓间充质干细胞成骨分化研究[J].中华中医药学刊,2020,38(7):212-215、270.
[26] NAKASHIMA K,DE CROMBRUGGHE B. Transcriptional mechanisms inosteoblast differentiation and bone formation[J]. Trends Genet,2003,19(8):458-466.
[27] 严伟,王中汉,刘贺.骨重建失衡导致骨质疏松发生的作用机制及其药物治疗策略[J].中国组织工程研究,2020,24(30):4866-4874.
(收稿日期:2020-07-29 修回日期:2020-08-30)
(编辑:林 静)

