甘草次酸修饰多西紫杉醇磁性纳米粒的制备与表征
王莎莎 陈家琦 王华华 黄胜楠 贾永艳 祝侠丽

摘 要 目的:制备甘草次酸修饰多西紫杉醇磁性纳米粒(GA-DTX-NGO/IONP-NPs),并对其理化性质进行评价。方法:以磁性纳米氧化石墨烯(NGO/IONP)作为抗肿瘤药物载体,多西紫杉醇(DTX)为模型药物,甘草次酸(GA)为靶头分子。采用水热法合成NGO/IONP、酰胺化反应合成GA修饰的壳聚糖(GA-CS)后,采用傅里葉红外光谱法、差示扫描量热法及振动样品磁测量法等对两者进行表征。采用离子凝胶化法制备GA-DTX-NGO/IONP-NPs;采用透射电镜、纳米粒度分析仪等对其微观形态、粒径及Zeta电位进行观察和测定;采用超滤离心法测定其包封率和载药量;通过观察有无外加磁场时的状态考察其磁性;结合808 nm激光对其进行光热转换试验。结果:成功合成了NGO/IONP和GA-CS,且NGO/IONP呈现超顺磁性。GA-DTX-NGO/IONP-NPs在透射电镜下呈圆球状,粒径为(262.8±4.23) nm,Zeta电位为(13.6±1.51) mV,包封率为(94.29±0.50)%,载药量为(17.12±0.12)%。GA-DTX-NGO/IONP-NPs的外观呈黑色,分散均匀;其在外加磁场下磁性纳米粒可定向移动,显示出良好的磁定向性。在808 nm激光照射下,GA-DTX-NGO/IONP-NPs具有良好的光热转换效应,且呈浓度和时间依赖趋势。结论:本研究成功制备了一种磁性纳米载药系统GA-DTX-NGO/IONP-NPs,可为肿瘤的磁热-化疗联合治疗提供一定的理论依据。
关键词 磁性纳米氧化石墨烯;甘草次酸;多西紫杉醇;磁性纳米粒
ABSTRACT OBJECTIVE: To prepare Glycyrrhetinic acid-modified docetaxel magnetic nanoparticles (GA-DTX-NGO/IONP- NPs), and to evaluate its physicochemical properties. METHODS: Magnetic nano graphene oxide (NGO/IONP) was chosen as the anti-tumor drug carrier, docetaxel (DTX) as the model drug and glycyrrhetinic acid (GA) as the target molecule. Firstly, NGO/IONP was synthesized by hydrothermal method and GA-CS was synthesized by amidation reaction. Fourier IR spectrometer, DSC and vibration sample magnetic measuring instrument were used to characterize NGO/IONP and GA-CS. GA-DTX-NGO/IONP-NPs were prepared by the ion gelation method. TEM and particle size analyzer were used to observe and determine the morphology, particle size and Zeta potential of GA-DTX-NGO/IONP-NPs; the ultrafiltration-centrifugation method was used to determine encapsulation efficiency and drug loading amount; the magnetic properties were investigated by investigating the state with or without external magnetic field; the photothermal conversion test was carried out with laser irradiation of 808 nm. RESULTS: NGO/IONP and GA-CS were successfully synthesized, and NGO/IONP exhibited superparamagnetism characteristics. GA-DTX-NGO/IONP-NPs were spherical under TEM, the particle size was (262.8±4.23) nm and the Zeta potential was (13.6±1.51) mV. The encapsulation rate and drug loading amount were (94.29±0.50)% and (17.12±0.12)%, respectively. GA-DTX-NGO/IONP-NPs were black in appearance and evenly dispersed. Under the external magnetic field, the magnetic nanoparticles could move directionally, showing good magnetic properties. GA-DTX-NGO/IONP-NPs showed a good concentration- and time-dependent photothermal conversion effect under 808 nm laser irradiation. CONCLUSIONS: GA-DTX-NGO/IONP-NPs are successfully prepared. This study could provide some theoretical basis for the combined treatment of magnetic heating-chemotherapy for liver tumors.
KEYWORDS Magnetic nano graphene oxide; Glycyrrhetinic acid; Docetaxel; Magnetic nanoparticles
肝癌是危害人类健康的重大疾病之一 [1-2]。近年来,一种通过磁性纳米粒子(Magnetic nanoparticles,MNPS)發挥作用的磁热疗法(Magnetic hyperthermia therapy,MHT)受到众多研究学者的关注[3]。MHT通过磁滞机制或交变磁场可以诱导MNPS 在肿瘤病灶部位产热,使局部升温至42~46 ℃,但不损伤周围正常组织[4-5]。纳米氧化石墨烯(Nano graphene oxide,NGO)因独特的二维平面结构使其具有载药量高、生物相容性好及稳定性强的优点[6-7]。在各种功能化的NGO中,经过磁性材料修饰后的NGO即磁性纳米氧化石墨烯(NGO/IONP)已作为磁热疗法的药物载体受到了相应研究[8-9]。
多西紫杉醇(Docetaxel,DTX)属于紫杉烷类抗肿瘤药物,具有较为广泛的抗瘤作用,但其本身水溶性差、毒性大、缺乏肿瘤靶向性[10-11]。甘草次酸(Glycyrrhetinic acid,GA)是传统中药甘草中天然产物甘草酸的三萜苷元成分[12-13]。研究发现,GA具有良好的肝靶向性[14]。鉴于此,本研究以DTX为模型药物,GA修饰的壳聚糖(GA-CS)为主要载体材料,采用离子凝胶化法制备一种同时包裹NGO/IONP、DTX的磁性纳米粒(GA-DTX- NGO/IONP-NPs),并对其进行表征,为肝肿瘤的磁热-化疗联合治疗提供参考。
1 材料
1.1 仪器
METTLERAE240型十万分之一天平、DSC 1 STARE型差式扫描量热(DSC)仪(德国Mettler-Toledo公司);Nano-ZS90型电位及粒度分析仪(英国Malvern公司);FD-1A-50型冷冻干燥机(北京博医康实验仪器有限公司);Spectrum 100型傅里叶变换红外光谱(IR)仪(美国Perkin Elmer公司);JEM-1400型透射电镜(日本JEOL公司);22331 Hamburg小型台式高速冷冻离心机(德国Eppendorf公司);COS-30 A型真空干燥箱(上海施都凯仪器设备有限公司);T6型新世纪紫外-可见分光光度计(北京普析通用仪器有限责任公司);DYNACOOL型振动样品磁测量仪(美国Quantum Design公司);MW-GX-808/3000 mW型激光器(中国科学院长春激光所);KQ-500DV型数控超声波清洗器(昆山市超声仪器有限公司)。
1.2 药品与试剂
GA原料药(武汉远成共创科技有限公司,批号:405310,纯度:>98%);DTX原料药(上海瀚香生物科技有限公司,批号:C338774,纯度:>98%);纳米氧化石墨烯(南京吉仓纳米科技有限公司,批号:JC181213);N-羟基琥珀酰亚胺(NHS)、CS(上海瑞永生物科技有限公司,批号:RT19U311、RA2017L712);N,N-二甲基甲酰胺(DMF)、三聚磷酸钠(天津市致远化学试剂有限公司,批号:2010082022、2017112022);1-乙基-3-(3-二甲氨基丙基)碳二亚胺盐酸盐(EDC·HCl,上海思域化工科技有限公司,批号:HF1160624);甲醇、丙酮等其余试剂均为分析纯,水为超纯水。
2 方法与结果
2.1 NGO/IONP及GA-CS的合成
2.1.1 NGO/IONP的合成 采用水热法进行合成。称取NGO 20 mg,加入乙二醇-二乙二醇(1 ∶ 19,V/V)混合溶液20 mL,超声(功率:500 W,频率:40 kHz)30 min,再以探头超声(功率:80 W,频率:20 kHz)5 min。依次称取醋酸钠0.3 g、FeCl3·6H2O 0.108 g加入上述溶液中,搅拌溶解混匀,必要时超声(条件同上),然后放置于200 ℃油浴中搅拌反应10 h[15]。反应结束后,以5 000 r/min离心处理10 min,沉淀用无水乙醇和水多次洗涤后,冷冻干燥即得黑色固体NGO/IONP,以此为抗肿瘤药物载体。
2.1.2 GA-CS的合成 采用酰胺反应合成GA-CS。称取CS 50 mg,溶于1%醋酸溶液10 mL中,4 ℃下放置过夜,使其溶解完全。称取GA 12.5 mg溶于DMF 5 mL中,加入NHS 4.59 mg、EDC·HCl 7.65 mg后冰浴30 min,冰浴结束后将此溶液缓慢滴加到CS溶液中,室温下反应6 h,然后在80 ℃下反应48 h[16]。反应结束后,加入过量(50 mL)丙酮,沉淀6 h以纯化除杂,以3 000 r/min离心5 min后弃去上清,沉淀依次用乙醇、乙醚洗涤后,真空干燥即得淡黄色固体GA-CS。
2.2 NGO/IONP及GA-CS的表征
2.2.1 IR表征 分别将NGO、NGO/IONP以及CS、GA、GA-CS与溴化钾混合后(1 ∶ 100,m/m),压片,采用IR法对上述物质结构进行表征,结果见图1、图2。
由图1可见,与NGO的IR谱图相比,NGO/IONP除了具有NGO的特征峰外,在575 cm-1处出现了Fe—O伸缩峰,提示NGO/IONP成功合成。
由图2可见,在CS的IR谱图中,2 878 cm-1处出现ν(CH2基)伸缩振动吸收峰,1 655 cm-1处出现的弱吸收峰为未完全脱乙酰度ν(NHCOCH3)的酰胺吸收峰,1 596 cm-1处出现的为ν(NH2基)弯曲振动吸收峰。在GA的IR谱图中,2 947 cm-1处出现的为ν(CH2基)伸缩振动吸收峰。在GA-CS 的IR谱图中,出现在GA图谱中2 934 cm-1和CS图谱中2 881 cm-1处出现的ν(CH2基)伸缩振动吸收峰,1 662 cm-1处酰胺ν(C=O)峰明显增强,1 563 cm-1处的ν(NH2基)振动吸收峰减弱,并和酰胺(Ⅱ)峰相重叠成一个较宽的峰,提示GA-CS成功合成。
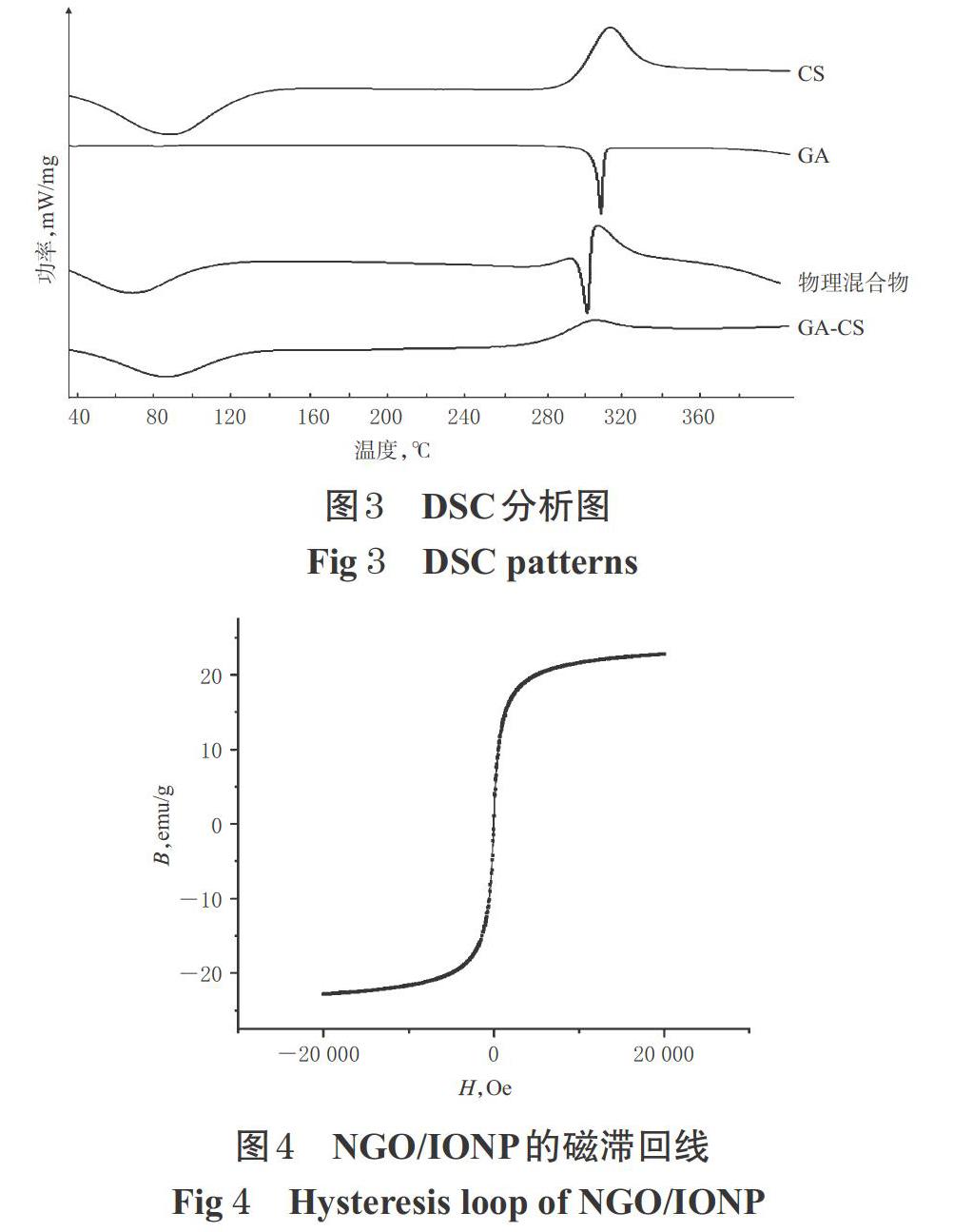
2.2.2 DSC表征 对CS、GA、GA-CS以及GA-CS物理混合物(质量比为1 ∶ 1)进行DSC扫描,扫描温度为30~400 ℃,结果见图3。
由图3可知,CS与GA有各自不同的吸热峰与放热峰,GA-CS物理混合物中具有二者共同的特征峰。而GA-CS与GA-CS物理混合物的峰形完全不同,与CS相比也有所改变,这证明GA-CS成功合成。
2.2.3 磁性表征 称取NGO/IONP 10 mg,加5 mL水超声,得到NGO/IONP水分散液。在室温条件下,于振动样品磁测量仪中测定该水分散液的磁滞回线,外加磁场区间为-20 000~20 000 Oe,结果见图4。
由图4可知,NGO/IONP的磁化强度随外加磁场的变化而变化,呈现超顺磁性,几乎无磁滞现象,饱和磁化强度大约为22 emu/g。参考前期本课题组建立的IONP的磁滞回线[17]可知,本研究合成的NGO/IONP具有超顺磁性。
2.3 GA-DTX-NGO/IONP-NPs的制备
采用离子凝胶化法[18]制备GA-DTX-NGO/IONP- NPs。称取GA-CS 10 mg,溶于1%醋酸溶液(pH 4.5)5 mL中,搅拌溶解后得GA-CS的高分子溶液。称取NGO/IONP 3 mg,分散于GA-CS溶液中,超声处理30 min,探头超声(功率:80 W,频率:20 kHz)5 min,制得溶液①。稱取DTX 3 mg,溶于0.2 mL甲醇中,将DTX药液加入上述溶液①中,超声(功率:500 W,频率:40 kHz)2 h,制得溶液②。然后在室温下搅拌的同时,将TPP水溶液(1 mg/mL)缓慢滴加入溶液②中,直至产生淡蓝色乳光时停止滴加,继续搅拌1 h,即得GA-DTX-NGO/IONP-NPs。同法制备空白纳米粒(仅不加DTX,其余步骤相同)。
2.4 GA-DTX-NGO/IONP-NPs中DTX的含量测定
采用紫外-可见分光光度法测定GA-DTX-NGO/IONP-NPs中DTX的含量。
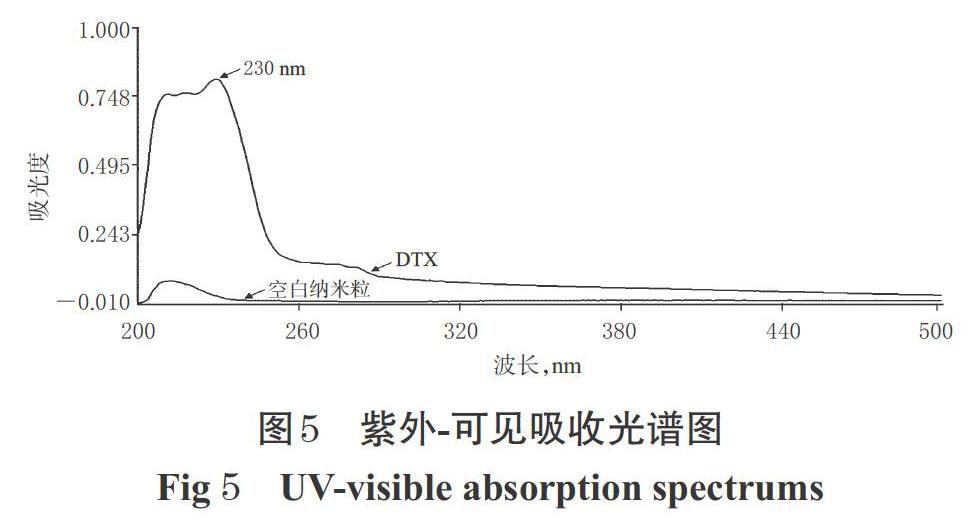
2.4.1 检测波长的确定 称取DTX 2.01 mg,加甲醇溶解并定容至2 mL,得质量浓度为1.005 mg/mL的DTX贮备液;取上述贮备液适量,加甲醇稀释,制成质量浓度为20.1 μg/mL的DTX供试品溶液。取空白纳米粒适量,加甲醇稀释,得空白纳米粒供试品溶液。以甲醇为空白对照进行调零,分别取上述2种供试品溶液于200~500 nm波长范围内进行全波长扫描,结果见图5。
由图5可知,DTX的最大吸收波长为230 nm,空白纳米粒在此波长处基本无吸收,表明空白辅料对DTX测定无干扰,故选择检测波长为230 nm。
2.4.2 方法学考察 (1)线性关系考察:精密吸取“2.4.1”项下DTX贮备液适量,加甲醇分别稀释制成质量浓度为5.02、10.05、15.07、30.15、40.2 μg/mL的对照品溶液,并于230 nm波长处测定其吸光度。以DTX质量浓度为横坐标(x,μg/mL)、吸光度为纵坐标(y)进行线性回归,得DTX的回归方程为y=0.025x-0.043 2(R2=0.999 1)。结果表明,DTX在5.02~40.2 μg/mL质量浓度范围内线性关系良好。(2)其他方法学考察:按照2015年版《中国药典》(四部)[19]标准进行精密度、稳定性和加样回收率考察。结果,精密度、稳定性(0、2、4、6、8、12 h)、重复性试验的RSD分别为0.81%(n=6)、1.04%(n=6)、0.62%(n=6);低、中、高(6、20、40 μg/mL)3个质量浓度的平均加样回收率分别为99.67%、99.90%、99.89%,RSD分别为0.16%、0.09%、0.04%(n=3)。
2.5 GA-DTX-NGO/IONP-NPs的表征
2.5.1 形态观察 采用透射电镜法进行观察。吸取“2.3”项下空白纳米粒和GA-DTX-NGO/IONP-NPs 2.5 mL,分别加水定容至5 mL,混匀后,滴至专用的碳膜铜网上,采用磷钨酸染色,待干燥后于透射电镜下观察其形态,结果见图6。
由图6可见,空白纳米粒和GA-DTX-NGO/IONP-NPs的形态良好,粒径均约为200 nm。与空白纳米粒相比,GA-DTX-NGO/IONP-NPs呈圆球状,有黑色簇状物吸附在纳米粒内外,笔者推测这可能是由于纳米粒负载了大量DTX-NGO/IONP。
2.5.2 粒径及Zeta电位测定 精密吸取“2.3”项下空白纳米粒和GA-DTX-NGO/IONP-NPs各0.5 mL,分别加水定容至5 mL,混匀后,采用电位及粒度分析仪测定其粒径及Zeta电位的分布,结果见图7、图8。
结果显示,空白纳米粒的粒径为(226.0±3.6) nm,Zeta电位为(15.1±1.0) mV;GA-DTX-NGO/IONP-NPs的粒径为(262.8±4.2) nm,Zeta电位为(13.6±1.5) mV。由图7、图8可见,空白纳米粒和GA-DTX-NGO/IONP-NPs的粒径和电位分布均较均匀。
2.5.3 包封率及载药量测定 采用超滤离心法[20]测定GA-DTX-NGO/IONP-NPs的包封率和载药量。精密吸取“2.3”项下GA-DTX-NGO/IONP-NPs 0.2 mL,加适量甲醇破乳0.5 h,然后再用甲醇定容至5 mL,采用紫外-可见分光光度仪于230 nm波长处测定溶液吸光度,按照“2.4.2(1)”项下DTX回归方程计算出溶液中DTX总质量,记为W总。精密吸取“2.3”项下GA-DTX-NGO/IONP- NPs 1 mL,置于超滤管中(分子量30 kDa),以5 000 r/min离心15 min,取上清液0.2 mL,加甲醇破乳0.5 h,再用甲醇定容至5 mL,同法于230 nm波长处测定溶液吸光度,按照“2.4.2(1)”项下DTX回归方程计算出溶液中DTX质量,记为W游。纳米粒混悬液中其他材料的质量根据加入量记为W其他。按公式计算包封率和载药量:包封率(%)= [(W总-W游)/W总]×100%;载药量(%)= [(W总-W游)/(W总+W其他)]×100%。结果,DTX的包封率为(94.29±0.50)%,RSD=0.53%(n=3);载药量为(17.12±0.12)%,RSD=0.70%(n=3)。
2.5.4 磁性檢测 将GA-DTX-NGO/IONP-NPs置于西林瓶中,旁边放置磁铁,0.5 h后室温下拍照,观察有或者无外加磁场时的状态,结果见图9。
由图9可知,GA-DTX-NGO/IONP-NPs在室温下为均匀黑色分散液,在外加磁场下能够迅速向磁场聚集得到澄清溶液,经振摇后又重新分散均匀。综合“2.2.3”项下结果,表明GA-DTX-NGO/IONP-NPs具有良好的磁定向性。
2.5.5 光热转换试验 参考文献方法[21]进行光热转换试验。精密吸取GA-DTX-NGO/IONP-NPs适量,加水稀释,制成NGO/IONP质量浓度分别为0.05、0.1、0.2、0.4 mg/mL的溶液,并以水为对照组(记为0 mg/mL)。分别取上述溶液各3 mL,置于石英比色皿中,采用激光器(2.5 W/cm2)照射,激发波长为808 nm,每30 s记录1次温度。以时间(min)为横坐标、温度(℃)为纵坐标,采用Origin 2019软件绘制光热转换曲线,结果见图10。
由图10可知,0.05、0.1、0.2、0.4 mg/mL 4 个质量浓度的GA-DTX-NGO/IONP-NPs随着照射时间的延长,其温度均先快速上升,而后趋于平缓;且质量浓度越大,温度上升速度越快。试验过程中对照组温度几乎无变化。结果表明,GA-DTX-NGO/IONP-NPs 具有浓度和时间依赖趋势的光热转换特性。
3 讨论
以CS作为纳米粒的载体材料,不仅安全无毒,且能够大幅提高药物的包封率及载药量,有效改善DTX入血后血药浓度低、生物利用度低等缺点。采用GA靶向修饰CS,利用GA良好的肝靶向性能赋予纳米粒主动靶向性,有望提高药物的肝肿瘤靶向性。
在肿瘤的治疗中,磁热疗法往往要与化疗结合。NGO/IONP作为磁热疗法中采用的常见纳米材料之一,因其独特的理化特性和光学性质,具有缓释性、靶向性及血脑屏障穿透性等优点,多用作肿瘤药物的载体从而进行靶向治疗[22-23]。NGO/IONP纳米尺径的大小会影响药物载体结合后的稳定性、纳米粒的成形甚至靶向定位效果,故对磁性材料尺径的调控至关重要。本研究所合成的NGO/IONP粒径在200 nm左右,对纳米粒的成形基本没有干扰作用。目前,关于NGO/IONP的研究大多只限于细胞试验和动物实验,真正用于临床上的成熟剂型很少,且国际上对其毒性大小也没有一个公认的标准,故NGO/IONP的安全性及稳定性仍需进一步考察改进,以期未来其能在肿瘤的诊断与治疗中发挥更大的作用。
本研究所制备的GA-DTX-NGO/IONP-NPs分散性良好、粒径大小较为均匀、包封率和载药量均较高,在外加磁场下可定向移动,具有良好的光热转换性能,可为将其应用于肝肿瘤磁热-化疗联合治疗提供一定的理论依据。
参考文献
[ 1 ] 郑荣寿,孙可欣,张思维,等. 2015年中国恶性肿瘤流行情况分析[J].中华肿瘤杂志,2019,41(1):19-28.
[ 2 ] SINGAL AG,EL-SERAG HB. Hepatocellular carcinoma from epidemiology to prevention:translating knowledge into practice[J]. Clin Gastroenterol Hepatol,2015,13(12):2140-2151.
[ 3 ] CHAO W,XU H,CHAO L,et al. Iron oxide@ polypyrrole nanoparticles as a multifunctional drug carrier for remotely controlled cancer therapy with synergistic antitumor effect[J]. Acs Nano,2013,7(8):6782-6795.
[ 4 ] GOBBO OL,SIAASTAD K,RADOMSKI MW,et al.Magnetic nanoparticles in cancer theranostics[J]. The- ranostics,2015,5(11):1249-1263.
[ 5 ] 陈路锋,钟红珊,徐克.基于氧化铁的磁性纳米颗粒在肿瘤诊疗中的应用进展[J].中国肿瘤临床,2019,46(8):416-420.
[ 6 ] 杜夏夏,舒刚,陈宗艳.氧化石墨烯在生物医学领域的应用[J].功能材料,2018,49(8):8040-8047.
[ 7 ] BARAHUIE F,SAIFULLAH B,DORNIANI D,et al. Corrigendum to“graphene oxide as a nanocarrier for controlled release and targeted delivery of an anticancer active agent,chlorogenic acid”[J]. Mater Sci Eng C Mater Biol Appl,2017. DOI:10.1016/j.msec.2017.03.050.
[ 8 ] MA X,TAO H,YANG K,et al. A functionalized graphene oxide-iron oxide nanocomposite for magnetically targeted drug delivery,photothermal therapy,and magnetic resonance imaging[J]. Nano Res,2012,5(3):199-212.
[ 9 ] CHEN W,YI P,YI Z,et al. Composites of aminodextran-coated Fe3O4 nanoparticles and graphene oxide for cellular magnetic resonance imaging[J]. ACS Appl Mater Interfaces,2011,3(10):4085-4091.
[10] 曹熙.多西紫杉醇聚合物胶束的研究进展[J].中国新药杂志,2017,26(10):1137-1143.
[11] ZHANG L,ZHANG N. How nanotechnology can enhance docetaxel therapy[J]. Int J Nanomedicine,2013. DOI:10.2147/IJN.S46921.
[12] SALOMATINA OV,MARKOV AV,LOGASHENKO EB,et al. Synthesis of novel 2-cyano substituted glycyrrheti- nic acid derivatives as inhibitors of cancer cells growth and NO production in LPS-activated J-774 cells[J]. Bioorg Med Chem,2014,22(1):585-593.
[13] 张丽娟,喻红梅,张勇,等.甘草次酸纳米粒的制备、表征及其抗肿瘤活性研究[J].中国药房,2020,31(13):1589- 1594.
[14] NEGISHI M,IRIE A,NAGATA N,et al. Specific binding of glycyrrhetinic acid to the rat liver membrane[J]. Biochim Biophys Acta,1991,1066(1):77-82.
[15] 高君.磁性氧化石墨烯的制备及其作为药物载体的初步研究[D].郑州:郑州大学,2014.
[16] 马亚萍,黄一平,赵呈雷,等.温敏性甘草次酸/壳聚糖药物载体的制备及其胶束的性能研究[J].中国新药杂志,2015,24(23):2733-2739.
[17] FAZIL M,MD S,HAQUE S,et al. Development and eva- luation of rivastigmine loaded chitosan nanoparticles for brain targeting[J]. Eur J Pharm Sci,2012,47(1):6-15.
[18] 刘丽丽,史畑女,方蕾,等.马钱子总碱-白芍总苷脂质立方液晶纳米粒制备及体外评价[J].中草药,2019,50(17):4076-4083.
[19] 国家药典委员会.中华人民共和国药典:四部[S]. 2015年版.北京:中国医药科技出版社,2015:38-40.
[20] ZHU XL,HUANG HQ,ZHANG YJ,et al. Cit/CuS at FeO-based and enzyme-responsive magnetic nanoparticles for tumor chemotherapy,photothermal,and photodynamic therapy[J]. J Biomater Appl,2017,31(7):1010- 1025.
[21] 祝侠丽,王莎莎,李玲华,等.甘草次酸修饰纳米氧化石墨烯递药系统的制备与表征[J].中国中药杂志,2019,44(21):4621-462.
[22] YANG X,ZHANG X,MA Y,et al. Superparamagnetic graphene oxide-Fe3O4 nanoparticles hybrid for controlled targeted drug carriers[J]. J Mater Chem,2009,19(19):2710-2714.
[23] 趙鹏慧,王彦,刘雪颖,等.叶酸修饰磁性氧化石墨烯载体的制备、表征及其磁性研究[J].中国药房,2019,30(15):2061-2065.
(收稿日期:2020-06-23 修回日期:2020-08-13)
(编辑:林 静)

