基于Met/PI3K/Akt信号通路研究五味子甲素对人鼻咽癌细胞HONE-1增殖、迁移和侵袭的影响
陈腾祥 梁黎 曾智锐 雷珊 王婧雅 孙远梅 兰金芝 薛燕


摘 要 目的:研究五味子甲素对人鼻咽癌细胞HONE-1增殖、迁移和侵袭的影响及其可能机制。方法:以HONE-1细胞为研究模型,使用不同浓度[0(空白对照)、10、20、40 μmol/L]的五味子甲素处理后,分别采用CCK-8试验、划痕试验和Transwell小室试验检测细胞的增殖、迁移和侵袭能力变化;通过计算机分子对接分析五味子甲素与酪氨酸蛋白激酶(Met)蛋白的结合能力;采用Western blotting法检测细胞中磷酸化酪氨酸蛋白激酶(p-Met)、磷酸化磷脂酰肌醇-3-激酶(p-PI3K)、磷酸化蛋白激酶B(p-Akt)、B淋巴细胞瘤2(Bcl-2)和N-钙黏蛋白(N-cadherin)的相对表达量。结果:与空白对照比较,10、20、40 μmol/L五味子甲素处理后细胞的增殖、迁移和侵袭能力均显著减弱(P<0.05);分子对接结果显示,五味子甲素能与Met蛋白的活性口袋稳定结合;Western blotting试验结果显示,与空白对照比较,10、20、40 μmol/L五味子甲素处理后细胞中p-Met、p-PI3K、p-Akt、Bcl-2和N-cadherin蛋白的相对表达量均显著降低(P<0.05)。结论:五味子甲素可通过抑制Met/PI3K/Akt信号通路的活化来抑制HONE-1细胞的增殖、迁移和侵袭。
关键词 五味子甲素;增殖;迁移;侵袭;酪氨酸蛋白激酶;磷脂酰肌醇-3-激酸;蛋白激酶B;人鼻咽癌细胞HONE-1
ABSTRACT OBJECTIVE: To study the effects and potential mechanism of deoxyschizandrin on the proliferation, migration and invasion of nasopharyngeal carcinoma cell HONE-1. METHODS: HONE-1 cell was set as cell model, while CCK-8 test, wound healing assay and Transwell chamber test were used to detect the proliferation, migration and invasion ability changes of HONE-1 cells after treatment with different concentrations [0 (blank control), 10, 20, 40 μmol/L] of deoxyschizandrin. Computer molecular docking was performed to analyze the binding ability between deoxyschizandrin and Met protein. Western blotting assay was used to detect the relative protein expressions of p-Met, p-PI3K, p-Akt, Bcl-2 and N-cadherin in cells. RESULTS: Compared with blank control, the proliferation, migration and invasion ability of cells after treated with 10, 20, 40 μmol/L deoxyschizandrin were all decreased significantly (P<0.05). Results of molecular docking revealed that deoxyschizandrin could stably bind with the activity pocket of Met protein. Results of Western blotting assay demonstrated that compared with blank control, 10, 20, 40 μmol/L deoxyschizandrin all decreased the relative protein expressions of p-Met, p-PI3K, p-Akt, Bcl-2 and N-cadherin in cells significantly (P<0.05). CONCLUSIONS: Deoxyschizandrin can inhibit the proliferation, migration and invasion of HONE-1 cell via inhibiting the activation of Met/PI3K/Akt signaling pathway.
KEYWORDS Deoxyschizandrin; Proliferation; Migration; Invasion; Met;PI3K;Akt;Human nasopharyngeal carcinoma cell HONE-1
鼻咽癌(Nasopharyngeal cancer)是一种在我国南部地区高发的头颈部恶性肿瘤,在广东省的发病率很高,故也被称为“广东癌”。目前,针对鼻咽癌的主要治疗手段為放疗,但放疗后患者的总生存率仍低于50%,且大部分患者在治疗后3~5年内会出现复发、化疗耐受等情况[1-2],因此迫切需要挖掘新的治疗鼻咽癌的药物。
酪氨酸蛋白激酶(Met)也称为c-Met,是一种受体酪氨酸激酶,在上皮细胞中广泛表达。在生理作用下,Met通过调控多个酪氨酸激酶[如磷脂酰肌醇-3-激酶(PI3K)和Rac家族GTP酶 1(RAC-1)]的磷酸化,进而调节细胞的增殖、迁移和分化等各项生物学功能[3]。在鼻咽癌患者中,Met表达升高,且与患者的不良预后相关[4]。此外,PI3K/蛋白激酶B (Akt)信号通路在鼻咽癌中呈异常活化,可通过调控B淋巴细胞瘤2(Bcl-2)等增殖相关因子和N-钙黏蛋白(N-cadherin)等迁移相关因子的表达,促进鼻咽癌的进展;而Met可以通过促进PI3K的磷酸化从而激活PI3K/Akt信号通路[5-6]。多项研究表明,通过基因工程或药理学手段抑制Met的表达或活性,能够抑制鼻咽癌细胞的增殖和转移。例如人工合成的Met抑制剂PF-2341066能够显著抑制鼻咽癌细胞的增殖,并与常规化疗药物顺铂有协同作用[7];再如利用慢病毒过表达miR-34c抑制Met的表达,能够抑制鼻咽癌的侵袭性[8]。
中药是我国重要的资源宝库,五味子甲素是中药五味子中的有效成分之一。本课题组早期研究发现,五味子甲素能够抑制多种肿瘤细胞(如肝癌和胰腺癌细胞等)的增殖和迁移[9-10]。然而,五味子甲素对鼻咽癌细胞增殖、迁移和侵袭的影响及作用机制仍不清楚。因此,本研究旨在探讨五味子甲素对人鼻咽癌细胞HONE-1增殖、迁移和侵袭的影响以及其分子机制,为临床治疗鼻咽癌提供理论依据。
1 材料
1.1 仪器
SW-CJ-1F(D)型单人工作台(苏州苏净安泰生物公司);BPN-80RNP型二氧化碳培养箱(上海一恒科学仪器有限公司);Multiskan GO型多功能酶标仪(美国Thermo Fisher Scientific公司);SZX16型倒置光学显微镜(日本Olympus公司);DYCZ-24K型电泳仪、DYCZ-40D型转膜仪(北京六一生物科技有限公司);GelDoc XR+型凝胶成像仪(美国Bio-Rad公司)。
1.2 药品与试剂
五味子甲素对照品(美国Med Chem Express公司,批号:HY-N0693,纯度:>98%);DMEM高糖细胞培养基、胎牛血清(FBS)(美国Gibco公司,批号:8120103、SA211.02);0.25%胰蛋白酶溶液(美国Multicell公司,批号:325043032);CCK-8试剂(武汉博士德生物工程有限公司,批号:15E27C60);Transwell小室(美国Corning公司,批号:30419069);Matrigel胶(美国BD公司,批号:354263);RIPA裂解液、蛋白酶抑制剂PMSF(武汉赛维尔生物技术有限公司,批号:G2002-100、G2008-01D);十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)试剂盒、二喹啉甲酸(BCA)定量试剂盒(大连美仑生物技术有限公司,批号:MA0388-08F、MA0082-02C);兔源Met多克隆抗体、鼠源PI3K单克隆抗体、兔源Akt多克隆抗体、兔源Bcl-2多克隆抗体、兔源N-cadherin多克隆抗体、鼠源β-肌动蛋白(β-actin)单克隆抗体(武汉三鹰生物技术公司,批号:25869、60225、10176、12789、22018、60008);兔源磷酸化PI3K(p-PI3K)多克隆抗体、兔源磷酸化Akt(p-Akt)多克隆抗体(美国CST公司,批号:17366、4060);辣根过氧化物酶(HRP)标记的山羊抗兔二抗、HRP标记的山羊抗鼠二抗(武汉爱博泰克生物科技有限公司,批号:AS014、AS003);ECL高敏曝光液(武汉聚能慧达生物有限公司,批号:36222ES60);二甲基亚砜(DMSO)等其余试剂均为分析纯或实验室常用规格,水为双蒸水。
1.3 细胞
人鼻咽癌细胞HONE-1由贵州省肿瘤医院肿瘤科馈赠。
2 方法
2.1 细胞培养
将HONE-1细胞用含10%FBS的DMEM高糖培养基在37 ℃、5%CO2的培养箱中培养,当细胞生长融合达85%时,用0.25%胰蛋白酶溶液进行消化、传代,取对数生长期细胞用于后续研究。
2.2 CCK-8试验检测五味子甲醇对细胞增殖能力的影响
将细胞用0.25%胰蛋白酶溶液消化后,以1 000 r/min离心5 min,收集细胞,用含10%FBS的DMEM高糖培养基重悬,制备成密度为2×104个/mL的细胞悬液,按100 μL/孔接种至96孔板。将细胞分为空白对照组(含0.4%DMSO)和五味子甲素不同浓度组(10、20、40 μmol/L,含4%DMSO),每组设置6个复孔。同时设置不加细胞和药物的调零孔。将各组细胞置于37 ℃、5%CO2的培养箱中培养过夜,然后加入相应药物,继续培养24、48 h。吸弃培养基,按100 μL/孔的量加入CCK-8溶液(将CCK-8试剂与DMEM高糖培养基以体积比1 ∶ 9混合),继续培养2 h后,采用多功能酶标仪在450 nm波长处测量每孔的吸光度(OD)值,并计算各组细胞的相对增殖率[细胞相对增殖率(%)=(五味子甲素给药组OD值-调零孔OD值)/(空白对照组OD值-调零孔OD值)×100%]。试验重复3次。
2.3 细胞划痕试验检测细胞迁移能力
将细胞按“2.2”项下方法消化、离心、收集并重悬,制备成密度为1×105个/mL的细胞悬液,按2 mL/孔的量接种至6孔板。将细胞分为空白对照组(含0.4%DMSO)和不同浓度五味子甲素组(10、20、40 μmol/L,含0.4%DMSO),每组设置3个复孔。将细胞置于37 ℃、5%CO2的培养箱中培养,待细胞生长融合达95%以上时,用200 μL移液枪头在每个孔中的单层细胞上划线,然后以PBS洗涤2次后,各孔加入相应药物,继续培养0、24 h后,于倒置显微镜下观察。随机选取5个视野进行拍照,使用Image Pro Plus 6.0軟件测量划痕面积,并根据0 h与24 h时的划痕面积差值计算细胞的迁移率[迁移率(%)=(给药0 h时的划痕面积-给药24 h时的划痕面积)/给药0 h时的划痕面积×100%]。试验重复3次。
2.4 Transwell小室试验检测细胞侵袭能力
将Matrigel胶和无血清DMEM高糖培养基按1 ∶ 8的体积比混匀,铺于Transwell上室,并置于37 ℃培养箱中烘干,弃掉多余的培养基。将细胞按“2.2”项下方法消化、离心、收集并重悬,制备成密度为2×105个/mL的细胞悬液,用移液枪分别吸取200 μL加入到Transwell上室,再分别加入0(空白对照)、10、20、40 μmol/L的五味子甲素(均含0.4%DMSO),每个浓度设置3个样本。在下室中加入700 μL含10%FBS的DMEM高糖培养基。培养24 h后,使用4%多聚甲醛固定小室,用PBS漂洗2次,然后用0.1%结晶紫染色15 min。擦拭掉非侵袭细胞后,在倒置显微镜下观察,计数每孔转移至微孔膜下层的细胞数,每个样本随机选择5个视野进行计数。试验重复3次。
2.5 计算机分子对接分析五味子甲素与Met蛋白的结合能力
从在线数据库PubChem Compound(https://www.ncbi.nlm.nih.gov/pccompound/)中下载五味子甲素的三维结构文件(SDF格式)。从在线数据库Protein Data Bank(PDB,https://www.rcsb.org/)中下载Met蛋白的晶体结构文件(该蛋白在PDB数据库的检索ID号:3DKF)。将Met蛋白的晶体结构文件导入到SYBYL 1.3软件中,删除原配体、修复氨基端和羧基端的黏性末端后,以自动识别模式根据蛋白序列鉴定蛋白的活性口袋;再导入五味子甲素的三维结构文件,以柔性对接模式进行对接。根据结合评分(C-score:0~5)判断分子与蛋白活性口袋结合的稳定性,C-score在4~5分范围则可认为分子与蛋白能够稳定结合[11]。
2.6 Western blotting法检测细胞中Met/PI3K/Akt信号通路相关蛋白的表达情况
将细胞按“2.2”项下方法消化、离心、收集并重悬,制备成密度为1×105个/mL的细胞悬液,按2 mL/孔接种至6孔板。将细胞置于37 ℃、5%CO2培养箱内培养,待细胞贴壁后,分别加入0(空白对照)、10、20、40 μmol/L的五味子甲素(均含0.4%DMSO)培养24 h。培养结束后,吸弃培养基,加入RIPA裂解液和PMSF蛋白酶抑制剂混合液(体积比为100 ∶ 1),在冰上裂解细胞15 min,然后在4 ℃下以12 000 r/min离心30 min,吸取蛋白上清液,用BCA法进行蛋白定量。蛋白经变性处理后,取25 μg经10%SDS-PAGE在90 V恒定电压下电泳2 h,300 mA恒流2 h转至聚偏氟乙烯(PVDF)膜上,以5%脱脂牛奶室温封闭2 h;分别加入Met、p-Met、PI3K、p-PI3K、Akt、p-Akt、Bcl-2、N-cadherin和GAPDH一抗(稀释比例均为1 ∶ 1 000),在4 ℃下孵育过夜;TBST漂洗5 min×3次,加入山羊抗兔二抗和山羊抗鼠二抗(稀释比例均为1 ∶ 2 000),在室温摇床中孵育2 h;TBST漂洗5 min×3次,滴加ECL高敏曝光液,于Bio-Rad成像仪中进行显影。以Image Lab 5.2.1软件测定条带的灰度值后,p-Met以Met为内参,p-PI3K以PI3K为内参,p-Akt以Akt为内参,Bcl-2和N-cadherin以GAPDH为内参,计算目标蛋白条带与内参蛋白条带灰度值的比值以表示目标蛋白的相对表达量。试验重复3次。
2.7 统计学分析
采用SPSS 20.0软件进行统计分析。试验数据以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05表示差異有统计学意义。
3 结果
3.1 五味子甲素对HONE-1细胞增殖的影响
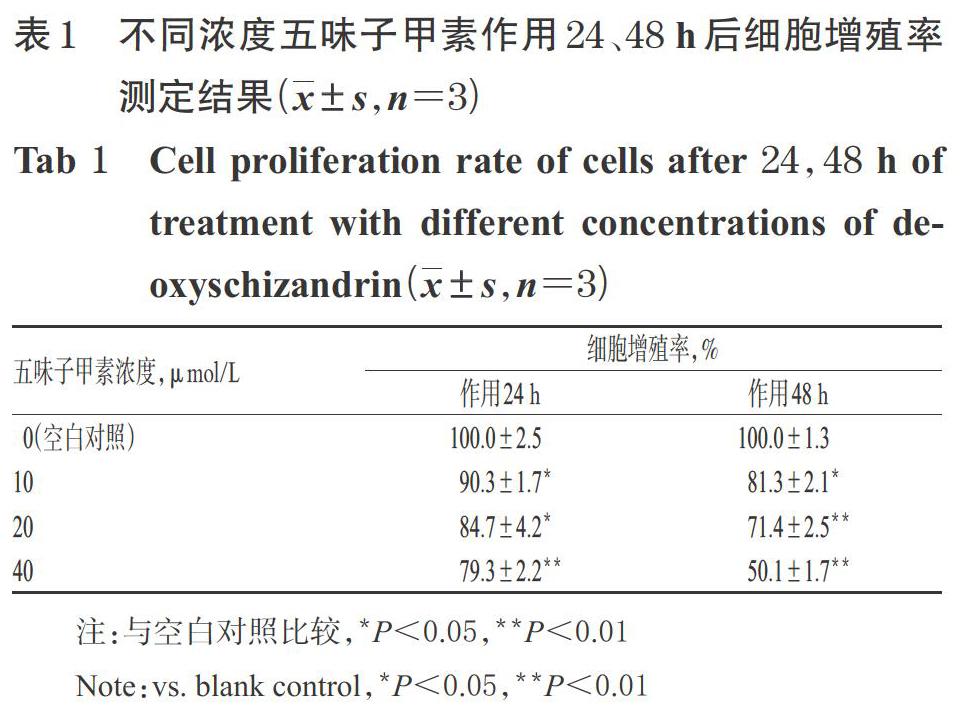
与空白对照(0 μmol/L)比较,10、20、40 μmol/L五味子甲素处理24、48 h后细胞的增殖率均显著降低(P<0.05或P<0.01),且具有一定的浓度依赖性趋势,提示五味子甲素能够显著抑制HONE-1细胞的增殖。不同浓度五味子甲素作用24、48 h后细胞增殖率测定结果见表1。
3.2 五味子甲素对HONE-1细胞迁移能力的影响
与空白对照(0 μmol/L)比较,10、20、40 μmol/L五味子甲素处理24 h后细胞的迁移率均显著降低(P<0.01),提示五味子甲素能够显著抑制HONE-1细胞的迁移。不同浓度五味子甲素作用24 h后细胞迁移情况显微图见图1,迁移率测定结果见表2。
3.3 五味子甲素对HONE-1细胞侵袭能力的影响
与空白对照(0 μmol/L)比较,10、20、40 μmol/L五味子甲素处理24 h后每视野下侵袭细胞数均显著减少(P<0.01),提示五味子甲素能够显著抑制HONE-1细胞的侵袭。不同浓度五味子甲素作用24 h后细胞侵袭情况显微图见图2,每视野下侵袭细胞数见表2。
3.4 五味子甲素与Met蛋白的活性口袋分子对接结果
分子对接结果显示,五味子甲素能与Met蛋白的活性口袋稳定结合(C-score=5),并且“包埋”在Met的活性口袋内,这提示五味子甲素发挥其生物学功能可能是通过影响Met蛋白及其下游信号通路来介导的。五味子甲素的三维结构及其与Met蛋白的活性口袋分子对接情况见图3。
3.5 五味子甲素对HONE-1细胞中Met/PI3K/Akt信号通路相关蛋白表达的影响
与空白对照(0 μmol/L)比较,10、20、40 μmol/L五味子甲素处理24 h后细胞中p-Met、p-PI3K、p-Akt、Bcl-2和N-cadherin蛋白的相对表达量均显著降低(P<0.05或P<0.01)。不同浓度五味子甲素作用24 h后细胞中p-Met、p-PI3K、p-Akt、Bcl-2和N-cadherin蛋白表达的电泳图见图4,蛋白相对表达量测定结果见表3。
4 讨论
虽然当前鼻咽癌以现代医学的治疗方法(放疗联合化疗)为主,但是中医药方面一直积极参与探索。中医药辨证论治在中晚期鼻咽癌和术后不良反应中发挥了重要的作用,其优点有降低毒副作用、显著减轻症状或延长带瘤生存期等[12]。
目前,多种中药及其有效成分展示了良好的抗鼻咽癌活性,如山楂酸能通过PI3K/Akt/雷帕霉素靶蛋白(mTOR)信号通路诱导鼻咽癌细胞自噬,进而抑制细胞增殖[13];萝卜硫素能够显著诱导鼻咽癌细胞凋亡[14];苦参碱衍生物能够通过增加抑癌miRNA(如miR-146b-5p)的表达,抑制鼻咽癌细胞的增殖、迁移和侵袭[15]。五味子甲素是一种从五味子果实中提取出来的具有生物活性的木脂素成分,具有抗炎、抗肿瘤和抗纤维化等多方面的药理学作用[16]。本研究通过CCK-8试验、划痕试验和Transwell小室试验发现,五味子甲素处理后,人鼻咽癌细胞HONE-1的增殖、迁移和侵袭能力均明显减弱,这提示五味子甲素具有良好的抗鼻咽癌活性。
Met蛋白是由位于7号染色体上的Met原癌基因编码的,具有酪氨酸激酶作用的跨膜受体,其配体是肝细胞生长因子,当其与肝细胞生长因子结合后,Met蛋白被磷酸化激活[17]。已有临床研究表明,在鼻咽癌细胞放射治疗过程中Met蛋白可以被异常激活,继而引起鼻咽癌细胞放化疗耐受[18-19]。此外,还有研究表明,Met蛋白的表达与鼻咽癌患者的淋巴结转移和远处转移有关[20-21]。过往研究中,多种针对Met蛋白的抑制剂均展示出了良好的抗肿瘤效果。本研究通过计算机分子对接发现,五味子甲素能够与Met蛋白的活性口袋稳定结合。通过Western blotting试验发现,五味子甲素能够抑制Met蛋白的磷酸化。而Met蛋白磷酸化后可以激活PI3K-Akt、促分裂原活化蛋白激酶 (MAPK)、信号传导及转录激活因子(STAT)等信号分子[22-23]。目前,已有研究证实,由Met介导活化的PI3K/Akt通路与鼻咽癌的多种恶性生物学行为如异常增殖、放化疗耐受、血管形成及远处转移等密切相关[24]。本研究进一步通过Western bloting试验检测了五味子甲素对PI3K/Akt信号通路及其下游蛋白Bcl-2、N-cadherin表达的影响,发现其能够显著抑制PI3K/Akt信号通路的活化及其下游蛋白Bcl-2、N-cadherin的表达。
综上所述,五味子甲素能够通过抑制Met/PI3K/Akt信号通路的活化来抑制鼻咽癌细胞HONE-1的增殖、迁移和侵袭。五味子甲素有望开发为一种良好的抗鼻咽癌药物,但还需要更多的研究进一步证实。
参考文献
[ 1 ] 吴丽芷,陈始明.鼻咽癌放疗抵抗机制的研究进展[J].山东医药,2020,60(12):102-105.
[ 2 ] WU P,ZHAO Y,XIANG L,et al. Management of chemotherapy for stage Ⅱ nasopharyngeal carcinoma in the intensity-modulated radiotherapy era:a review[J]. Cancer Manag Res,2020. DOI:10.2147/CMAR.S239729.
[ 3 ] WANG H,RAO B,LOU J,et al. The function of the HGF/c-Met axis in hepatocellular carcinoma[J]. Front Cell Dev Biol,2020.DOI:10.3389/fcell.2020.00055.
[ 4 ] LUAN T,YU Y. Increased hepatocyte growth factor and c- Met receptor expression in nasopharyngeal carcinoma[J]. Int J Clin Exp Med,2014,7(12):5583-5587.
[ 5 ] ZHANG Y,XIA M,JIN K,et al. Function of the c-Met receptor tyrosine kinase in carcinogenesis and associated therapeutic opportunities[J]. Mol Cancer,2018. DOI:10. 1186/s12943-018-0796-y.
[ 6 ] LAU PC,WONG EY. Targeting Met by tyrosine kinase inhibitor suppresses growth and invasion of nasopharyngeal carcinoma cell lines[J]. Pathol Oncol Res,2012,18(2):357-363.
[ 7 ] ZHAO Y,ZHANG J,TIAN Y,et al. Met tyrosine kinase inhibitor,PF-2341066,suppresses growth and invasion of nasopharyngeal carcinoma[J]. Drug Des Devel Ther,2015.DOI:10.2147/DDDT.S85837.
[ 8 ] LI YQ,REN XY,HE QM,et al. MiR-34c suppresses tumor growth and metastasis in nasopharyngeal carcinoma by targeting Met[J]. Cell Death Dis,2015. DOI:10.1038/cddis.2014.582.
[ 9 ] 薛燕,曾智銳,雷珊,等.五味子甲素协同吉西他滨抑制肝癌细胞HepG2增殖[J].中国药理学通报,2020,36(4):550-555.
[10] 沈伊依,曾智锐,雷珊,等.五味子甲素抑制胰腺癌PANC- 1细胞迁移和侵袭及其机制探讨[J].肿瘤,2019,39(10):775-783.
[11] LI Y,HUANG Y,TU C,et al. Systems-pharmacology- based identification of antitumor necrosis factor effect in mimeng flower decoction for the treatment of diabetic retinopathy[J]. Evid Based Complement Alternat Med,2019. DOI:10.1155/2019/5107103.
[12] 于凤,王林林.中医药治疗鼻咽癌研究进展[J].中医眼耳鼻喉杂志,2019,9(2):99-101.
[13] 周芳亮,胡梅,胡晶,等.山楂酸通过PI3K/Akt/mTOR通路诱导鼻咽癌CNE2细胞自噬研究[J].中草药,2020,51(9):2481-2485.
[14] 赵丽,华夏,谭晔,等.萝卜硫素介导Akt/p70S6K信号传导诱导人鼻咽癌CNE-2细胞凋亡[J].中国临床药理学与治疗学,2019,24(7):786-791.
[15] XIE M,YI X,WANG R,et al. 14-Thienyl methylene matrine (YYJ18),the derivative from matrine,induces apoptosis of human nasopharyngeal carcinoma cells by targe- ting MAPK and PI3K/Akt pathways in vitro[J]. Cell Physiol Biochem,2014,33(5):1475-1483.
[16] 李静,张培,李文尧,等.五味子甲素研究进展[J].中国药业,2020,29(5):53-56.
[17] KANG YK,MURO K,RYU MH,et al. A phase Ⅱ trial of a selective c-Met inhibitor tivantinib (ARQ 197) monotherapy as a second- or third-line therapy in the patients with metastatic gastric cancer[J]. Invest New Drugs,2014,32(2):355-361.
[18] VIOLA D,CAPPAGLI V,ELISEI R,et al. Cabozantinib (XL184) for the treatment of locally advanced or metastatic progressive medullary thyroid cancer[J]. Future Oncol,2013. DOI:10.2217/fon.13.128.
[19] SCAGLIOTTI GV,NOVELLO S,PAWEL J. The emer- ging role of MET/HGF inhibitors in oncology[J]. Cancer Treat Rev,2013,39(7):793-801.
[20] YAP TA,SANDHU SK,ALAM SM,et al. HGF/c-Met targeted therapeutics:novel strategies for cancer medicine[J]. Curr Drug Targets,2011,12(14):2045-2058.
[21] TIAN X,LIU Z,NIU B,et al. E-cadherin/beta-catenin complex and the epithelial barrier[J]. J Biomed Biotechnol,2011. DOI:10.1155/2011/567305.
[22] LIU T,LI Q,SUN Q,et al. MET inhibitor PHA-665752 suppresses the hepatocyte growth factor-induced cell proliferation and radioresistance in nasopharyngeal carcinoma cells[J]. Biochem Biophys Res Commun,2014,449(1):49-54.
[23] SPIGEL DR,ERVIN TJ,RAMLAU RA,et al. Rando- mized phase Ⅱ trial of onartuzumab in combination with erlotinib in patients with advanced non-small-cell lung cancer[J]. J Clin Oncol,2013,31(32):4105-4114.
[24] SUN X,SU S,CHEN C,et al. Long-term outcomes of intensity-modulated radiotherapy for 868 patients with nasopharyngeal carcinoma:an analysis of survival and treatment toxicities[J]. Radiother Oncol,2014,110(3):398- 403.
(收稿日期:2020-07-04 修回日期:2020-08-17)
(編辑:林 静)

