不同植物生长调节剂浓度组合消毒方式及培养基蔗糖浓度对梭砂贝母愈伤组织诱导的影响
欧珠朗杰 贺凯 米玛潘多


摘 要:以梭砂贝母鳞茎为外植体,研究梭砂贝母组织培养中植物不同生长调节剂种类和浓度组合、外植体不同消毒方式及培养基蔗糖浓度对愈伤组织的诱导结果比较。结果表明,适宜诱导梭砂贝母鳞茎的植物生长调节剂组合及浓度为6-BA 0.5mg·L-1加NAA 3.0mg·L-1的MS培养基,用75%的乙醇消毒外植体30s,再用0.1%的升汞消毒10min污染率较低,蔗糖浓度为3%时,愈伤组织诱导率较高,结构结实、颜色淡黄且褐化率低。
关键词:梭砂贝母;外植体;愈伤组织;植物生长调节剂
中图分类号:S-3 文献标识码:A
DOI:10.19754/j.nyyjs.20200930007
引言
梭砂贝母(Fritillaria delavayi Franch.)属百合科(Liliaceae)贝母属(Fritillaria),藏语为阿皮卡,是白合科多年生草本植物,地下鳞茎外表类白色或浅黄棕色,部分具零星棕色斑点[1]。在西藏海拔4100m以上的高山流石滩均有出产,云南西北部、四川西部、青海南部(杂多、囊谦)也有出产。为重要的藏药材,用于阴虚劳嗽、肺热燥咳,干咳少痰,具有润肺清热,化痰功效[1]。由于梭砂贝母药用价值高,而其生长环境特殊、分布分散,自然繁殖系数低,商品药材完全依靠采挖野生资源并连年过度采挖,导致资源日趋减少,面临枯竭危险,破坏了梭砂贝母生长环境、种群自然更新,使梭砂贝母资源陷入匮乏。应用植物组织培养技术人工扩繁梭砂贝母资源,可不受季节、地域的影响,后代遗传性能稳定,具有很大的发展前景和极其重要的实际意义。目前,国内外对梭砂贝母的研究主要集中在化学成分、药效方面,对其栽培技术方面的研究相对较少,尚无针对梭砂贝母的较成熟组培技术参数[2]。本文通过人工条件下组织培养梭砂贝母,从梭砂贝母不同生长调节剂浓度及组合配比、不同消毒方式、培养基蔗糖浓度等方面探究梭砂贝母培养技术并进行分析,得出相关技术参数,提供理论依据。
1 材料与方法
1.1 材料
本试验材料为2020年7月采集于西藏山南市扎囊县境内,生长于海拔4650m的高山流石滩的梭砂贝母的鳞茎。从其鳞茎中选取无病害乳白色鳞茎进行实验室无菌处理,将切成适宜大小的鳞茎小块,接种于不同浓度植物生长调节剂组合浓度的MS培养基上,进行调控培养。
1.2 试验方法
1.2.1 培养基及母液的配制
以MS培养基(大量元素、微量元素、铁盐、有机物质)为基本培养基分别加入2%、3%、4%的蔗糖和7g·L-1的琼脂,pH值调至5.8,搅拌均匀,添加不同浓度的2, 4-D,6-苄基氨基嘌呤(6-BA)、萘乙酸(NAA)激素,分装于培养瓶。
2, 4-D、萘乙酸(NAA)、6-苄基嘌呤(6-BA)等植物生长调节物质,分别配成母液(0.1mg·mL-1)。配制方法:分别称取2, 4-D、6-BA和NAA各10mg,将NAA用少量(1mL)无水乙醇预溶,将6-BA用少量(1mL)物质的量浓度为0.1mol·L-1的NaOH溶液溶解,溶解过程需要水浴加热,最后分别定容至100mL,即得质量浓度为0.1mg·mL-1的母液[3]。
1.2.2 外植体的处理
组培用梭砂贝母鳞茎取自自然生境,外植体内外附有大量的微生物,外植体能否有效消毒是组织培养成功与否的重要影响因素[4]。消毒要求把材料表面和组织内的各种微生物杀灭干凈,只轻微损伤甚至不损伤组织材料而达到不影响外植体组织活力的目的[4]。
选取梭砂贝母地下鳞茎先用流水冲洗1h以上,根据试验设计进行3种不同的消毒方式(表1),用无菌水冲洗3次,再用无菌滤纸将外植体表面的水吸干,将其切成0.5cm,厚度为0.2cm左右大小相近的小块,接种到培养基上。
1.2.3 愈伤组织的诱导
根据外植体消毒处理结果,选择消毒效果良好的消毒方法,将梭砂贝母适宜大小鳞茎小块接种在附加不同浓度AA、2, 4-D、BA组合及不同浓度蔗糖培养基上,设蔗糖浓度为2%、3%、4%的培养基,比较蔗糖和植物生长调节剂浓度组合对梭砂贝母愈伤组织生长的影响[5]。
2 结果与分析
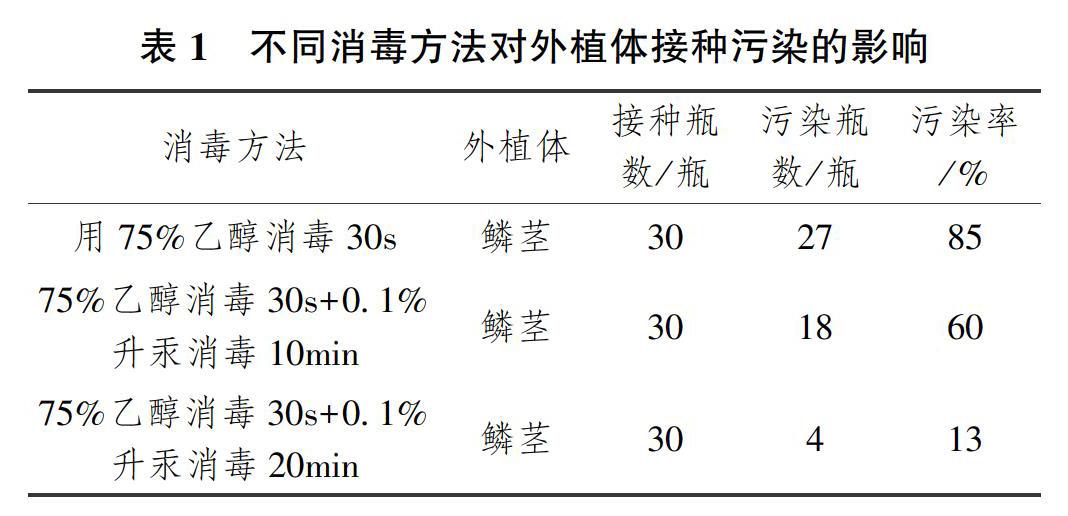
2.1 不同消毒方法对外植体污染的影响
从表1可以看出,仅用75%乙醇消毒30s的外植体污染率最高;75%乙醇消毒30s,再用0.1%的升汞消毒10in次之;用75乙醇消毒材料30s,再用0.1%的升汞消毒20min的外植体污染率最低。
3种消毒方法中,第1种方法污染率最高,第3种消毒方法污染率最低,但第3种消毒方法使鳞茎褐变率达90%以上。因此,第2种消毒方法较适合鳞茎的消毒。
2.2 植物生长调节剂对外植体愈伤组织诱导的影响
植物生长调节剂是植物组织培养过程中外植体脱分化形成愈伤组织的关键因素,形成愈伤组织的量和质量由培养基中不同植物生长调节剂的相对浓度控制,而不是这些物质的绝对浓度决定[5]。采用上述第2种消毒方法消毒的梭砂贝母鳞茎接种于附加2, 4-D,6-BA,NAA的6种培养基。结果(表2)表明,在6-BA 0.5mg·L-1加2, 4-D 3.0mg·L-1和MS加6-BA 0.5mg·L-1加NAA 3.0mg·L-1的MS培养基对鳞茎愈伤组织诱导率最高,均达到75%。
2.3 蔗糖浓度对外植体愈伤组织诱导的影响
选取相同适宜消毒方法和植物生调节剂浓度组合的培养基,其蔗糖浓度为3%时,外植体愈伤组织诱导率较高(表3);蔗糖浓度为2%、2.5%、3.5%、4%时,外植体的愈伤组织诱导率均较低;其中4%时外植体愈伤组织诱导率最低,可见诱导愈伤组织培养基较适宜的蔗糖浓度为3%。
3 结论
在本研究中,以梭砂贝母鳞茎作为外植体,分别研究适宜诱导愈伤组织的外植体消毒剂浓度、培养基蔗糖浓度及植物生长调节剂种类和浓度组合。
通过试验发现,在培养基中添加不同浓度的蔗糖对愈伤组织诱导有一定程度的影响,蔗糖浓度为3%时,外植体的愈伤组织诱导率较高;较低(2%)或较高(4%)均抑制外植体脱分化形成愈伤组织。较低或较高的蔗糖浓度使愈伤组织呈透明或淡黄色水泽状,结构硬板,形成量小,易褐化死亡,不利于进一步转接繁殖、分化和成苗[6]。诱导愈伤组织2种较好的培养基分别是MS加6-BA 0.5mg·L-1加2, 4-D 3.0mg·L-1和MS加6-BA 0.5mg·L-1加NAA 3.0mg·L-1。可为今后克服梭砂贝母组培与扩繁试验的盲目性,节约人力、物力、财力提供理论依据。
参考文献
[1] 欧珠朗杰.藏药材——梭砂贝母组织培养研究[J].西藏科技,2012(09):72-73.
[2]马吉义.暗紫贝母组织培养和快速繁殖的研究[D].西宁:青海师范大学,2011.
[3]欧珠朗杰,米玛潘多.梭砂贝母鳞茎组织培养研究[J].南方农业,2019,13(27):129-130.
[4]张志良,戳伟青.植物生理学实验指导[M].北京:高等教育出版社,2002.
[5]唐进,汪发缵.中国植物志[M].第14卷.北京:科学出版社,1980:104-105.
[6]蔡朝晖,李萍,高山林.中药贝母的组织培养研究状况[J].中草药,1998,29(04):272-178.
(责任编辑 李媛媛)

