鳑鲏对“蚌-草”关系的影响*
于谨磊,杨 柳,夏曼莉,2,候元璋,何 虎,关保华,刘正文,2,4
(1:中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,南京 210008) (2:暨南大学生态学系水生生物研究所,广州 510632) (3:同济大学环境科学与工程学院,上海 200092) (4:中国科学院大学中丹科研教育中心,北京 100049)
沉水植物在水生态系统中发挥重要作用[1],它通过叶片吸收水体营养盐,可有效降低水体营养盐浓度; 通过根系泌氧提高沉积物氧含量,抑制磷的释放速率; 其发达的根系还可稳固沉积物,抑制沉积物再悬浮[2-3]. 因此,在浅水湖泊生态修复中,沉水植物群落恢复被认为是湖泊修复的关键. 该技术也被广泛应用于我国热带、亚热带湖泊生态修复实践,在一些外源污染得到一定控制的湖泊中取得较好效果[4-8],其中惠州西湖南湖的生态修复效果已稳定维持了10多年[7].
在沉水植物恢复初期,即使在沉水植物覆盖度较高的水体,营养盐也可维持在较高的浓度水平. 这主要归因于长期处于富营养化状态的湖泊,沉积物中的营养盐含量较高,在适宜的环境条件下,将不断的释放到上覆水[9-11],从而促进浮游植物生物量快速增长,引起透明度下降,影响沉水植物生长. 湖泊富营养化引起的透明度下降,被认为是沉水植物生物量下降和生物多样性损失的主要原因[12]. 因此,在沉水植物恢复初期,为了维持适宜的光照条件,加速和保障沉水植物群落恢复,常将放养可通过滤食作用提高水体透明度[13-16]、促进沉水植物生长[17]的河蚌作为其并行手段,并已应用于湖泊生态修复[4,8,18]. 而较好的水下光照,还有利于植物表面附着藻类的生长,将会对沉水植物生物量和多样性产生显著的负面影响[19-20]. 但河蚌对沉水植物表面附着藻类的影响还未见相关报道.
河蚌是鳑鲏鱼类(鲤科鳑鲏亚科鱼类的统称)繁殖的重要基质,放养河蚌可能有利于鳑鲏种群的增加.鳑鲏的受精卵必须在河蚌(例如背角无齿蚌和三角帆蚌等[21])的外套膜发育,幼鱼在此生活一段时间后才独自生活. 因此,放养的河蚌可通过携带鳑鲏受精卵和增加鳑鲏的产卵基质两种途径,补充或促进鳑鲏种群的发展. 鳑鲏属于小型杂食性鱼类,可摄食浮游动物、底栖动物、附着藻类、碎屑和沉水植物等[5,22]. 而杂食性鱼类可通过排泄、扰动沉积物和影响浮游动物群落结构和生物量等途径,引起水体营养盐和浮游植物生物量升高,从而削弱水下光照[23-26],影响沉水植物生长[24]. 而鳑鲏对水质及沉水植物生长的影响还尚不清楚.
杂食性鱼类在低纬度地区浅水湖泊中的物种丰度较高[27],也是我国长江中下游湖泊的优势鱼类. 现有研究多关注较大个体杂食性鱼类的影响[23-26],对小型杂食性鱼类的关注较少. 而这些小型鱼类是某些生态修复湖泊的优势种[5,28],且放养肉食性鱼类也很难控制其数量[4-5]. 因此,了解此类小型杂食性鱼类对水生态系统的影响,将为浅水湖泊管理和生态修复提供理论参考. 本研究通过设置中宇宙试验系统,以密刺苦草(Vallisneriadenseserrulata)、大鳍鱊(Acheilognathusmacropterus)和背角无齿蚌(Sinanodontawoodiana)为研究对象,探讨大鳍鱊(鳑鲏)对水质、密刺苦草生长和“蚌-草”关系的影响.
1 材料与方法
1.1 试验设置
本试验在位于苏州东山镇的中国科学院南京地理与湖泊研究所太湖湖泊生态系统实验站的池塘中进行(东山站). 试验采用的试验系统为高密度聚乙烯塑料桶(容积: 130 L; 高: 66 cm; 上口直径: 56 cm; 底部直径: 45 cm). 每个桶内加入10 cm混匀的沉积物(采自东山站池塘,用孔径为0.5 cm的筛网过滤)和100 L经64 μm浮游生物网过滤的湖水; 同时,也将提前准备好的蓄水桶(1000 L)装满,用于补充各试验系统在试验期间流失的水分(自然蒸发和采样用水).
在试验开始之前,向12个中宇宙系统中分别栽植10株密刺苦草(以下简称苦草),其平均叶长为20.5±1.7 cm、平均生物量为81.8±8.1 g/m2. 本试验共设置3个处理组,分别为对照组(仅栽植苦草)、河蚌组(苦草+放养河蚌)和河蚌+鳑鲏组(苦草+河蚌+鳑鲏),每个处理组设置4个重复. 苦草种植7天后,对照组的试验系统不再添加任何试验材料; 向河蚌组的试验系统中加入1只背角无齿蚌(以下简称河蚌),其生物量为264.4±2.5 g/m2; 而在放养鳑鲏的试验系统中,不仅添加相同数量和相近生物量(266.7±5.0 g/m2)的河蚌,而且还加入3尾规格相近的大鳍鱊: 平均全长7.5±0.5 cm; 平均湿重9.1±0.2 g; 生物量39.9±2.7 g/m2,经分析: 系统间的大鳍鱊规格与生物量不存在显著性差异. 本试验采用的鱼类密度(8.6 ind./m2)接近自然湖泊中的小型鱼类密度(8.7 ind./m2)[29]; 而背角无齿蚌的生物量低于2006-2007年太湖蚌类的总平均生物量(647.4 g/m2)[30]. 鳑鲏和河蚌均在试验开始时同时投放到相应的试验系统. 本试验周期为42天,在4-5月(4月8日至5月20日)开展试验. 试验期间的平均水温为19.4±2.2℃.
1.2 样品采集与分析
在试验开始的第0、7、14、21、28、35和42天测定水体的营养盐、悬浮质和叶绿素a(Chl.a)浓度; 试验结束时,测定植物的各项生长指标和植物表面附着藻生物量. 每次水样采集时,用2.5 L的有机玻璃采水器,收集5 L不同水层的上覆水,然后准备2 L混合均匀的水样回试验室分析水体不同形态的氮、磷营养盐浓度、Chl.a浓度和不同形态的悬浮物浓度,最后将剩余水样倒回试验系统. 每次采样结束或当系统水位变化明显时,我们用提前准备好的湖水将水位恢复至试验初始水平.
总氮(TN)、溶解性总氮(TDN)、总磷(TP)、溶解性总磷(TDP)浓度的分析方法参照《湖泊富营养化调查规范》[31]. 用醋酸纤维膜过滤0.5~1 L水样,将滤膜转入离心管,加入10 mL 90%的丙酮溶液,充分震荡后置于4℃暗处反应18~24 h; 随后,经3500 r/min离心后,取上清液,用紫外分光光度计测定其在750、663、645和630 nm波长下的吸光值,计算水样中的Chl.a浓度.
用已知重量(W0)的Whatman GF/C玻璃纤维膜抽滤500~1000 mL水样,随后将膜置于60℃烘箱内,48 h后通过万分之一的天平获得膜重(W1),W1与W0的差值即为水体总悬浮质(TSS)浓度. 然后,将膜置于450℃的马弗炉中灼烧4 h,取出称重(W3),通过W1和W3的重量差获得总悬浮有机质(OSS)浓度; 而W1与W0的差值即为总悬浮无机质(ISS)的浓度.
试验结束时,将每个试验桶中所有苦草取出,测量每个桶的总株数、总生物量和最大叶长. 苦草根冠比测定时,从每个试验系统中随机选取10株植物,在实验室将表面附着物洗净后,置于60℃烘箱中烘48 h,然后分别称量每株植物的根和叶片重量,获得植物的根冠比值. 苦草叶片表面附着藻样品收集时,从每个试验系统中随机选取3株植物,然后从每株植物上随机摘取1片叶片. 为了保证所收集的附着藻来自同一水层,避免不同水层附着藻生物量的差异,我们选取苦草叶片离地(沉积物)20~30 cm处的叶片测定其附着藻生物量(用Chl.a浓度表示). 然后,将获得的苦草叶片用牙刷将其表面的附着藻刷入烧杯中. 最后,用量筒测量附着藻液体积后,用GF/C膜抽滤一定体积混匀的附着藻液(体积视藻液浓度而定),参照水体Chl.a浓度的测定方法获得附着藻类生物量(μg/cm2).
苦草的单株平均生物量(g/株)通过每个系统的苦草总重量和总株数获得. 苦草相对生长率(RGR,(mg/(g·d))的计算公式为:
RGR=1000×ln (Wf/Wi)/d
(1)
式中,Wf和Wi分别是苦草结束和初始总生物量(g);d是试验持续的天数.
1.3 数据分析
本研究的所有数据统计分析均在SPSS 22.0软件中进行. 通过单因素重复测量方差分析(rmANOVA),分别比较对照组与河蚌组和河蚌组与河蚌+鳑鲏组间的TN、TDN、TP、TDP、Chl.a、TSS、OSS和ISS浓度差异,其中组内比较参照一元方差分析中Greenhouse-Giesser校正后的结果. 试验结束时,对照组与河蚌组和河蚌组与河蚌+鳑鲏组间苦草的RGR、总株数、根冠比和平均单株生物量,以及植物表面附着藻类生物量采用t-test方法进行统计分析.
2 结果
2.1 水体营养盐浓度
对照组(P<0.01)、河蚌组(P<0.05)和河蚌+鳑鲏组(P<0.05)的水体TN浓度随时间变化显著,但对照组与河蚌组和河蚌组与河蚌+鳑鲏组间的TN浓度差异不显著(P>0.05)(图1a); TDN浓度在对照组(P<0.01)、河蚌组(P<0.05)和河蚌+鳑鲏组(P<0.01)中随时间的变化显著,但各处理组间TDN的浓度也无显著性差异(P>0.05)(图1b).
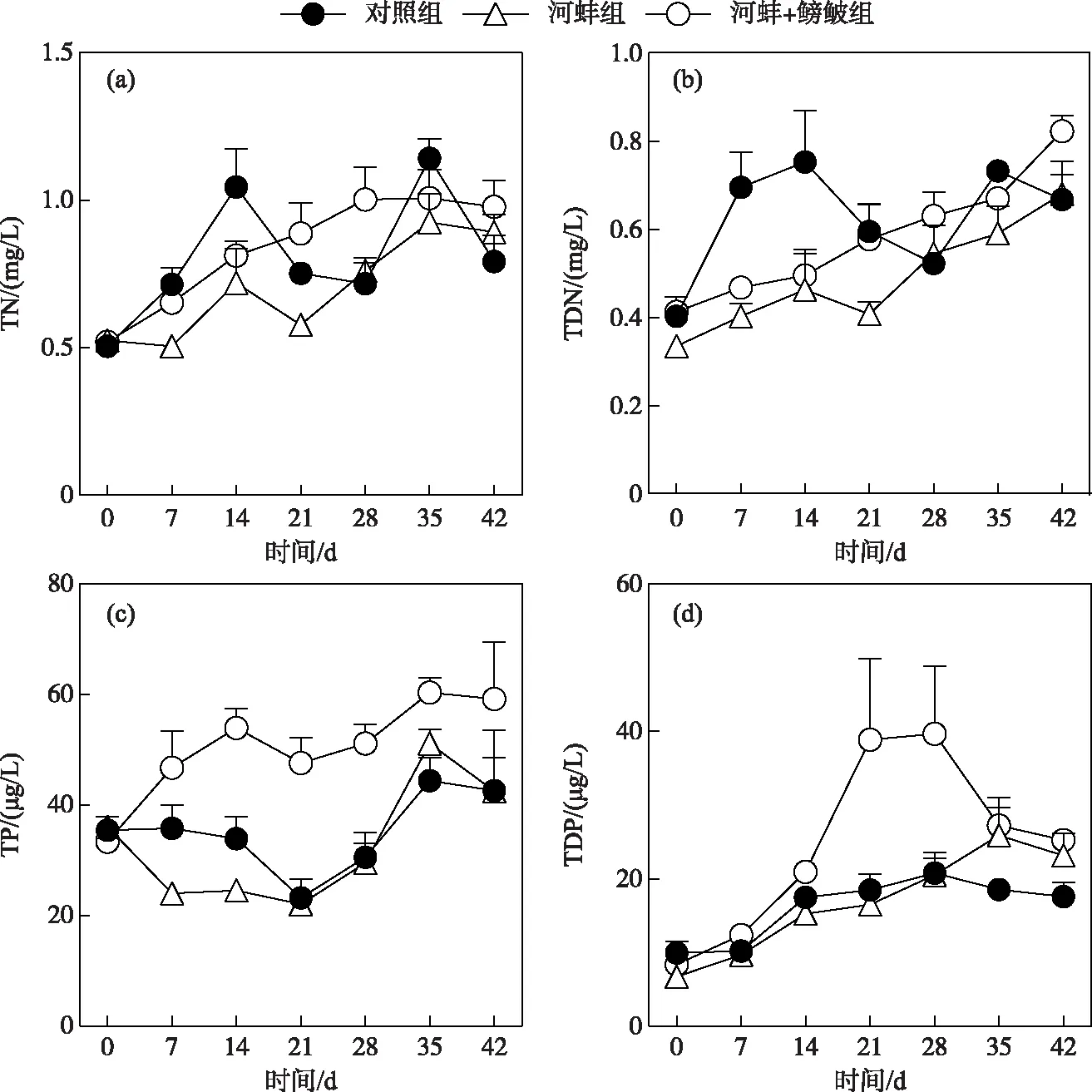
图1 试验期间不同处理组的总氮、总溶解氮、总磷和总溶解磷浓度随时间的变化Fig.1 Concentrations of total nitrogen,total dissolved nitrogen,total phosphorus and total dissolved phosphorus in different treatments during the experiment
对照组和河蚌组的TP浓度变化趋势相似,随时间的变化趋势显著(P<0.05); 但河蚌组与对照组的TP浓度在整个试验过程中均无显著差异(P>0.05)(图1c). 鳑鲏组的TP浓度在整个过程中呈逐渐升高的趋势(P<0.01); 其中,第14、21和28天的浓度均显著高于河蚌组(P<0.01),而其他采样时间的TP浓度与河蚌组间均无显著差异(P>0.05)(图1c).
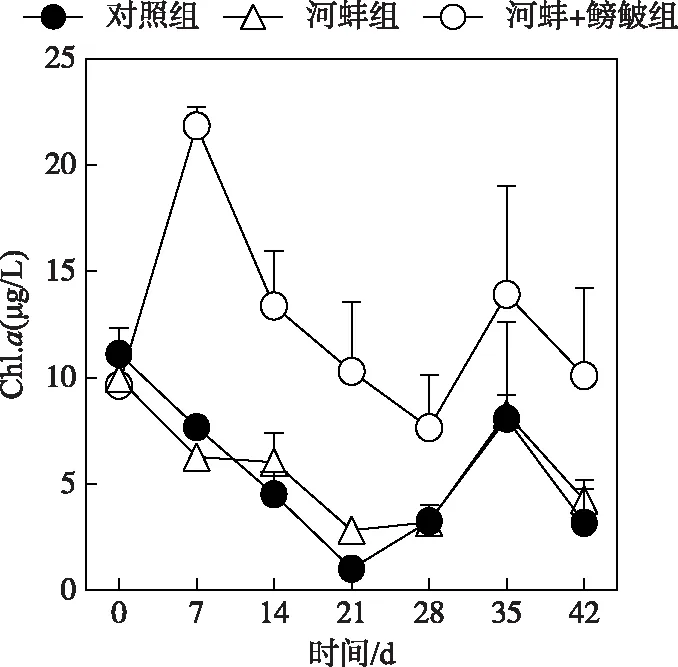
图2 试验期间不同处理组的 水体叶绿素a浓度Fig.2 Concentrations of chlorophyll-a in different treatments during the experiment
在整个试验周期内,对照组的TDP浓度变化不显著(P>0.05),而河蚌组和河蚌+鳑鲏组的TDP浓度随时间变化显著(P<0.05)(图1d). 河蚌+鳑鲏组的TDP浓度仅在试验开始的第21天时显著高于河蚌组(P<0.01),而在其他采样时间中,河蚌组与对照组以及河蚌+鳑鲏组与河蚌组间的TDP浓度均无显著性差异(P>0.05)(图1d).
2.2 水体Chl.a浓度
在本试验中,3个处理组的Chl.a浓度随时间的变化显著(P<0.05)(图2). 对照组和河蚌组间的Chl.a浓度,在整个试验过程中均无显著性差异(P>0.05). 而河蚌+鳑鲏组的Chl.a浓度显著高于河蚌组(P<0.001);在试验的第7天,河蚌+鳑鲏组的Chl.a浓度显著高于河蚌组(P<0.0001),而在其他采样时间这两组的Chl.a浓度差异不显著(P>0.05)(图2).
2.3 水体悬浮质浓度
对照组、河蚌组和河蚌+鳑鲏组的TSS浓度随时间变化显著(P<0.05). 对照组的TSS浓度在试验开始后逐渐下降,但仅第21和35天的TSS浓度显著低于初始浓度(P<0.05). 河蚌组的TSS浓度呈先升后降的变化趋势,其中河蚌组第7天的TSS浓度显著高于初始值(P<0.05),而第21和28天的TSS浓度则显著低于初始浓度(P<0.05)(图3a). 河蚌+鳑鲏组的TSS浓度也呈先升后降的趋势,其第7天的浓度,显著高于初始浓度(P<0.05),而其他采样时间的TSS浓度均与初始浓度无显著差异(P>0.05).
试验开始时,河蚌组与对照组和河蚌+鳑鲏组与河蚌组间的TSS浓度均相近(P>0.05). 河蚌+鳑鲏组的TSS浓度从第7天开始直至第28天,一直显著高于河蚌组(P<0.05). 河蚌组与对照组间的TSS浓度仅在试验开始的前两周内存在显著性差异(P<0.01),而在其他采样时间点的差异不显著(P>0.05)(图3a).
此外,对照组和河蚌组的OSS浓度随时间的变化显著(P<0.05),而河蚌+鳑鲏组的OSS浓度随时间的变化不显著(P>0.05). 试验期间,河蚌+鳑鲏组的OSS浓度显著高于河蚌组(P<0.0001)(图3b). 对照组的ISS浓度随时间变化不显著(P>0.05),而河蚌组(P<0.05)和河蚌+鳑鲏组(P<0.05)的ISS浓度随时间变化显著(图3c). 河蚌+鳑鲏组的ISS浓度显著高于河蚌组(P<0.0001),而河蚌组与对照组间的ISS浓度在整个试验期间均无显著性差异(P>0.05)(图3c).
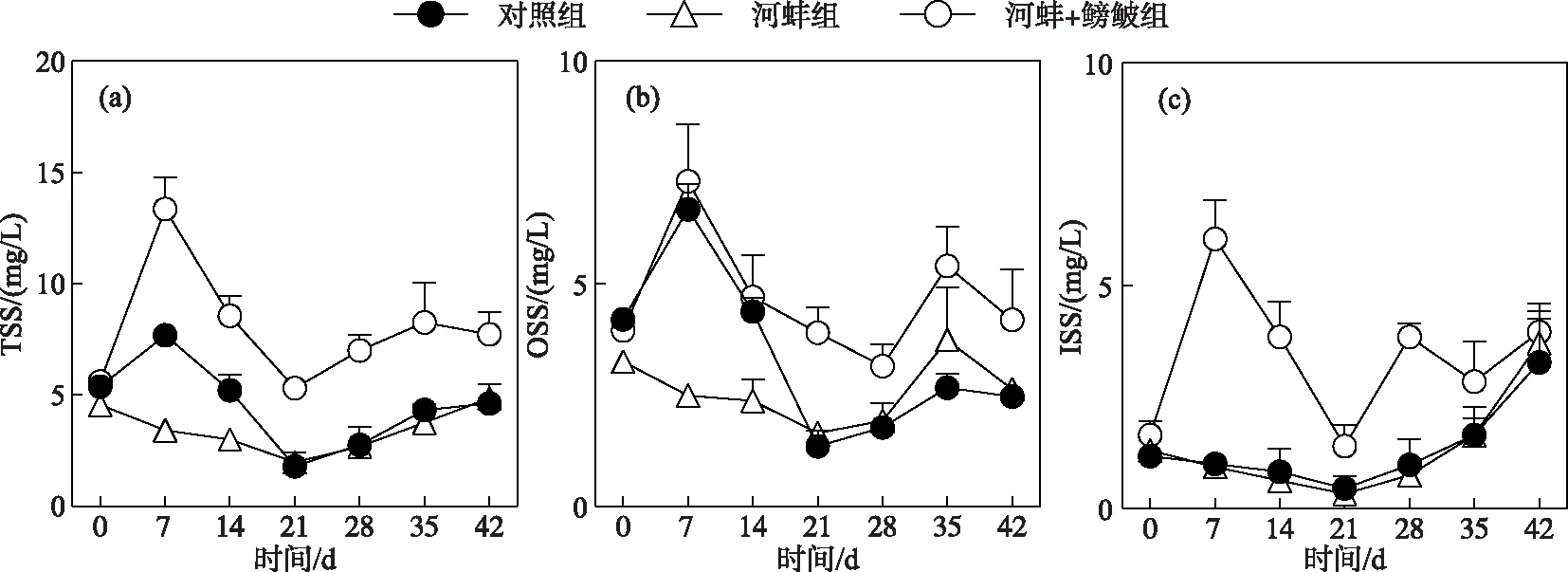
图3 试验期间不同处理组的总悬浮质、总有机悬浮质和总无机悬浮质浓度随时间的变化Fig.3 Concentrations of total suspended solids,organic suspended solids and inorganic suspended solids in different treatments during the experiment
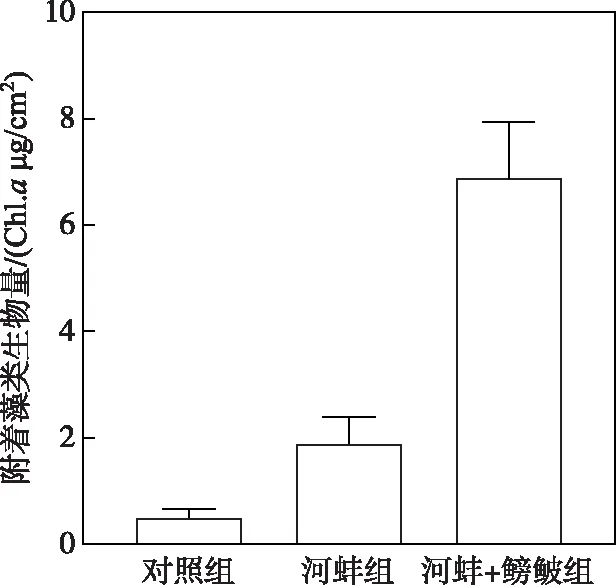
图4 密刺苦草叶片表面附着藻类生物量Fig.4 The biomass of periphyton on the surface of V. denseserrulata
2.4 附着藻类
试验结束时,河蚌组密刺苦草叶片表面附着藻类生物量高于对照组,但两者间的差异不显著(P>0.05);而河蚌+鳑鲏组的附着藻类生物量显著高于河蚌组(P<0.01)(图4).
2.5 密刺苦草
试验结束时,对照组中苦草的RGR略高于河蚌组(P>0.05); 同时,河蚌+鳑鲏组与河蚌组间苦草的RGR差异也不显著(P>0.05,图5a). 河蚌+鳑鲏组的苦草总株数(95±8株)高于河蚌组(82±10株),但差异不显著(P>0.05); 对照组中苦草的平均总株数为86±13株,与河蚌组间的差异不显著(P>0.05,图5b).
河蚌组的苦草根冠比低于对照组(P>0.05); 而鳑鲏的出现,对苦草的根冠比影响不显著,其(河蚌+鳑鲏组)根冠比略低于河蚌组(P>0.05)(图6a). 河蚌+鳑鲏组的苦草最大叶长高于对照组(P>0.05); 河蚌组的最大叶长高于对照组,且差异显著 (P>0.05)(图6b). 此外,对照组的苦草平均单株生物量显著低于河蚌组(P<0.01),但河蚌组与河蚌+鳑鲏组间不存在显著性差异(P>0.05)(图6c).
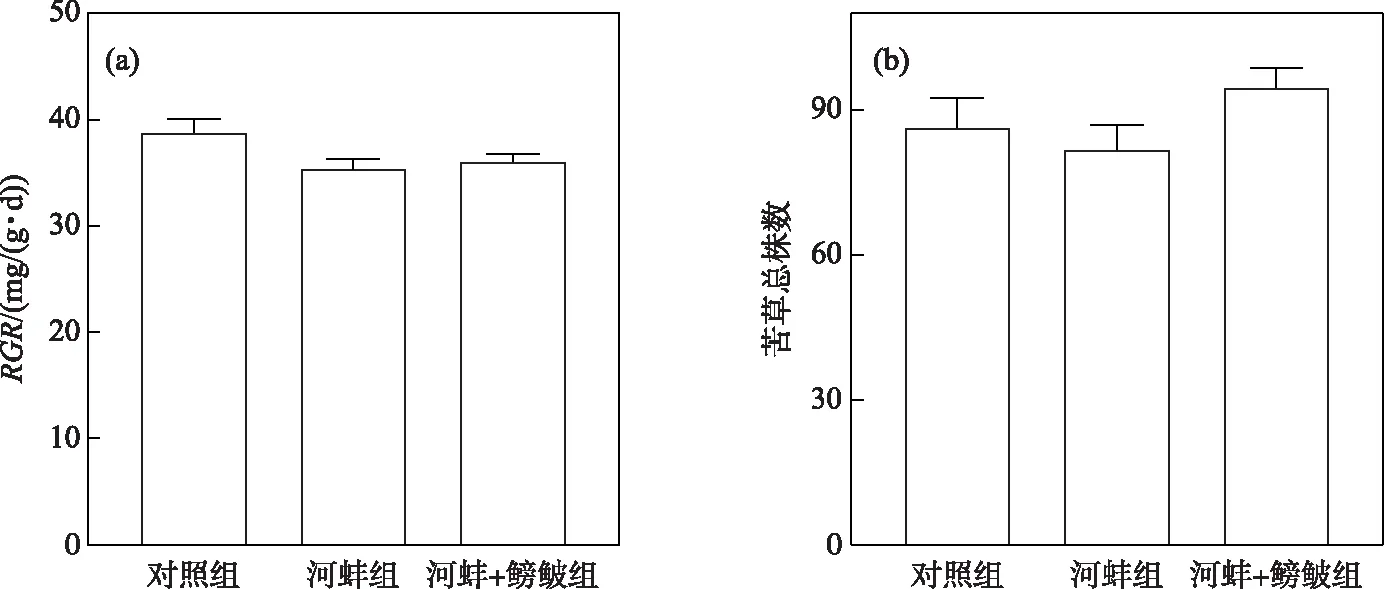
图5 密刺苦草在试验结束时的相对生长率(RGR)和总株数Fig.5 The relative growth rate (RGR) and total plant individuals of V. denseserrulata at the end of the experiment
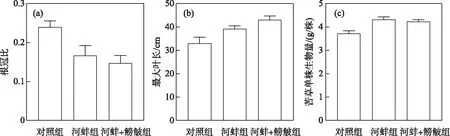
图6 试验结束时密刺苦草的根冠比、最大叶长和单株平均生物量Fig.6 Root-shoot dry biomass ratio,maximum leaf length and mean individual biomass of V. denseserrulata at the end of the experiment
3 讨论
目前关于鳑鲏对水质或生态系统影响的研究相对较少,仅喻倩等[32]通过室内试验报道了高密度鳑鲏(中华鳑鲏)对水质等的影响,发现较高密度鳑鲏可显著增加水体TN、TP和氨氮浓度. 而在我们的中宇宙原位生态系统中,鳑鲏对TP和TDP浓度的影响显著,而对TN和TDN浓度的影响不显著. 这可能与试验系统中存在沉水植物有关: 一方面,由于系统初始的氮浓度相对较低,密刺苦草生长过程中可直接吸收水体营养盐,降低水体营养盐浓度; 另一方面,沉水植物表面的附着物可为硝化和反硝化细菌提供生境,提高水体的脱氮能力[33]. 此外,沉水植物还可通过影响水体pH和溶解氧的浓度,促进氨的挥发[34]. 因此,沉水植物通过直接吸收利用和间接影响氮素的地球化学循环速率等方式,保持系统中较低的氮浓度. 而河蚌+鳑鲏组中较高的磷浓度,可能主要与鳑鲏通过扰动沉积物间接促进沉积物磷释放和直接排泄引起磷浓度有关. 排泄和扰动沉积物是杂食性鱼类影响水体营养盐浓度的主要途径,这些行为在底栖杂食性鱼类中较为常见[23-24,35].
杂食性鱼类通过扰动沉积物,可引起水体悬浮物浓度升高[26,36-37]. 在本研究中,河蚌组的悬浮物浓度一直处于较低水平; 而大鳍鱊的出现则显著增加了TSS浓度,其中OSS和ISS的浓度也显著高于河蚌组. 河蚌+鳑鲏组中OSS浓度的升高,主要由于该组的营养盐(主要是TP和TDP)浓度较高,促进了浮游植物生长,河蚌+鳑鲏组的浮游植物生物量(Chl.a)显著高于其他处理组也佐证了这一点. 此外,浮游动物是鳑鲏的重要食物来源[5,22,38],鳑鲏可能通过降低枝角类等浮游动物的生物量,削弱浮游动物对浮游植物的下行控制,是引起河蚌+鳑鲏组Chl.a浓度显著高于其他两组的原因之一,这也是其他杂食性鱼类影响水体Chl.a浓度的重要途径[23-24,35,39-40]. 大鳍鱊引起ISS浓度升高,说明大鳍鱊可扰动沉积物(ISS浓度通常是用于评价鱼类扰动沉积物强弱的指标),这些影响在试验初期较为明显,而在试验中后期随着密刺苦草生物量不断增加,抑制了鳑鲏对沉积物的扰动作用; 此外,在背角无齿蚌滤食的共同作用下,ISS浓度逐渐下降,并在试验结束时与河蚌组间无显著差异(图3c). 而在大鳍鱊与河蚌共存的试验系统中,河蚌未能有效地抑制鳑鲏引起的水体Chl.a和OSS浓度升高. 这可能主要与本研究中较低的河蚌与鳑鲏生物量比(6.7:1)有关; 当河蚌与鳑鲏的生物量比高于10:1时,河蚌有效抑制了水体Chl.a和OSS浓度的升高(于谨磊,未发表数据).
沉水植物生长与水下光照密切相关,而较高的悬浮质浓度和附着藻类生物量可阻碍沉水植物对光的获取,从而影响沉水植物生长[19,41]. 有研究发现,沉水植物表面附着藻类生物量随着水体营养盐浓度的升高而逐渐增加[39-40]. 在自然湖泊中,研究者发现沉水植物表面附着藻类生物量越高的湖泊,其沉水植物生物量、覆盖度和多样性越低[44]. 而在削减植物表面附着藻类生物量后,植物的光合作用效率明显增加[45]. 在我们的研究中,河蚌组与对照组间的营养盐、悬浮质和Chl.a浓度均无明显差异,即使河蚌组的附着藻类生物量略高于对照组,但并没有抑制河蚌组密刺苦草的生长与种群扩张,其RGR和植物总株数与对照组间无显著性差异(图5). 而河蚌+鳑鲏组的附着藻生物量显著高于其他处理组. 这主要由于河蚌+鳑鲏组的营养盐浓度较高,促进了附着藻的生长,因为附着藻生物量可随营养盐的升高而显著增加[42,46]. 但在试验结束时,鳑鲏的出现未对密刺苦草的RGR和总株数产生显著影响,说明本试验采用的鳑鲏密度在短期内(42天)未对苦草的生长产生显著的负面影响. 而鳑鲏对沉水植物生长的长期影响还需进一步研究.
河蚌显著增加了苦草的单株生物量,说明在植物表面附着较高的藻类生物量时,密刺苦草的生长策略发生了变化. 我们发现密刺苦草主要通过增加叶长和地上部分生物量的方式来应对鳑鲏试验系统内较弱的水下光照条件(较高的Chl.a和TSS浓度),因为河蚌+鳑鲏组的苦草叶片较长而根冠比较低(较高的地上部分生物量). 这可以解释为什么鳑鲏的出现未显著影响密刺苦草的相对生长率. 此外,试验期间系统内的营养盐浓度远远低于文明章等[47]报道的限制苦草生物量和生长率的浓度水平(TN: 10 mg/L和TP: 0.4 mg/L),这可能也是本试验各处理组间苦草RGR差异不显著的另一原因.
本研究结果对浅水湖泊生态修复与生态系统管理具有重要的指导意义. 鳑鲏幼鱼主要以浮游动物为食,而成鱼则主要以沉水植物为食[5]. 在我国的一些亚热带浅水湖泊生态修复中,肉食性鱼类(如鳜和乌鳢)很难控制类似鳑鲏的小型杂食性鱼类的数量[4-5],因为这些肉食性鱼类对小型杂食性鱼类的摄食比例较低[5]. 因此,这些小型杂食性鱼类容易发展成为生态修复湖泊的优势鱼类. 在我们的短期受控试验中(42天),虽然鳑鲏的出现(河蚌+鳑鲏组组)未显著影响密刺苦草的生长和繁殖,但鳑鲏不仅引起水体营养盐和Chl.a浓度升高,而且还促进了植物表面附着藻的生长. 而过多的附着藻将通过遮光效应影响沉水植物生长,因此从湖泊生态修复效果的长效维持角度考虑,过多的鳑鲏可能会进一步加剧植物表面附着藻的生长,阻碍沉水植物生长和种群发展; 此外,虽然鳑鲏可直接摄食沉水植物[5],但由于受口裂大小的限制,可能对不同植物种类或同一种类的不同部位(嫩芽、嫩叶、种子等)表现出较强的选择性,将会直接影响沉水植物生长和种间竞争模式. 因此,在湖泊生态修复中,应加强鳑鲏等小型杂食性鱼类的监测与管理; 并开展进一步研究,评估鳑鲏等小型杂食性鱼类在浅水湖泊生态系统中的地位与作用.
4 结论
1)在密刺苦草为主的系统中,与对照组相比,背角无齿蚌(河蚌组)的出现未显著改变水体营养盐、Chl.a和悬浮颗粒物浓度.
2)河蚌对密刺苦草的生长(RGR)、繁殖(总株数)、根冠比和最大叶长均无显著性影响,而河蚌显著增加了苦草的单株生物量(P<0.01);此外,苦草叶片表面附着藻生物量也高于对照组(但差异不显著,P>0.05).
3)鳑鲏(大鳍鱊)的出现(河蚌+鳑鲏组组),不仅引起试验系统营养盐、Chl.a和悬浮物浓度显著升高,而且还促进了植物表面附着藻的生长,其附着藻生物量显著高于河蚌组.
4)虽然河蚌+鳑鲏组的水体营养盐和植物表面附着藻生物量均显著高于河蚌组,但这并未显著影响密刺苦草的生长和繁殖. 然而从湖泊生态修复效果的长效维持角度考虑,过多的鳑鲏可能会进一步加剧水体营养盐和Chl.a浓度升高,促进植物表面附着藻的生长,通过遮光效应(较高的浮游植物和附着藻类生物量)阻碍沉水植物生长和种群发展. 因此,在湖泊生态修复中,应加强鳑鲏等小型杂食性鱼类的监测与管理; 并开展进一步研究,评估鳑鲏等小型杂食性鱼类在浅水湖泊生态系统中的地位与作用.
致谢: 感谢甄伟和王明飞对受控试验和实验室工作的支持.
——以武汉紫阳湖为例

