新城疫病毒诱导结肠癌Caco2细胞株发生Caspase和p38MAPK依赖性诱凋亡
古丽娜儿, 王思橦, 黄莉莉, 刘竹青, 朱忠政, 许 青
(1. 同济大学附属第十人民医院肿瘤科,上海 200072; 2. 上海市皮肤病医院肿瘤科,上海 200443; 3. 同济大学癌症中心,上海 200072)
结肠癌是消化道系统最常见的恶性肿瘤之一,有着很高的发病率和死亡率[1]。结肠癌的治疗除了传统的手术、化疗、放疗及靶向治疗等之外,最近免疫治疗也成为一个热点[2-3]。溶瘤病毒(oncolytic virus, OVs)疗法是一种直接作用于肿瘤细胞的治疗方法。经遗传修饰的病毒或天然存在的病毒感染肿瘤细胞,选择性在肿瘤细胞中复制,导致肿瘤细胞裂解与死亡。由于溶瘤病毒在肿瘤细胞内选择性复制,并不需要整合到宿主基因中,因此它们作为溶瘤剂安全、有效[4-6]。
新城疫病毒(newcastle disease virus, NDV)属溶瘤病毒的一种,临床前和临床研究显示NDV病毒株具有杀死多种来源的癌细胞的潜力[7]。既往研究证明,NDV/FMW毒株在体外特异性杀伤人肝癌细胞株SMMC7721、肺癌细胞株A549,同时对正常人胚胎肝细胞L-O2、对正常人胚肾细胞HEK293等杀伤率不到1%[8]。NDV/FMW在肺癌[9]、甲状腺癌[10]、黑色素瘤[11]、前列腺癌[12]等多种肿瘤细胞中诱导肿瘤细胞凋亡。丝裂原活化蛋白激酶(MAPK)途径与细胞增殖、分化、迁移、衰老和凋亡有关[13]。MAPK信号通路有3个亚家族,分别为MAPK(细胞外信号调节激酶,ERK)、p38亚家族和JNK。既往研究表明,p38MAPK通路在NDV/FMW诱导的肿瘤细胞凋亡中起重要作用[10]。本研究旨在细胞水平上验证NDV/FMW对结肠癌细胞的凋亡作用及其机制。
1 材料与方法
1.1 实验材料
人结肠癌Caco2细胞株来自中国科学院典型培养物保藏委员会细胞库(上海);鸡胚成纤维DF-1细胞株购自美国ATCC公司;新城疫病毒NDV/FMW毒株(GenBank登记编号: GU564399)由大连医科大学肿瘤干细胞研究院孟松树实验室提供;DMEM培养基、DMEM/F12培养基、0.25%胰酶(Trypsin-EDTA)、胎牛血清(FBS)、双抗(Pen Strep)、表皮生长因子(EGF)、b27均购自Gibco公司;碱性成纤维细胞生长因子(bFGF)购自德国默克公司;抗体: 血凝素-神经氨酸酶蛋白(HN)(鼠)购自Santa Cruz公司;兔抗人半胱氨酸天冬氨酸特异性蛋白酶3(cysteinylaspartate specific protease, Caspase3)、兔抗人poly ADP-ribose polymerase(PARP)、兔抗人p38、兔抗人磷酸化p38(p-p38)、兔抗人JNK、兔抗人p-JNK均购自CST公司;兔抗人Erk1/2、兔抗人p-Erk1/2、泛胱天蛋白酶肽抑制剂Z-VAD-FMK购自Promega公司;多克隆β-actin(鼠)购自Sigma-Aldrich公司;羊抗兔二抗购自Proteintech公司;羊抗鼠二抗购自Bioworld公司;p38MAPK抑制剂SB203580购自Calbiochem公司;JNK MAPK抑制剂SP600125购自Selleck公司;Cell Counting Kit-8(CCK-8)试剂盒购自Med Chem Express公司;细胞凋亡-Hoechst染色试剂盒(Hoechst 33258染色液)购自碧云天公司。
1.2 细胞培养
人结肠癌Caco2细胞株、DF-1细胞株均用含10%胎牛血清、1%双抗的DMEM培养基培养。细胞置于37℃、5% CO2饱和湿度培养箱中按照常规方法培养。
1.3 病毒滴度测定
取对数生长的Caco2细胞,胰酶消化,细胞计数铺板,用感染复数(multiplicity of infection, MOI)为0.01的NDV/FMW感染Caco2细胞株,分别于24、48、72h时收集上清液,-80℃反复冻融3次后进行梯度稀释,用病毒液感染DF-1细胞进行病毒滴度测定,病毒感染第2天起观察细胞形态变化,连续培养7d,统计每列病变孔直至不再出现病变孔,根据Reed-Muench法计算病毒滴度。
1.4 CCK8检测细胞存活率
将Caco2细胞接种到96孔板,分为5个实验组和对照组,每组设6个复孔。各实验组分别用MOI为0.001、0.01、0.1、1、2、3、5、10的NDV/FMW感染细胞1h后,更换1% DMEM培养基,将96孔板置于培养箱继续培养24、48h,待培养时间结束后向待测孔加入10μL/孔的CCK8溶液,将细胞培养板放回培养箱中继续孵育4h。用酶标仪测定在450nm处的吸光度(A450),并计算分析。
1.5 细胞成球培养
成球培养液配置: 无血清DMEM/F12(50mL)+20ng/mL bFGF+20ng/mL EGF+b27(1∶50)。
2D细胞消化后,完全培养液重悬,离心5min(室温,离心半径13.5cm, 1000r/min),去上清液;DMEM/F12培养液重悬,再次离心5min(室温,离心半径13.5cm, 1000r/min),去上清液;成球培养液重悬细胞,细胞计数后,1000/孔铺于96孔低黏附板内,置于37℃、5%CO2下连续培养7d,待细胞成球。
1.6 Hoechst 33258荧光染色观察细胞形态学改变
种植Caco2细胞于6孔板内,调整细胞密度为4×105个/孔,待细胞贴壁后用MOI为1的NDV/FMW感染细胞48h;取出细胞加入500μL/孔固定液固定10min、磷酸盐缓冲液(PBS)清洗3遍;再加入500μL/孔Hoechst 33258染色液染色5min、PBS清洗3遍;最后滴一滴抗荧光猝灭封片液在载玻片上,盖上贴有细胞的盖玻片、避光、倒置荧光显微镜下观察细胞凋亡形态学改变。
1.7 Western印迹法
Caco2细胞株100万/皿接种在60mm细胞皿内,分别设空白对照组与NDV/FMW感染实验组,实验组用MOI为1的NDV/FMW感染1h后,更换1% DMEM培养基继续培养。NDV/FMW感染12、24、48h后收集细胞裂解液,考马斯亮蓝法测定裂解液中的蛋白浓度。取20μg蛋白用10%的分离胶和4%浓缩胶进行SDS-PAGE电泳,转膜,4% BSA常温封闭2h,孵育一抗兔抗人Caspase3抗体4℃过夜,TBST洗膜后常温孵育二抗2h,TBST洗膜、显色、用凝胶成像仪显影,观察Caspase3蛋白及其磷酸化裂解片段cleaved-Caspase3蛋白表达情况。其他蛋白表达水平检测方法同上。
1.8 统计学方法
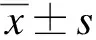
2 结 果
2.1 NDV/FMW在结肠癌Caco2细胞内复制
用MOI为0.01的NDV/FMW感染Caco2细胞24、48、72h后,病毒滴度随时间增加逐渐增加(图1A)。MOI为1的NDV/FMW病毒感染细胞24、48、72h后,Western印迹法检测HN蛋白(NDV/FMW的基因组蛋白之一)表达水平随时间增加而增加(图1B),提示NDV/FMW在Caco2细胞株中可以有效复制。

图1 NDV/FMW在Caco2细胞株中有效复制Fig.1 NDV/FMW effectively replicated in Caco2 cellsA: 病毒滴度法检测NDV/FMW在Caco2细胞内的复制,MOI=0.01;B: Western印迹法检测NDV/FMW病毒蛋白HN表达情况,β-actin为内参蛋白
2.2 NDV/FMW降低Caco2细胞的存活率
NDV/FMW感染2D培养Caco2细胞24、48h后,CCK8检测结果显示随着MOI值升高和感染时间增加细胞存活率逐渐降低(P<0.001),见图2A。在体外环境中,细胞成球被认为时模拟肿瘤体内生物学特性的有效模型。1个MOI值的NDV/FMW感染3D培养Caco2细胞24、48h后,与对照组相比NDV/FMW感染细胞不能二次成球,显著降低3D培养Caco2细胞的存活率(图2B)。
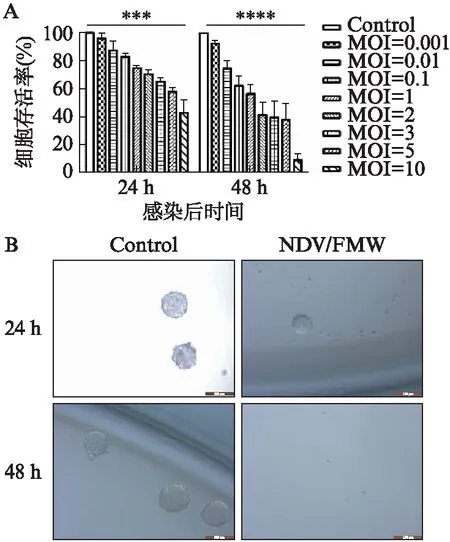
图2 NDV/FMW降低Caco2细胞株的存活率Fig.2 NDV/FMW reduced cell viability of Caco2 cellsA: NDV/FMW感染2D培养Caco2细胞24、48h后,CCK8法检测细胞存活率逐渐降低,***P<0.001,****P<0.0001;B: 经NDV/FMW感染3D培养的Caco2细胞24、48h后,病毒感染组细胞不能二次成球
2.3 NDV/FMW诱导Caco2细胞发生Caspase依赖性凋亡
经Hochest33258染色采用倒置荧光显微镜观察细胞形态变化,病毒感染组较空白对照组细胞绿色荧光明显增加细胞呈凋亡形态学改变(图3A)。用MOI=1的NDV/FMW感染Caco2细胞12、24、48h后(分别设置空白对照组),Western印迹法检测凋亡相关蛋白变化。Western印迹法检测结果显示在病毒感染细胞后48h时,裂解的Caspase3(cleaved-Caspase3)和裂解的PARP(cleaved-PARP)蛋白表达水平明显增加(图3B)。采用泛Caspase抑制剂Z-VAD-FMK预处理细胞后,再用NDV/FMW(MOI=1)感染细胞48h,与仅感染病毒组相比,Z-VAD-FMK降低了病毒感染细胞中cleaved-Caspase3和cleaved-PARP表达水平(图3C),结果表明NDV/FMW诱导Caco2细胞凋亡,并且NDV/FMW诱导细胞凋亡依赖于Caspase。
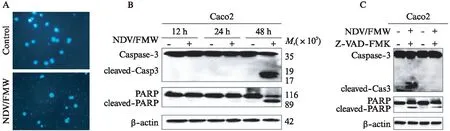
图3 NDV/FMW诱导Caco2细胞凋亡Fig.3 NDV/FMW induced apoptosis in Caco2 cellsA: Hoechst33258染色后,荧光显微镜下(×200)观察NDV/FMW(MOI=1,48h)处理Caco2细胞形态学改变;B: Western印迹法检测细胞裂解的Caspase和PARP条,β-actin作为内参;C: Z-VAD-FMK(25μM)预处理Caco2细胞,Western印迹法检测裂解的Caspase和PARP蛋白,β-actin作为内参
2.4 NDV/FMW调控p38MAPK信号通路
为了进一步探究NDV/FMW诱导结肠癌细胞凋亡的分子机制,检测了MAPK下游信号通路蛋白p38、Erk1/2、JNK的活化。经NDV/FMW病毒感染Caco2细胞12、24、48h后,Western印迹法检测结果显示,NDV/FMW感染后p38MAPK通路明显活化;病毒感染24、48h后磷酸化的JNK蛋白水平亦增加;然而,Erk1/2没有明显变化(图4A)。
NDV/FMW可能通过促进p38MAPK和JNK MAPK信号通路的活化而诱导细胞凋亡。进一步为了明确p38MAPK和JNK MAPK信号通路在NDV/FMW诱导结肠癌Caco2细胞凋亡中的作用,利用p38MAPK特异性抑制剂SB203580和JNK MAKP抑制剂SP60015预处理细胞30min后,NDV/FMW感染细胞48h,检测凋亡相关蛋白表达水平。Western印迹法检测结果显示,SB203580预处理组凋亡蛋白Caspase3及PARP裂解片段表达水平较仅NDV/FMW感染组显著减少,与对照组相比,p38MAPK抑制剂SB203580处理组明显减少了NDV/FMW引起的细胞凋亡;SP60015预处理后凋亡蛋白Caspase3和PARP裂解片段增加与NDV/FMW感染组没有明显变化(图4B)。提示p38MAPK参与NDV/FMW诱导结肠癌细胞凋亡,而不是JNK MAPK通路。
图4 NDV/FMW调控p38MAPK信号通路Fig.4 NDV/FMW regulated p38MAPK signaling pathwayA: NDV/FMW(MOI=1)感染Caco2细胞12、24、48h后,Western印迹法检测p38、JNK、Erk1/2及磷酸化p38、JNK、Erk1/2 蛋白水平,β-actin作为内参;B: SB203580和SP600125预处理30min后,NDV/FMW(MOI=1)感染Caco2细胞48h,Western印迹法检测PARP、Caspase3蛋白水平,β-actin作为内参
3 讨 论
目前已开展多项基于溶瘤病毒NDV治疗肿瘤的临床试验。实际上,根据统计2017年已有78项溶瘤病毒应用相关临床试验已被注册,癌种包括多种实体瘤。但在结肠癌中的研究多数停留在Ⅰ/Ⅱ期临床研究[14-15],虽然有Ⅲ期的临床试验研究报道了NDV的抗肿瘤作用,这些报道多是关于NDV对结肠癌转移瘤的抗肿瘤作用,或者NDV作为佐剂的作用[16-17]。前期研究已证明新城疫病毒FMW毒株NDV/FMW在肺癌[9]、甲状腺癌[10]、黑色素瘤[11]、前列腺癌[12]等多种肿瘤细胞中的直接溶瘤作用。
本实验结果证明,NDV/FMW感染2D培养Caco2细胞24、48h后,随着MOI值升高和感染时间增加细胞存活率逐渐降低。实验用MOI=1的NDV/FMW感染Caco2细胞48h后,经Hoechst33258荧光染色检测,病毒感染后Caco2细胞株绿色荧光明显增加,NDV/FMW可能促进其发生凋亡。为了明确NDV/FMW是否诱导结肠癌上述细胞株凋亡,本研究采用Western印迹法检测NDV/FMW感染后Caco2细胞中凋亡相关Caspase3、cleaved-Caspase3和PARP、cleaved-PARP蛋白表达水平。实验结果显示,MOI=1的NDV/FMW感染48h条件下,Caco2细胞株NDV/FMW感染组Caspase3、PARP蛋白表达水平显著降低,cleaved-Caspase3、cleaved-PARP蛋白表达水平显著增加,提示NDV/FMW诱导Caco2细胞株凋亡。
肿瘤干细胞(cancer stem cells, CSCs)通过自我更新和分化能力维持着肿瘤的无限增殖,从而影响肿瘤的发生、发展以及转移[18]。研究发现,CSCs对化疗或放疗具有原发耐药性[19-20]。CSCs在体外形成多细胞3D球,可在无血清培养条件下成长[21]。在体外环境中,肿瘤细胞成球被认为是模拟肿瘤体内生物学特性的有效模型。本研究通过体外3D培养Caco2细胞株,在MOI=1的NDV/FMW感染细胞球24、48h条件下,NDV/FMW抑制结肠癌细胞球二次成球能力。实验结果证明,NDV/FMW在体外对3D培养Caco2细胞株具有潜在溶瘤能力。
NDV的溶瘤机制包括多种途径,其中一个途径就是通过促进肿瘤细胞凋亡引起溶瘤作用,NDV通过内在线粒体途径和外在死亡途径诱导肿瘤细胞凋亡,这两种途径都会转化为Caspase的级联激活[22]。本实验采用泛Caspase抑制剂Z-VAD-FMK预处理细胞后,与仅感染病毒组相比,Z-VAD-FMK降低了病毒感染细胞中cleaved-Caspase3和cleaved-PARP表达水平,提示NDV/FMW诱导细胞凋亡依赖于Caspase。
p38MAPK信号通路的活化有赖于苏氨酸和酪氨酸双位点的同时磷酸化,正常情况下ATP提供磷酸化所需的磷酸基团,而p38MAPK抑制剂SB203580与ATP竞争作用于p38 ATP结合活性位点Thr106,使p38不能与ATP结合,从而失去激酶活性[23-24]。既往研究发现p38MAPK通路在NDV/FMW诱导肺癌细胞凋亡中起重要作用[25]。在实验中,NDV/FMW感染细胞中磷酸化p38较对照组增加,p38抑制剂SB203580预处理组细胞中PARP及Csapase3裂解片段蛋白表达水平较仅病毒感染组显著减少,提示NDV/FMW诱导Caco2细胞依赖于p38MAPK通路,p38MAPK通路参与NDV/FMW引起的结肠癌细胞凋亡。
本研究在细胞水平上验证NDV/FMW对Caco2细胞株有促进Caspase依赖性细胞凋亡作用,还进一步证明p38MAPK通路在NDV/FMW诱导的结肠癌细胞凋亡中起重要作用,为NDV对结肠癌细胞的溶瘤潜力及其机制提供了理论依据。本研究观察了NDV对结肠癌细胞的作用,后续有待开展动物体内试验,以进一步明确NDV在结肠癌治疗中的应用价值。

