酱油酿造用耐盐产乙醇风味酵母的选育及其应用
吕变梅,蒋雪薇,2,,彭 东,徐晓刚,丁 源,罗晓明,2,周尚庭
(1.长沙理工大学化学与食品工程学院,湖南 长沙 410114;2.湖南省调味品发酵工程技术研究中心,湖南 长沙 410600;3.加加食品集团股份有限公司,湖南 长沙 410600)
酱油是以大豆和小麦为主要原料,经过微生物及其酶系长期作用,最终形成具有特殊色泽和独特酱香的传统调味品[1]。酱油风味的形成是米曲霉、乳酸菌及酵母菌等多菌种相互作用的结果,其中酵母菌在发酵过程中产生的酯类、醇类等物质,对酱油风味的形成具有十分重要的贡献[2]。目前应用于酱油发酵的酵母菌主要有鲁氏接合酵母(Zygosaccharomyces rouxii)、球拟酵母(Torulopsisspp.)和假丝酵母(Candidaspp.),其中鲁氏接合酵母与球拟酵母应用最广[3]。鲁氏接合酵母是酱油酿造中后期风味形成的重要菌株之一,它在酱油发酵中可以提升乙醇、高级醇及芳香杂醇类物质的含量[4]。
酱油挥发性风味物质的研究中,乙醇作为一种常见的香气成分被检出,其特殊香味对酱油风味有重要影响,且能与酸类物质结合,生成各种风味物质及风味物质的前体,对酱油色泽风味的形成以及改善酱油品质发挥着重要的作用[5]。蔡金星等[6]研究发现,乙醇的存在对酱油的风味和色泽都有明显影响,同时,一定量乙醇的存在有利于酱油保存[7]。日式酱油发酵研究发现,提高乙醇含量有利于提升酱油品质[8]。目前对于酱油中挥发性香气成分乙醇的研究主要集中在检测含量[9]及菌种添加引起的风味成分变化[10],而改良耐盐产乙醇菌种以获得较好的乙醇产量并进行应用研究报道较少。本研究利用紫外诱变鲁氏接合酵母L6选育得到1 株优良的耐盐产乙醇酵母L6-1,研究其在高盐稀态发酵中的应用,通过跟踪分析发酵酱醪中乙醇积累量与挥发性风味物质的变化,确定添加产乙醇酵母对酿造酱油品质的提升作用,以期为耐盐产乙醇风味酵母在酱油酿造中的应用提供理论支持。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
出发菌株:鲁氏接合酵母L6,筛选自湖南某酱油厂的高盐稀态酱醪中,由湖南省调味品发酵工程技术研究中心(长沙理工大学分中心)保藏。
1.1.2 培养基
豆芽汁培养基配制参照文献[11]。
2,3 ,5 -氯化苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)筛选双层培养基,上层培养基:葡萄糖5 g、琼脂粉15 g、TTC试剂0.5 g,1 000 mL蒸馏水,121 ℃灭菌15 min;下层培养基:葡萄糖10 g、蛋白胨2 g、酵母膏1.5 g、MgSO4·7H2O 4 g、K2HPO41 g、琼脂粉20 g,1 000 mL蒸馏水,调节pH 5.6~5.8,121 ℃灭菌15 min。
1.2 仪器与设备
UV1800紫外-可见分光光度计 日本岛津公司;ZWY-2102C恒温振荡培养箱 上海智城分析仪器制造有限公司;PE28型pH计 梅特勒-托利多仪器(上海)有限公司;YRE2000B旋转蒸发仪 巩义市予华仪器有限责任公司;436GC/EVOQ TQ/PAL气相色谱-质谱联用仪美国布鲁克科技有限公司;Rxi-5Sil MS色谱柱 瑞思泰康科技(北京)有限公司;65 μm PDMS/DVB固相微萃取针 美国色谱科公司。
1.3 方法
1.3.1 紫外诱变致死率曲线的测定
将菌种接种至含质量分数10% NaCl的豆芽汁液体发酵培养基中,28 ℃、180 r/min培养24 h,取菌悬液,离心洗涤3 次后制成108个细胞/mL的菌悬液备用;吸取10 mL菌悬液于功率15 W紫外灯下,距离45 cm照射0、30、60、90、120、180、240 s后分别取样稀释涂平板,28 ℃避光培养48 h后计数,绘制致死率曲线[12]。致死率计算如式(1)所示:

1.3.2 突变株筛选
诱变后的菌悬液涂于TTC筛选平板的下层培养基,28 ℃恒温培养48 h后,倒入TTC上层培养基,30 ℃避光保温2~3 h。挑选TTC上层平板中显色深的菌株,接入含10% NaCl的豆芽汁液体培养基中,28 ℃、180 r/min培养24 h,再在28 ℃恒温培养箱中静置培养48 h后,测定乙醇含量。
1.3.3 生长曲线的测定
将鲁氏接合酵母L6与诱变后筛选的突变株L6-1分别接种于含10% NaCl的豆芽汁液体培养基中,28 ℃、180 r/min培养,在0~48 h每隔2 h取样测OD570nm,绘制生长曲线。
1.3.4 高盐稀态酱醪发酵工艺
按成品曲-盐水1∶2(质量比)拌入质量分数23%的盐水,制备16% NaCl的盐卤发酵醪,置于28 ℃保温发酵,将出发菌株及选育菌株制备成浓度为107个细胞/mL的菌悬液,分别加入发酵25 d的酱醪中,接种量为5%(体积分数),28 ℃继续恒温发酵65 d,总发酵周期90 d,未添加酵母菌的为对照组。分别在发酵第0、15、30、45、60、75、90天取酱醪压榨酱油,测定还原糖、总酸、氨态氮、乙醇含量。
1.3.5 分析方法
1.3.5.1 乙醇含量测定
参照GB 5009.225—2016《酒中乙醇浓度的测定》的密度瓶法[13]。
1.3.5.2 发酵酱油理化指标测定
还原糖含量测定参照GB/T 5009.7—2016《食品中还原糖的测定》[14];总酸含量测定参照GB/T 5009.39—2003《酱油卫生标准的分析方法》[15];氨态氮含量测定参照GB 18186—2000《酿造酱油》的甲醛法[16]。
1.3.5.3 高盐稀态发酵酱油中挥发性风味物质分析
样品准备:取成品酱油,添加5 μL质量浓度为0.816 μg/μL的2-甲基-3-庚酮作为内标物,总体积为2 mL[17]。固相微萃取条件:振荡器50 ℃,将酱油样品加热振荡25 min。气相色谱条件:进样口温度250 ℃,程序升温,40 ℃保持2 min,以5 ℃/min升温至120 ℃,保持2 min,再以10 ℃/min升温至230 ℃,保持5 min;载气为高纯氦气,流速1.2 mL/min,分流比10∶1。质谱条件:电子电离源,电子能量70 eV,发射电流200 μA,离子源温度250 ℃,质量扫描范围m/z30~500。挥发性化合物定量计算如式(2)所示:

式中:C1为挥发性化合物含量;C2为内标物含量;A1为挥发性化合物峰面积;A2为内标物峰面积。
1.4 数据处理
利用主成分分析对风味物质进行分析,使用SPSS软件处理数据[18],利用Origin 9.0进行数据可视化处理分析。
2 结果与分析
2.1 出发菌株的紫外诱变及乙醇高产菌株的筛选
鲁氏接合酵母是耐高渗透压酵母[19],能在高盐环境下生长,可利用原料降解产生的还原糖代谢产生乙醇[20]。前期从高盐稀态发酵酱醪中筛选出1 株耐盐鲁氏接合酵母L6,其在含10% NaCl豆芽汁培养基中的乙醇积累量(体积分数)为1.75%,有一定的产乙醇能力,适合作为选育耐盐产乙醇酵母的出发菌株。
紫外诱变是物理诱变中最为简便安全的诱变剂,在选育中常作为诱变因子[21]。采用不同的照射时间处理制备好的菌悬液,绘制致死率曲线,结果见图1。研究发现,正突变往往出现在致死率较低的情况下,选择致死率70%~80%的诱变条件处理菌株,除能获得较高的正突变率外,还比较易于筛选[22],从图1可以看出,致死率为70%~80%时,诱变处理时间为60~90 s,选择诱变时间90 s,处理出发菌株L6,诱变后的菌悬涂布于TTC双层平板,筛选获得54 株生长良好、显色明显的突变菌株。
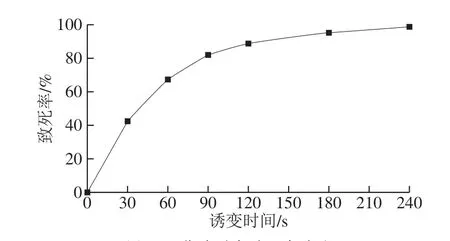
图1 紫外诱变致死率曲线Fig.1 Lethality of UV mutagenesis

图2 耐盐产乙醇突变株的筛选结果Fig.2 Results of screening for ethanol-producing mutants
TTC是一种无色显色指示剂,能与酵母菌无氧呼吸代谢产生乙醇过程中被乙醇脱氢酶脱掉的氢结合,还原成红色的1,3,5-三苯甲臜,因此通过呈色的深浅可以判断出乙醇脱氢酶活力大小及产乙醇能力的高低,颜色越深,说明产乙醇能力越强[23]。TTC显色筛选平板如图2a(红色圈标注出的为显色深的菌落),对比54 个显色明显的菌株,选出显色较深的15 株,豆芽汁发酵测定乙醇积累量,结果见图2b。可以看出,突变株1、4、7、8、12乙醇积累量均高于出发菌株L6,将其分别命名为L6-1、L6-4、L6-7、L6-8和L6-12,其中L6-1的乙醇积累量最高,为2.71%,较出发菌株提高54.86%,经5 次传代及保藏,其在10% NaCl的豆芽汁培养基发酵中乙醇积累量平均为2.48%,具有良好的遗传稳定性,可以应用于酱油发酵中。
2.2 突变株L6-1与出发菌株L6性能比较
在高盐条件下,菌株的生长性能往往会发生一些变化,如迟缓期延长、对数期生长速率降低等。为研究L6-1和L6的生长性能,分别测定其在10% NaCl豆芽汁培养基中的生长曲线,结果见图3a。10% NaCl质量分数下,L6-1和L6同时进入和结束对数期,生长周期一致,但是L6-1菌体浓度稍高于L6。由图3b可知,当NaCl质量分数由5%升高到16%时,L6-1和L6活菌数均下降104CFU/mL,NaCl质量分数为5%~14%的培养条件下,L6-1活菌数高于L6,而NaCl质量分数为16%的培养条件下,L6活菌数则超过L6-1,但相差不大,突变株L6-1具有较好的耐盐能力,适合应用到酱油发酵中。接种L6-1和L6到不同NaCl质量分数的豆芽汁培养基中,发酵72 h测定乙醇积累量,结果见图3c。随着NaCl质量分数升高,乙醇积累量呈下降趋势,与活菌数变化趋势相符,说明在液体培养基中活菌数直接影响了乙醇的积累,5%~14%的NaCl质量分数下L6-1相比L6产乙醇能力明显增强,有应用于酱油发酵的潜力。
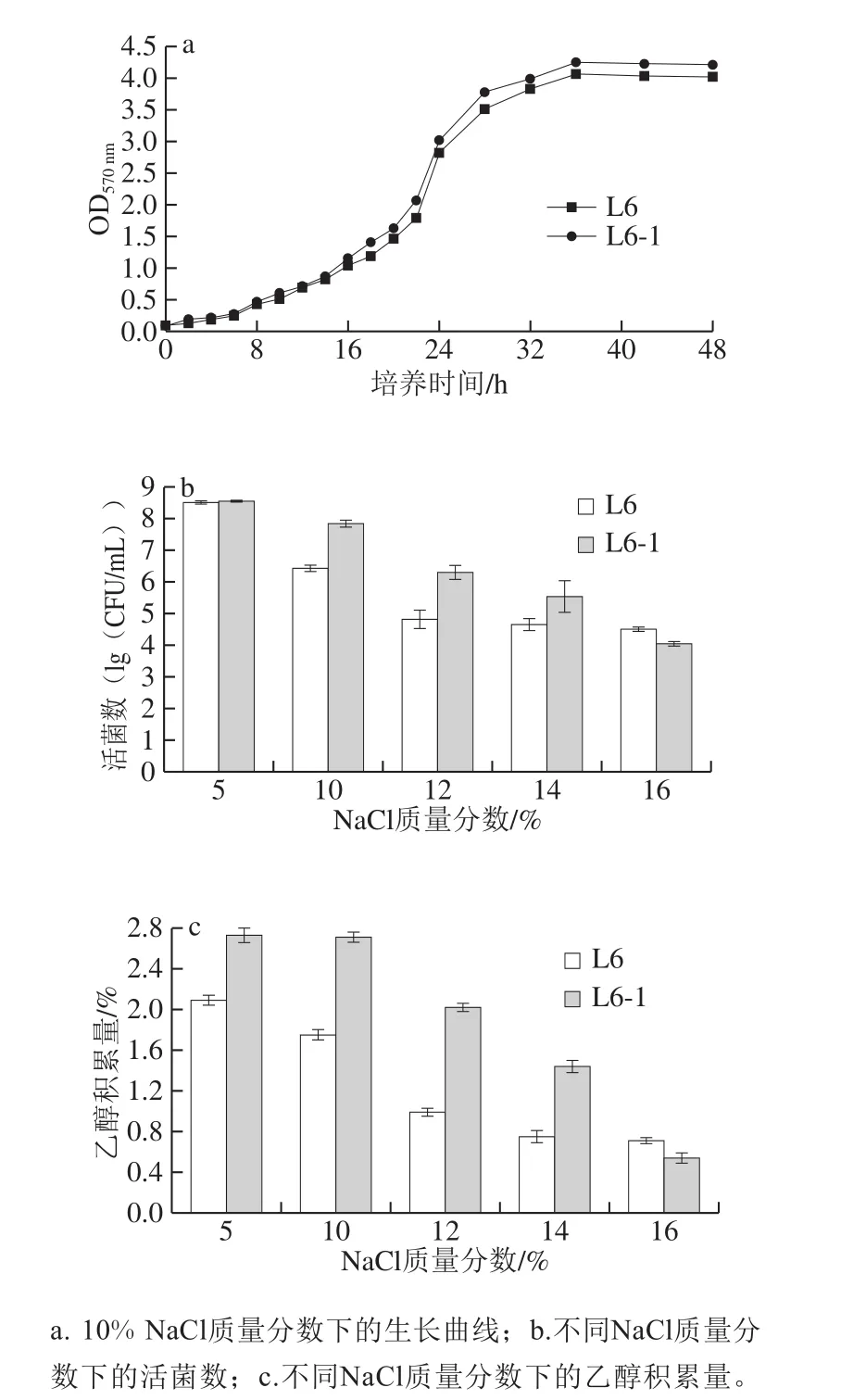
图3 L6与L6-1性能比较Fig.3 Comparison of growth and fermentation performance of L6 and L6-1
2.3 L6-1在高盐稀态发酵酱油酿造中的应用
2.3.1 添加L6-1对高盐稀态发酵酱油乙醇含量及理化指标的影响
鲁氏接合酵母为醇香型酵母,可在pH 5.0~6.0的环境中生长,主要作用于酱油发酵前期,这个阶段主要是原料降解、乳酸菌产乳酸、鲁氏接合酵母进行乙醇发酵,过高或过低添加浓度都不利于乙醇的产生及酱油风味的形成[24]。酱醪发酵开始时pH值为6.5~7.0,发酵到25 d,pH值下降为5.5~6.0,有利于鲁氏接合酵母的生长及代谢,因此发酵25 d作为添加时间。前期预备实验发现,采用菌悬浓度107个细胞/mL、接种量5%能获得较好的发酵效果,采用发酵至第25天的酱醪以上述菌悬浓度及接种量接种L6-1及L6,研究发酵酱醪中随时间而变化的乙醇积累量及各项理化指标。
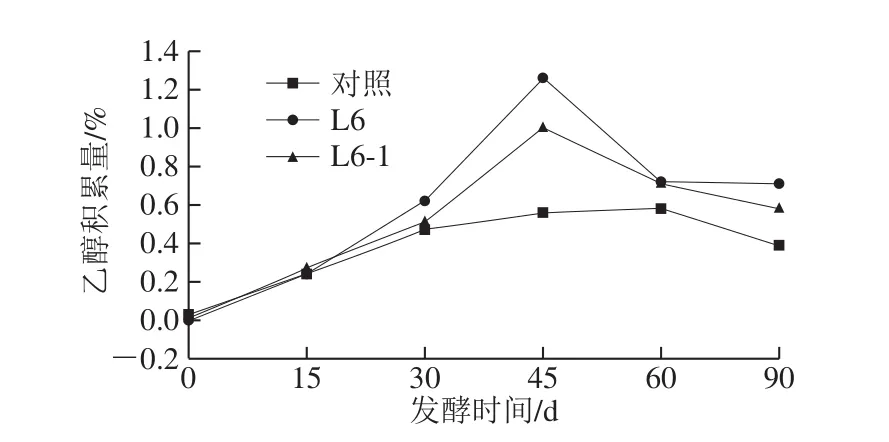
图4 高盐稀态发酵酱醪中乙醇积累量的变化Fig.4 Variations in ethanol content during high-salt liquid-state fermentation of soy sauce
酱油中的乙醇主要是由酵母菌厌氧发酵产生,乙醇能赋予酱油特有的醇香风味,并且为乙酯类风味物质的形成奠定基础,完善酱油的风味体系,同时还可抑制杂菌生长,有利于酱油的保存,因此酱油中乙醇含量是评价酿造酱油品质的重要指标之一[25]。如图4所示,酱醪发酵25 d添加L6-1及L6,发酵进行到45 d,乙醇积累量分别为1.00%、1.26%,分别比对照组提高78.57%、125%。发酵进行到90 d,L6-1和L6的乙醇积累量分别降到0.58%、0.71%,分别高于对照组48.72%、82.05%。L6和L6-1对酱醪中的乙醇含量均有明显提升作用,L6在高盐稀态酱醪(16% NaCl)中发酵积累乙醇的能力比其突变株L6-1强,这与两株菌在16% NaCl的豆芽汁培养基中表现一致,可见,在高盐环境中,突变株L6-1的生长能力弱于出发菌株L6,从而厌氧代谢产物乙醇的积累量略少;另外,L6-1乙醇积累量小于L6也可能是其生成的部分乙醇被进一步用于合成乙酯类物质,需要进一步研究乙酯类挥发性风味物质。
酱油发酵的理化指标主要有还原糖、总酸、氨态氮含量,其中氨态氮含量是酱油的分级标准,而总酸含量也是判断酱油质量的重要指标。酱油发酵中还原糖含量的变化能够反映淀粉的降解与微生物消耗还原糖之间平衡的结果,总酸是发酵过程中微生物分解糖类底物而生成的各种有机酸,氨态氮由水解蛋白质生成,氨态氮含量能够显示酿造酱油的呈味能力和发酵水平[26]。在发酵25 d的酱醪中接种L6-1、L6,对酱醪中还原糖、总酸和氨态氮含量进行分析。由图5a可知,发酵0~15 d,由于淀粉酶分解碳水化合物,生成低聚糖及葡萄糖等,还原糖呈上升趋势,之后还原糖作为主要碳源被代谢生成乙醇、高级醇与有机酸等物质,其含量开始下降,添加L6-1的酱醪还原糖含量比添加L6下降速率更快;由图5b可知,发酵0~15 d,总酸含量迅速上升,随后增速变缓,发酵60 d,总酸达到最高后开始下降,这一阶段是有机酸类物质与乙醇等醇类物质成酯的时期,酱香在这一阶段开始形成,75 d后由于芽孢杆菌等细菌的作用,总酸又出现了小幅升高,整个发酵过程中总酸质量浓度均未超过25 g/L,符合酿造酱油标准;由图5c可知,发酵0~30 d是米曲霉蛋白酶的主要作用时期,蛋白酶水解蛋白质使氨态氮含量上升,45~75 d由于美拉德反应及微生物作用,游离氨基酸被消耗,氨态氮含量下降,75 d以后,由于细菌的作用,氨态氮含量略有升高,从发酵30 d开始,酱油氨态氮含量开始保持在7 g/L以上,达到一级酿造酱油的标准。总体而言,添加L6-1及L6发酵均有利于还原糖降解,在积累乙醇的同时对酿造酱油重要指标总酸及氨态氮的影响较小。
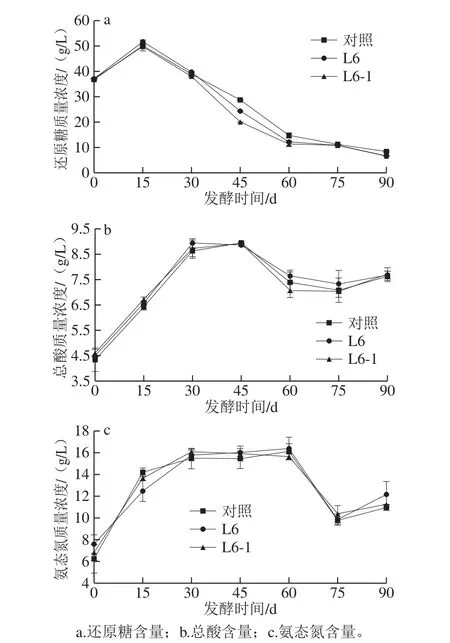
图5 高盐稀态发酵酱醪中理化指标的变化Fig.5 Variations in physicochemical indicators during high-salt liquid-state fermentation of soy sauce
2.3.2 添加L6-1对高盐稀态发酵酱油挥发性风味物质的影响
耐盐产乙醇酵母对酱油风味的形成发挥着关键作用,可在代谢过程中利用糖类等物质代谢产生乙醇、高级醇、芳香杂醇以及酮、酚等物质,醇类物质可进一步与酸类物质形成酯类香气成分[27]。挥发性物质成分是微生物综合作用的结果,也是衡量酱油品质的重要指标之一[28]。采用固相微萃取-气相色谱-质谱联用分析样品中挥发性物质成分,结果见图6及表1。

图6 高盐稀态发酵酱油挥发性风味物质种类Fig.6 Numbers of volatile components in HLF soy sauces
发酵结束时,对照组和添加L6-1与L6发酵组的物质种类数分别为37、47、27 种。如图6所示,添加L6-1的发酵酱油中酯类物质、醇类物质(不含乙醇)、醛类物质、酚类物质、酮类物质、酸类物质分别为17、14、5、4、4、1 种,分别比L6添加组多2、10、4、1、3、0 种。内标法定量分析计算各物质的含量,结果见表1,可以看出L6-1、L6、对照组的发酵酱油中醇类含量分别为1 507.87、1 743.72、1 177.63 ng/g,L6-1添加组与L6添加组分别较对照组提高28.04%、48.07%;虽然添加L6-1发酵酱油醇类物质总含量比添加L6酱油低,但添加L6-1的酱油中醇类物质种类更加丰富;酯类物质种类分别为17、15、17 种,含量分别为828.72、583.72、518.56 ng/g,L6-1添加组与L6添加组在酯类物质种类差别不大的情况下,其含量分别较对照组提高59.81%、12.57%,其中L6-1添加组乙酯类物质含量最高,为605.64 ng/g,比添加L6及对照组的发酵酱油分别提高6.79%及20.61%。结合其乙醇积累量的变化可知,L6-1积累的乙醇部分被用来合成乙酯类挥发性风味物质,增加了酱油香气的丰富度,因此添加L6-1有利于酱油香气成分的多样性。
结合表1可知,醇类物质中,具有玫瑰花香的苯乙醇在3 种发酵酱油中都有检测到,添加L6-1发酵酱油中含量最高为1 217.78 ng/g,分别比对照组与添加L6的发酵酱油高出52.57%、9.21%,有肉汤香的3-甲硫基丙醇在对照组与添加L6-1的酱油中都有检测到,具有蘑菇香的3-辛醇、常用作食用香料的二异丁基甲醇只在添加L6-1的酱油中检测到,虽然这3 种物质含量低,但其香气阈值低,对酱油香气贡献大;酯类物质中,具有玫瑰香气的乙酸苯乙酯只在添加L6-1的发酵组中检测出,另外添加L6-1的酱油中一些重要的乙酯类香气物质苯甲酸乙酯(水果气味)、琥珀酸二乙酯(食品加香剂)、辛酸乙酯(水果香)、乙酸苯乙酯(烟草、玫瑰香)、癸酸乙酯(葡萄香)、月癸酸乙酯(树叶香)、十四酸乙酯(鸢尾油香)、棕榈酸乙酯(蜡香)的含量均不同程度高于其他实验组,它们可缓冲酱油的咸味并通过抑制胺类和部分脂肪酸类物质的刺激感及苦味赋予酱油良好的风味[29];醛类物质中,苯乙醛在3 种发酵酱油中都有检测出,L6对苯乙醛有提升作用,但具有杏仁味的糠醛、苯甲醛和具有可可香味与水果香味的2-苯基巴豆醛、异戊醛只在添加L6-1的酱油中检测到;酚类物质中,L6对异丁香酚、4-乙基愈创木酚均有提升作用,2-甲氧基-4-乙烯基苯酚与麦芽酚只在添加L6-1的酱油中检测出,2-甲氧基-4-乙烯基苯酚具有丁香味,麦芽酚有焦奶油硬糖的味道,起到增香、固香、增甜的作用,对酱油香气影响较大[30]。挥发性风味物质的定量分析结果说明添加L6-1能够促进酱油风味物质的形成,提高酱油风味物质的丰富度。
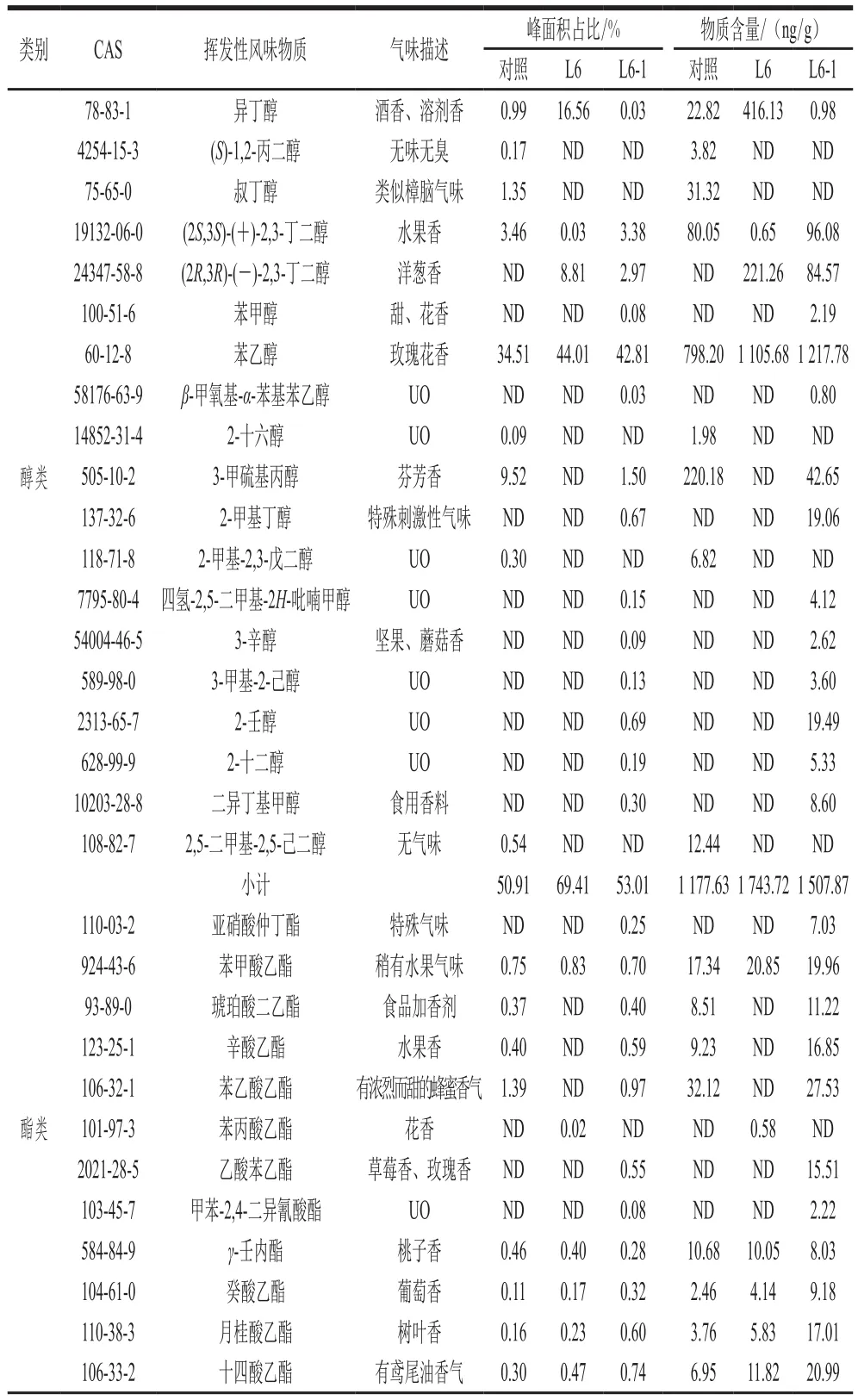
表1 高盐稀态发酵酱油挥发性风味物质成分及含量Table 1 Volatile flavor compositions of HLF soy sauces

续表1
对发酵酱油的挥发性风味物质进一步进行主成分分析,从醇类、酯类、醛类、酚类、酮类、酸类、其他物质七大类物质中提取出2 个主成分,各主成分的贡献率及总贡献率如表2所示,所提取的2 个主成分总贡献率达到100.00%,能充分解释各个原始成分。各主成分载荷图如图7所示,在PC1轴上,醇类、醛类、酮类、酸类的相关性系数较大,因此可用PC1解释这4 类物质,其中醇类、醛类及酮类物质呈正相关,而酸类物质呈负相关;PC2轴显示,酯类、酚类、其他物质的相关性系数较大,因此可用PC2解释这3 类物质。

表2 主成分方差贡献情况Table 2 Contribution rates of principal components to total variance
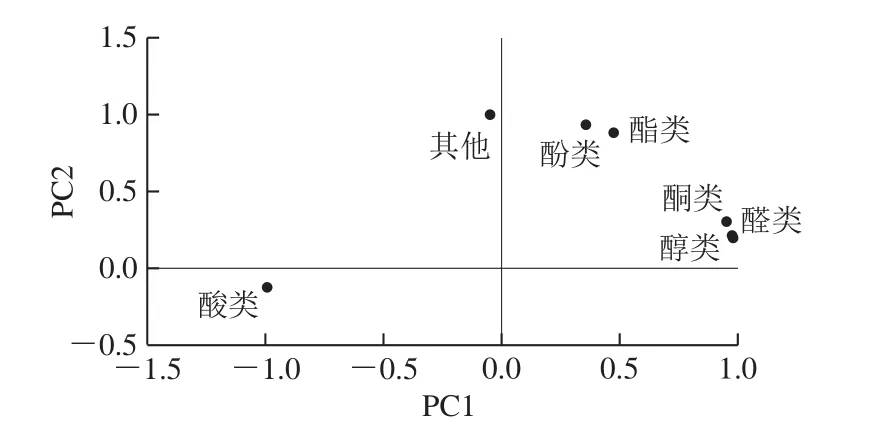
图7 主成分载荷图Fig.7 Loading plot of principal components
计算各变量的主成分得分系数并计算各主成分得分,得到最终总得分计算公式:F总=0.737F1+0.263F2,各酱油样品主成分得分及总得分如表3所示。
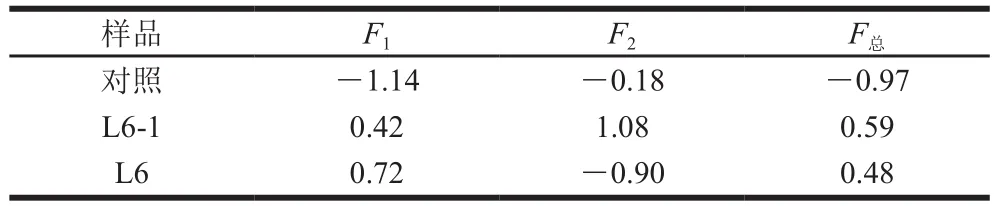
表3 酱油样品主成分得分Table 3 Principal component scores of soy sauces
由表3可看出,总得分对照组最低,则L6-1与L6对酱油的风味呈正向贡献,且L6-1得分最高,因此,突变株L6-1有明显提升酱油风味的作用。L6在PC1上得分较高,PC1与醇类、醛类、酮类的相关性系数较大,说明L6对此三类物质贡献较大;L6-1在PC2上得分较高,PC2与酯类、酚类、其他的相关性系数较大,同时PC1上也有较好得分,由于PC1得分的权重系数为0.737,L6-1的总得分与PC1和PC2都有较大相关性,说明L6-1除醇类、醛类、酮类物质贡献较大外,酯类、酚类、其他类物质的贡献也较大。综合乙醇积累量、挥发性风味物质种类、含量及贡献度,可以发现,突变株L6-1接入酱醪后,除提高乙醇为主的醇类化合物种类和含量之外,还对酱油重要的香气成分酯类,特别是乙酯类物质的形成起到了重要的促进作用,有效地丰富了酿造酱油的风味。
3 结 论
酱油酿造由传统的晒露法及低盐固态发酵发展为现代高盐稀态发酵,其封闭的发酵设备大幅减少了污染菌的质量安全风险,同时也影响了酿造酱油的风味。以鲁氏接合酵母L6为出发菌株,经紫外诱变选育了1 株在10% NaCl豆芽汁培养基中能很好积累乙醇的突变株L6-1,16% NaCl高盐稀态发酵酱醪中对比研究L6-1和L6,发现酱醪发酵45 d时两株菌乙醇含量均达到了最高,分别比对照组提高了78.57%和125%,随着发酵的进行,其乙醇积累量有所下降;挥发性风味物质定量分析发现,添加L6-1的发酵酱油除乙醇外的醇类物质以及酯类物质(特别是乙酯类物质)的丰富度均好于L6,其中乙酯类风味物质含量最高为605.64 ng/g,比添加L6及对照组的发酵酱油分别提高了6.79%及20.61%;主成分分析并评分发现,添加突变株L6-1的发酵酱油得分最高,进一步说明了L6-1除提高酱油乙醇含量外,对酱油风味物质的丰富度及风味具有良好的促进作用。选育耐盐产乙醇酵母,能促进酱醪发酵中乙醇及乙醇为底物的乙酯及其他物质的积累,在提高酱油醇香风味的同时有效提升了酱油风味的丰富度,这为今后酱油酿造风味菌的选育提供了一条围绕核心代谢产物选育的思路,将更有效地提升酿造酱油的品质。
参考文献:[1]包启安.酱及酱油的起源及其生产技术(一)[M].北京: 中国轻工业出版社, 1992: 2-5.
[2]陈彬, 鲁绯, 王夫杰, 等.耐盐酵母菌对发酵酱油风味作用及其应用的研究进展[J].中国酿造, 2010, 29(6): 1-3.DOI:10.3969/j.issn.0254-5071.2010.06.001.
[3]郭建, 伍学明, 樊君, 等.鲁氏酵母和球拟酵母不同接种方式对高盐稀态酿造酱油品质的影响[J].中国调味品, 2019, 44(2): 100-104.DOI:10.3969/j.issn.1000-9973.2019.02.021.
[4]徐莹, 姜维, 何晓霞.耐盐性鲁氏酵母的研究进展[J].中国酿造,2009, 28(10): 1-4.DOI:10.3969/j.issn.0254-5071.2009.10.001.
[5]HARADA R, YUZUKI M, ITO K, et al.Microbe participation in aroma production during soy sauce fermentation[J].Journal of Bioscience and Bioengineering, 2018, 125(6): 688-694.DOI:10.1016/j.jbiosc.2017.12.004.
[6]蔡金星, 曹小红, 刘秀凤.耐盐酱油酵母产乙醇优化研究[J].食品工业科技, 2005, 26(1): 57-59.DOI:10.3969/j.issn.1002-0306.2005.01.017.
[7]戴德慧, 黄光荣, 蒋家新, 等.米渣酱油多菌种制曲工艺研究[J].食品科学, 2007, 28(3): 234-237.DOI:10.3321/j.issn:1002-6630.2007.03.055.
[8]丁莉莉, 王昊, 王新宇, 等.日本酱油与中国酱油在不同模拟条件下挥发性呈香物质分析[J].中国酿造, 2019, 38(6): 144-151.DOI:10.11882/j.issn.0254-5071.2019.06.028.
[9]LIU M, LI H, ZHAN H.A novel method for the determination of the ethanol content in soy sauce by full evaporation headspace gas chromatography[J].Food Analytical Methods, 2014, 7(5): 1043-1046.DOI:10.1007/s12161-013-9711-8.
[10]SINGRACHA P, NIAMSIRI N, VISESSANGUAN W, et al.Application of lactic acid bacteria and yeasts as starter cultures for reduced-salt soy sauce (moromi) fermentation[J].LWT-Food Science and Technology, 2017, 78: 181-188.DOI:10.1016/j.lwt.2016.12.019.
[11]沈萍, 陈向东.微生物学实验[M].北京: 高等教育出版社, 2007.
[12]姚璐晔, 李想, 邢鋆, 等.紫外诱变选育高效降解甲醛菌株及其降解特性[J].食品科学, 2015, 36(13): 143-147.DOI:10.7506/spkx1002-6630-201513027.
[13]国家卫生和计划生育委员会.酒中乙醇浓度的测定: GB 5009.225—2016[S].北京: 中国标准出版社, 2016: 1-3.
[14]国家卫生和计划生育委员会.食品中还原糖的测定: GB/T 5009.7—2016[S].北京: 中国标准出版社, 2016: 1-4.
[15]国家标准化管理委员会.酱油卫生标准的分析方法: GB/T 5009.39—2003[S].北京: 中国标准出版社, 2003: 6.
[16]国家质量监督技术局.酿造酱油: GB 18186—2000[S].北京: 中国标准出版社, 2000: 5
[17]何天鹏, 刘少敏, 薛丹丹, 等.SPME结合GC-O-MS分析酵母菌对大酱中挥发性香气物质的影响[J].食品科技, 2018, 43(1): 284-289.DOI:10.13684/j.cnki.spkj.2018.01.051.
[18]郭显光.如何用SPSS软件进行主成分分析[J].统计与信息论坛,1998, 12(2): 61-65.
[19]DAKAL T C, SOLIERI L, GIUDICI P.Adaptive response and tolerance to sugar and salt stress in the food yeastZygosaccharomyces rouxii[J].International Journal of Food Microbiology, 2014, 185: 140-157.DOI:10.1016/j.ijfoodmicro.2014.05.015.
[20]SCHIFFERDECKER A J, SIURKUS J, ANDERSEN M R, et al.Alcohol dehydrogenase gene ADH3 activates glucose alcoholic fermentation in genetically engineeredDekkera bruxellensisyeast[J].Applied Microbiology Biotechnology, 2016, 100(7): 3219-3231.DOI:10.1007/s00253-015-7266-x.
[21]施巧琴, 吴松刚.工业微生物育种学[M].4版.北京: 科学出版社,2013: 96.
[22]刘晨, 张丽萍.亚硝基胍-紫外复合诱变筛选高产苯乳酸菌株[J].中国食品学报, 2015, 15(9): 41-46.DOI:10.16429/j.1009-7848.2015.09.006.
[23]陈卫平, 涂谨, 熊建华, 等.红四氮唑在酒精酵母选育中的应用效果研究[J].酿酒科技, 2003, 23(6): 35-37.DOI:10.3969/j.issn.1001-9286.2003.06.007.
[24]HOANG N X, FEMG S, TING C-H, et al.Optimizing the initial moromi fermentation conditions to improve the quality of soy sauce[J].LWT-Food Science and Technology, 2016, 74: 242-250.DOI:10.1016/j.lwt.2016.07.049.
[25]DZIALO M C, PARK R, STEENSELS J, et al.Physiology, ecology and industrial applications of aroma formation in yeast[J].FEMS Microbiology Reviews, 2017, 41: S95-S128.DOI:10.1093/femsre/fux031.
[26]赵谋明.调味品[M].北京: 化学工业出版社, 2001: 8-15.
[27]DEVANTHI P V P, GKATZIONIS K.Soy sauce fermentation:microorganisms, aroma formation, and process modification[J].Food Research International, 2019, 120: 364-374.DOI:10.1016/j.foodres.2019.03.010.
[28]JIANG X W, XU Y T, YE J, et al.Isolation, identification and application on soy sauce fermentation flavor bacteria of CS1.03[J].Journal of Food Science and Technology, 2019, 56(4): 2016-2026.DOI:10.1007/s13197-019-03678-w.
[29]GAO L H, LIU T, AN X J, et al.Analysis of volatile flavor compounds influencing Chinese-type soy sauces using GC-MS combined with HS-SPME and discrimination with electronic nose[J].Journal of Food Science and Technology, 2017, 54(1): 130-143.DOI:10.1007/s13197-016-2444-0.
[30]VAN DER SLUIS C, TRAMPER J, WIJFFELS R H.Enhancing and accelerating flavour formation by salt-tolerant yeasts in Japanese soysauce processes[J].Trends in Food Science & Technology, 2001,12(9): 322-327.DOI:10.1016/S0924-2244(01)00094-2.

