超声造影联合声辐射力脉冲弹性成像评估微波消融治疗大鼠肝泡型棘球蚴病
沈 淼,马钦风,马有良,尹秋萍,张玉英*
(1.青海大学研究生院,青海 西宁 810016;2.青海省人民医院超声科,青海 西宁 810007)
肝泡型棘球蚴病(hepatic alveolar echinococcosis, HAE)是慢性、复杂性、地方性人畜共患病,外科手术为首选治疗方法,但创伤大,且易出现并发症[1]。热消融术现已成为治疗HAE的新兴微创方法[2-3]。本研究观察超声造影(contrast-enhanced ultrasound, CEUS)联合声辐射力脉冲(acoustic radiation force impulse, ARFI)弹性成像评价微波消融(microwave ablation, MWA)治疗大鼠HAE疗效的价值。
1 材料与方法
1.1 实验动物及造模 清洁级雄性SD大鼠50只,鼠龄约3个月,平均体质量200 g,由青海大学高原医学研究中心提供[SYXK(青)2020-0001]。参照文献[4-5]方法建立HAE模型,经常规超声证实40只造模成功。
1.2 动物分组及处理 将40只HAE模型大鼠随机分为实验组30只和对照组10只。对实验组行MWA,术前12 h停饲,按0.5 ml/100 g体质量腹腔注射7%水合氯醛麻醉,于超声引导下将消融针(康友KY-2450A)插入病灶内,功率40 W,消融30 s~2 min, 待病灶全部变为强回声后扩大消融0.5 cm病灶旁组织,CDFI示无血流信号提示消融成功。对照组大鼠常规饲养。
1.3 仪器与方法 采用Siemens Acuson Oxana3超声诊断仪,线阵探头9L4(频率4~9 MHz),于术前及术后1个月行常规超声、CEUS及ARFI检查。先行常规超声,记录病灶形态及大小。将六氟化硫微泡(SonoVue)冻干粉59 mg与5 ml生理盐水混合,经大鼠尾静脉注射1 ml后即刻注入1 ml生理盐水冲管,以CEUS模式连续观察5 min,记录动脉相(2~20 s)、门静脉相(21~40 s)及延迟相(41~300 s)[5]。采用ImageJ软件定量分析HAE病灶边缘带灰阶强度,以造影后病灶边缘增强带5个不同位置为ROI,并选取相邻正常肝组织(术后术前保持ROI位置一致),计算病灶周围增强带与相邻肝组织的平均灰阶比,比值≥1.1为高增强,≤0.9为低增强,二者之间为等增强。于二维模式下显示病灶最佳切面,开启ARFI模式,于病灶周边浸润带选取5个ROI分别测量剪切波速度(shear wave velocity, SWV),以平均值为最后结果。
1.4 病理学检查 术后1个月完成超声扫查后处死并解剖大鼠。根据CEUS及ARFI声像图,每只大鼠病灶取1~3块标本,每块标本均包括HAE病灶、周边浸润带及正常肝组织。标本经固定、包埋、切片后行常规HE染色、CD34免疫组织化学染色及Masson染色。①以CD34标记微血管密度(microvessel density, MVD),血管内皮细胞胞质内出现棕黄色或棕褐色颗粒为阳性表现。于HAE病灶边缘带计数MVD:先在低倍光镜下(×100)选择5个微血管最密集区域,即“热点”,再在高倍光镜下(×400)计数,取平均值作为结果。②于高倍镜下(×400)观察Masson染色片病灶边缘区域5个ROI,采用Image-Pro Plus 6.0软件测量蓝色胶原纤维面积,取平均值作为纤维化面积。
1.5 统计学分析 采用SPSS 23.0统计分析软件。计量资料以±s表示,以t检验及单因素方差分析比较组间病灶最大径、SWV、MVD和纤维化面积,以t'检验分析灰阶比值变化;采用Pearson直线相关分析观察灰阶比值及MVD、SWV与纤维化面积的相关性。P<0.05为差异有统计学意义。
2 结果
实验组26只消融成功,4只因穿刺失败而放弃消融。术后1个月内死亡7只,其中4只腹腔出血,2只严重肠粘连、肠管扩张,1只麻醉后即刻出现全身痉挛、窒息。最终实验组纳入19只、共21个病灶,对照组大鼠10只共10个病灶,一般情况均良好。
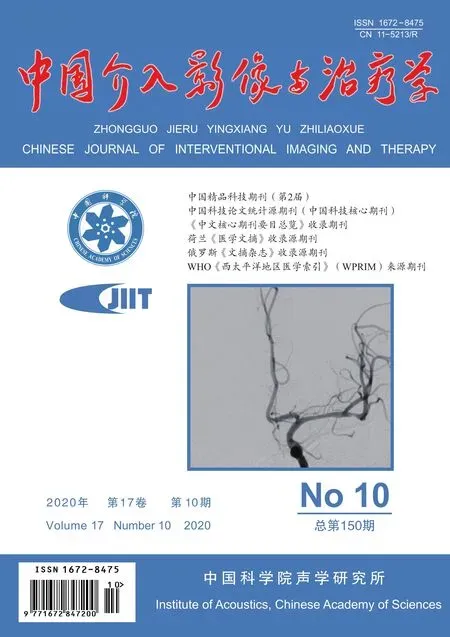
图1 实验组大鼠MWA术前及术后1个月CEUS及ARFI图像 A、B.术前(A)及术后1个月(B)CEUS图像显示术后病灶增强强度减弱(箭示HAE病灶边缘带); C、D.术前(C)及术后1个月(D)ARFI图像显示术后边缘带SWV增大;术前二维超声、CEUS及ARFI测量病灶最大径分别为1.12、1.51、1.54 cm,术后1个月分别为0.94、1.25、1.18 cm
2.1 病灶最大径 术前二维超声、CEUS及ARFI 所测2组病灶最大径差异均无统计学意义(t=-1.112、-1.185、-1.148,P=0.275、0.246、0.260)。术后1个月,实验组3种方法所测病灶最大径均较术前缩小(P均<0.001),对照组均较入组时增大(P均<0.001)。CEUS、ARFI所测2组病灶最大径大于二维超声(P均<0.05),CEUS与ARFI测值差异无统计学意义(P均>0.05)。见表1、2及图1。
2.2 消融前后病灶边缘带灰阶比值 实验组最终共选取105个ROI,术前94.29%(99/105)为高增强,3.81%(4/105)为等增强,1.90%(2/105)为低增强,平均灰阶比值为1.73±0.24;术后1个月59.05%(62/105)为高增强,32.38%(34/105)为等增强,8.57%(9/105)为低增强,平均灰阶比值为1.16±0.15,术后1个月HAE病灶周边边缘带灰阶比低于术前(t'=9.177,P<0.001)。
表1 3种方法测量实验组大鼠MVA术前及术后1个月病灶最大径比较(±s,n=21)

表1 3种方法测量实验组大鼠MVA术前及术后1个月病灶最大径比较(±s,n=21)
方法最大径(cm)术前术后1个月t值P值二维超声1.26±0.391.07±0.3814.631<0.001CEUS1.57±0.42*1.38±0.41*13.067<0.001ARFI1.54±0.38*1.34±0.39*10.139<0.001F值4.0103.677--P值0.0230.031--
注:*:与二维超声比较,P<0.05
表2 3种方法测量对照组大鼠入组时及饲养1个月后病灶最大径比较(±s,n=10)

表2 3种方法测量对照组大鼠入组时及饲养1个月后病灶最大径比较(±s,n=10)
方法最大径(cm)入组时饲养1个月后t值P值二维超声1.10±0.27 1.23±0.26 -7.960<0.001CEUS1.40±0.28*1.53±0.28*-7.702<0.001ARFI1.39±0.30*1.54±0.28*-14.848<0.001F值3.4184.248--P值0.0480.025--
注:*:与二维超声比较,P<0.05
2.3 消融前后病灶边缘带SWV 实验组21个病灶术前病灶边缘带SWV平均值为(5.01±0.34)m/s,术后1个月为(6.05±0.38)m/s,差异有统计学意义(t=-9.380,P<0.001)。
2.4 病灶边缘带MVD和纤维化程度 实验组消融灶边缘带MVD低于对照组,纤维化面积高于对照组(P均<0.001),见表3、图2。
表3 2组大鼠HAE病灶边缘带MVD及纤维化面积比较(±s)
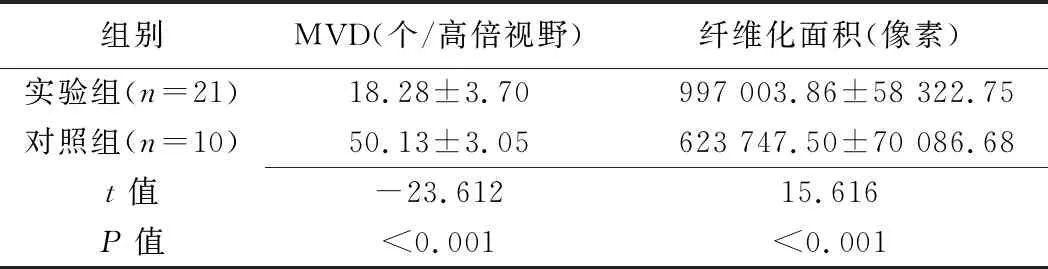
表3 2组大鼠HAE病灶边缘带MVD及纤维化面积比较(±s)
组别MVD(个/高倍视野)纤维化面积(像素)实验组(n=21)18.28±3.70 997 003.86±58 322.75对照组(n=10)50.13±3.05623 747.50±70 086.68t值-23.61215.616P值<0.001<0.001
2.5 相关性 实验组术后1个月消融灶边缘带灰阶比值与MVD呈正相关(r=0.541,P=0.011),SWV值与Masson染色纤维化面积呈正相关(r=0.494,P=0.023)。
3 讨论
泡球蚴通过向外芽生原头节及囊液外漏方式向周围肝组织浸润,引起机体迟发型超敏反应,最终形成假囊壁,即含有炎性细胞、微血管及纤维组织的周边浸润活性增殖带,并向周边侵袭[6]。

图2 病灶边缘带MVD及纤维化程度 A、B.分别为实验组、对照组CD34免疫组织化学染色图片(×400); C、D.分别为实验组、对照组Masson染色图片(×400)。实验组病灶边缘带MVD较对照组明显减少,纤维化程度较对照组增高
HAE潜伏期长,早期常无明显症状,出现症状时多已进入晚期,肝脏严重受损,泡球蚴甚至已随血液及淋巴转移至远隔重要脏器,因此早期诊治尤为重要。最新泡型肝包虫病诊疗专家共识[7]已将消融作为早期HAE(直径≤4 cm)的首选治疗方法之一。MWA可使HAE病灶发生凝固性坏死,并阻断病灶周边浸润带微血流灌注,从而抑制泡球蚴向周边侵袭,并切断其营养支持,达到灭活目的[8]。评价热消融治疗肝癌效果时,常以组织内有无微循环灌注作为影像学检查判断消融灶是否具有生物学活性的主要依据[9]。HAE浸润性生长依赖新生血管,通过监测HAE病灶周边浸润带有无微血流灌注可评估消融灶内是否有存活泡球蚴。
宋涛等[10]发现HAE病灶在CEUS中常表现为中央区全程“黑洞”,周边区在动脉早期出现边框样增强,呈“快进慢出” 灌注模式,且周边环状增强灰阶强度与MVD呈正相关,故可采用CEUS监测HAE病灶周边浸润带微血流灌注状态。应用纯血池造影剂SonoVue进行CEUS,反映微血供状态比CT、MRI更敏感,判断HAE病灶活性与PET/CT结果一致性更好[11]。本研究中消融后1个月实验组病灶边缘带平均灰阶比值较术前降低,提示术后周边浸润带微血管灌注减少,病灶活性降低,且消融灶边缘带MVD低于对照组,表明应用CEUS增强灰阶强度可无创、准确观察大鼠HAE病灶周边滋养微血管状态,进而评估MWA后病灶有无残存或复发。
ARFI技术通过测量组织的SWV定量分析不同组织间软硬度差异,现已广泛用于评估肝纤维化。华国勇等[12]发现HAE病变周边浸润带SWV值与病理所示纤维化程度呈正相关。本研究采用AFRI技术观察消融前后大鼠HAE病灶边缘带纤维组织变化,发现术后1个月SWV较术前升高,提示术后大鼠消融灶边缘纤维组织丰富。既往研究[13]报道,泡球蚴生长过程中,其边缘浸润带微血管形成与纤维化交替共存,新生肉芽肿内含丰富的新生血管及少量纤维组织,故边缘带活性更强。本研究中MWA后消融灶周边浸润带微血流灌注减少、纤维化增多,此时边缘带活性降低,提示观察上述两方面能更全面地反映病灶的生物学活性。此外,本研究CEUS测得HAE病灶最大径与ARFI测值无明显差异,均大于二维超声测值,与张玉英等[14]的结果相符,提示ARFI判断消融范围的价值与CEUS相当。
综上所述,CEUS联合ARFI技术能较二维超声更准确地显示大鼠HAE病灶周边浸润带形态、宽度,可用于评估消融范围,有助于更加彻底地清除病灶,且便于实时监测病灶有无残存及术后随访,对于MWA后早期评估疗效有一定价值,而其对于监测中长期疗效的价值尚待进一步观察。