增强CT术前预测骨肿瘤血供程度
陈 尘,高 健,胡立宝,郅 新
(北京大学人民医院放射科,北京 100044)
骨肿瘤包括原发肿瘤和转移瘤,主要治疗方式是外科手术切除[1-3]。但富血供骨肿瘤、尤其是脊柱肿瘤,其位置深在、血供丰富,术中出血量大,一直是手术面临的巨大挑战[4-5]。骨肿瘤术前栓塞可明显减少骨肿瘤术中出血、改善预后,现已得到广泛认可[6-10],但为有创操作,患者术中需接受较大剂量X线照射,且费用较高。另一方面,并非所有骨肿瘤均富于血供,目前公认巨细胞瘤、甲状腺癌及肾癌骨转移等骨肿瘤血供丰富,术前必须予以栓塞[4,6,9],而对其他骨肿瘤尚无定论[11]。如何在术前准确评估肿瘤血供,判断其是否需要进行术前栓塞,是当前亟需解决的问题[6]。既往研究[12-13]多以增强MRI评估病灶血供程度,假阴性率高。本研究观察以增强CT术前预测骨肿瘤血供程度的可行性。
1 资料与方法
1.1 一般资料 回顾性分析2011年10月—2020年1月 455例于北京大学人民医院接受术前栓塞的骨肿瘤患者,男257例,女198例,年龄9~82岁,平均(43.7±17.0)岁;均于栓塞前1个月内接受相应部位增强CT检查,并于外科切除术前24 h接受血管造影及肿瘤局部栓塞;病变位于肱骨3例,骨盆(含骶骨)344例,颈椎8例,胸椎58例,腰椎42例。455例中,原发肿瘤349例,包括巨细胞瘤78例、软骨肉瘤41例、骨肉瘤38例、脊索瘤27例、神经纤维瘤24例、神经鞘瘤21例、浆细胞瘤17例、未分化肉瘤15例、尤因肉瘤13例、血管瘤9例、其他66例;转移瘤106例,来源包括肾透明细胞癌31例、肝细胞肝癌13例、肺癌12例、甲状腺癌11例、结肠癌4例、神经内分泌癌4例、恶性黑色素瘤3例、乳腺癌3例,其他25例。排除标准:①病灶处无软组织肿物形成,难以测量CT值;②病变骨化或钙化明显,难以测量CT值;③既往手术留有金属固定物,病变区域金属伪影明显;④术后病理诊断为非肿瘤病变。
1.2 仪器与方法
1.2.1 CT检查 采用GE VCT、GE Revolution CT或Siemens Sensation 64层 CT机,自动曝光模式,管电压80~120 kV、管电流200~300 mAs进行平扫;之后采用高压注射器,经肘静脉以流率3 ml/s团注优维显370 mgI/ml,用量 1.0 ml/kg体质量,行静脉期增强扫描。
由2名不知晓血管造影及病理结果的放射科主治医师分别阅片,在5 mm层厚平扫图像上相同区域测量病灶平扫CT值;由其中1名医师于1个月后以简单随机法抽取50例再次进行测量。在5 mm层厚静脉期图像上选取病灶内强化最明显区域测量CT值,对囊实性病变测量实性强化部分,囊性病变测量囊壁或分隔,病灶内有骨化或钙化时,测量软组织部分;于同一层面避开血管结构测量正常肌肉强化CT值。
1.2.2 介入操作 采用Philips FD20 DSA机。于局麻下穿刺股动脉,先以5F猪尾导管行主动脉造影明确肿瘤血管起源,之后分别选择性插管至肿瘤供血动脉行选择性及超选择性造影。由2名不知晓病理及增强CT结果的介入医师对造影图像进行评分。肿瘤血供分级评分标准:0分,未见肿瘤供血血管及肿瘤染色;1分,肿瘤血管及肿瘤染色等于或少于邻近正常骨骼;2分,肿瘤血管或肿瘤染色多于邻近正常骨骼;3分,存在动静脉瘘。
取2名医师评分均值作为血管造影评分结果,据此将患者归入乏血供组(≤1分)或富血供组(>1分)。造影后即刻于DSA引导下进行栓塞。对富血供组将导管超选入肿瘤供血动脉,酌情以直径350~560 μm明胶海绵微粒予以栓塞;对乏血供组结合CT及造影结果判断病变范围,对病变范围供血动脉酌情以350~560 μm明胶海绵微粒进行栓塞;栓塞终点均为目标动脉血流中断。
对2组均于栓塞后24 h内行骨肿瘤外科切除术。造影后1个月,由其中1名医师以简单随机法抽取50例造影图像再次进行评分。
1.3 统计学分析 采用SPSS 21.0统计分析软件,以组内相关系数(intra-class correlation coefficient,ICC)评价2名医师测量CT值及同一医师2次测量CT值的一致性,以Kappa检验评价2名医师肿瘤血供评分及同一医师2次评分的一致性。根据所测CT值均值得到3组指标,即肿瘤增强CT值、强化值(肿瘤增强CT值-肿瘤平扫CT值)以及肿瘤与周围肌肉差值(肿瘤增强CT值-周围肌肉增强CT值)。以ROC曲线分析CT值评估肿瘤血供情况的效能。采用单因素ROC曲线分析肿瘤增强CT值、强化值以及肿瘤与周围肌肉差值3个CT指标的AUC,以约登指数法计算最优界值及其敏感度、特异度。采用多因素ROC曲线分别分析上述3个CT指标联合及两两联合,先以Logistic回归得到预测概率,再以预测概率作ROC曲线分析得到AUC,以约登指数法计算最优界值及其敏感度、特异度。P<0.05为差异有统计学意义。
2 结果
2名医师之间所测肿瘤CT值的ICC值为0.906,同一医师2次测量间的ICC值为0.988。
455例骨肿瘤中,乏血供组85例(图1),富血供组370例(图2)。2名医师血管造影评分结果的Kappa值为0.856,同一医师2次评分间的Kappa值为0.896。
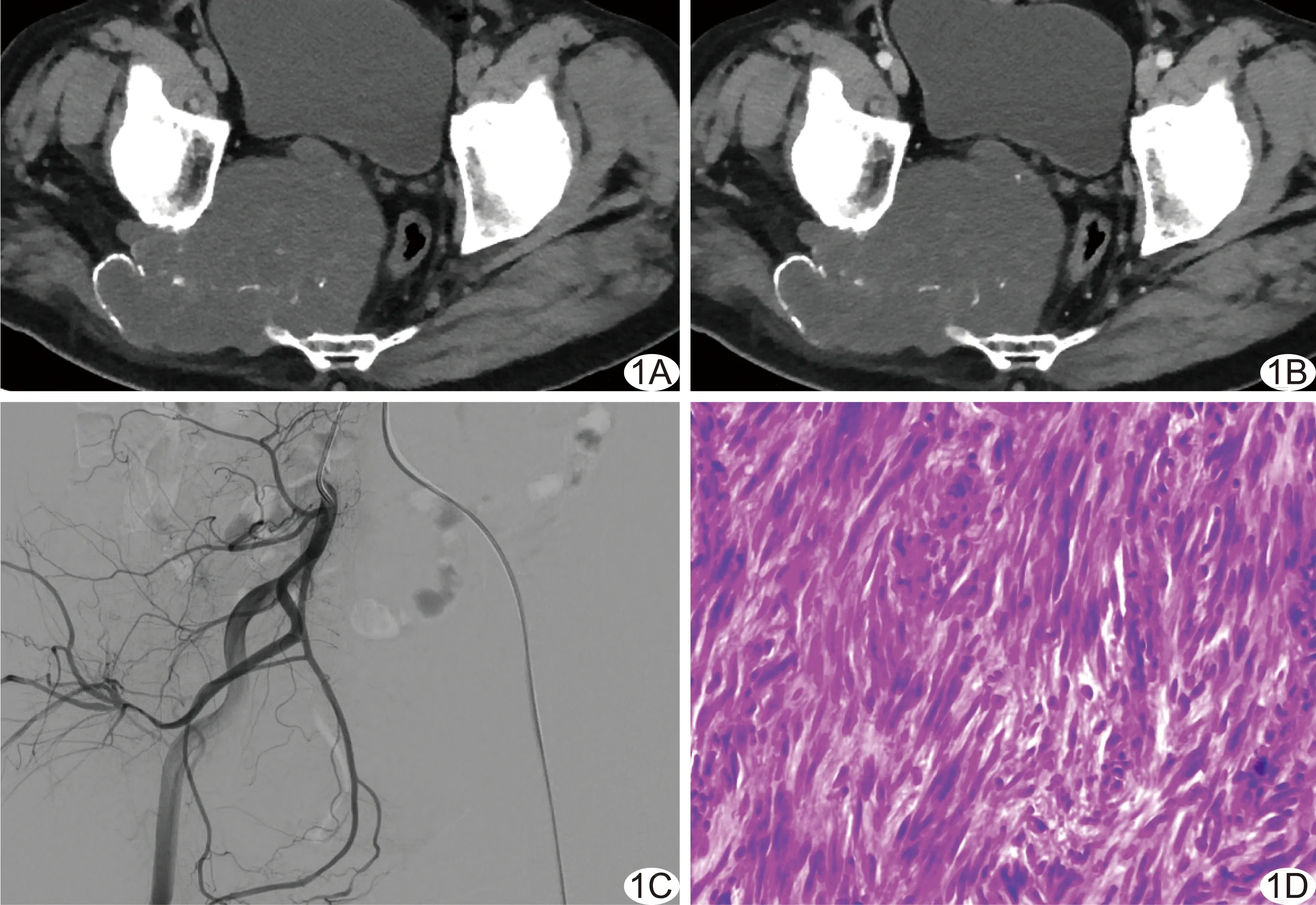
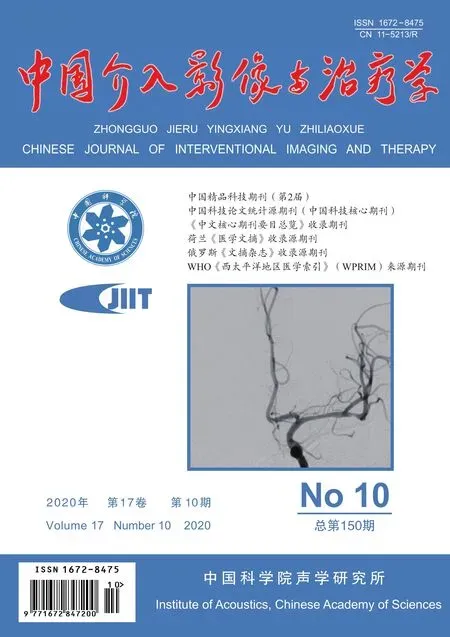
图1 患者女,47岁,骶骨神经源性肿瘤 A、B.骨盆平扫(A)及增强(B)CT图像示骶骨右侧巨大分叶状软组织肿物,平扫CT值约33.8 HU,增强后CT值约43.8 HU; C.右侧髂内动脉造影示臀下动脉呈受压推挤表现,未见明确肿瘤血管及肿瘤染色,血管造影评分0分; D.术后病理(HE,×20)符合神经源性肿瘤,倾向于富于细胞的神经鞘瘤
图2 患者男,43岁,胸椎孤立性纤维性肿瘤 A、B.胸椎平扫(A)及增强(B)CT图像示T12右侧软组织肿物,平扫CT值约19.1 HU,增强后CT值约169.0 HU; C.右侧第12肋间动脉造影见右侧第12肋间动脉明显增粗,有粗大肿瘤血管及肿瘤染色形成,伴粗大引流静脉提前显影,血管造影评分为2.5分; D.术后病理(HE,×10)诊断孤立性纤维性肿瘤
ROC曲线结果显示,肿瘤增强CT值、强化值及与周围肌肉差值的AUC分别为0.967、0.973及0.967;增强CT值+强化值、增强CT值+与周围肌肉差值、强化值+与周围肌肉差值的AUC分别为0.977、0.969、0.979;3者联合为0.979,见表1及图3。
3 讨论
骨肿瘤术前栓塞对于控制富血供骨肿瘤术中出血、缩短手术时间进而改善患者预后的效果已为多项研究[4,6-10]所证实,但对乏血供肿瘤术前有无必要予以栓塞目前尚无明确定论[11],临床迫切需要可靠的无创检测方式于术前预测肿瘤血供程度,以筛选术前栓塞适应证[6]。
既往研究[12-13]对骨肿瘤术前多以增强MRI评估病灶血供程度,但假阴性率较高,即使增强MRI提示乏血供肿瘤,仍有相当部分病灶血管造影显示为富血供。MRI的原理是以射频脉冲激发组织中的氢原子,采集受激发氢原子所释放的能量,通过傅里叶变换重建出组织图像,不同设备、不同扫描序列可得到不同图像及不同信号值,故难以对增强MRI所示组织强化程度进行量化评估,而多仅能单纯定性为有强化或无强化。CT则通过测量X线通过组织后的衰减程度,按照衰减程度计算CT值,不同设备之间测量CT值的一致性较高,便于量化评估。因此,本研究采用增强CT预测骨肿瘤的富血供程度。
本研究对455例骨肿瘤患者于术前1个月内进行CT检查,选取肿瘤增强CT值、肿瘤强化值及肿瘤与周围肌肉CT值差值3个指标进行评价,并与术前24 h血管造影结果进行对比,评价其判断肿瘤血供能力;并应外科医师要求,造影后全部病灶进行术前栓塞。因肿瘤生长速度快,其内血管化程度不均匀,增强扫描后强化程度不均匀,强化最明显区域代表肿瘤内血管化程度最高的区域,更能代表肿瘤血供程度,故选择于强化最明显区域测量增强扫描肿瘤CT值。经肘静脉团注对比剂后,对比剂回流入心并进入主动脉,而后进入肿瘤供血动脉至肿瘤毛细血管网,再经引流静脉回流,扫描时间不同,对比剂所在循环部位不同,CT值也会有一定差异。测量肿瘤同层面肌肉组织CT值,计算肿瘤组织与该值之间差值,有利于减少上述差异。ROC曲线分析结果显示,本组3个评价指标的AUC均>0.900,提示其均可用于评估病灶血供程度,其中肿瘤强化值的AUC最大,为0.973,诊断价值最高,其最优界值为26.28 HU,敏感度0.968、特异度0.882,敏感度较高而特异度稍低,符合术前评估要求,有利于筛选术前栓塞适应证。
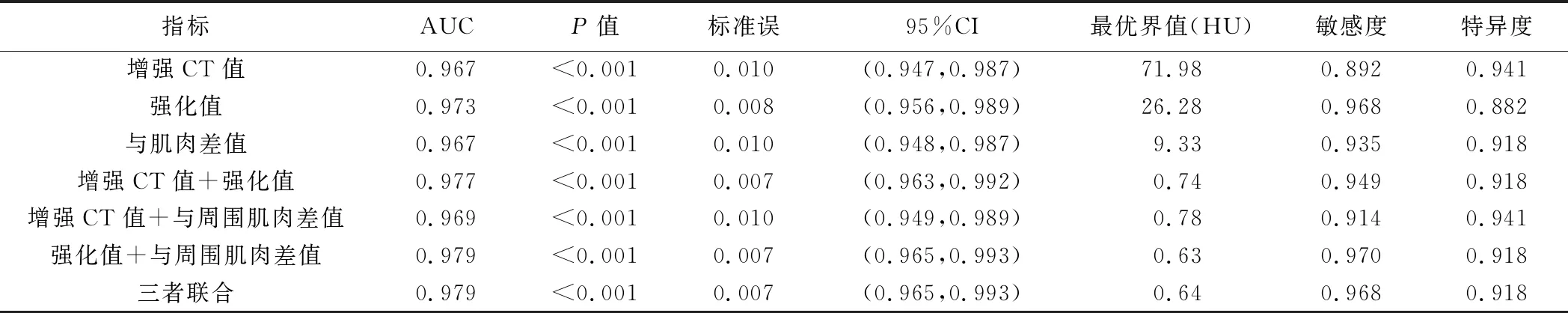
表1 增强CT评估骨肿瘤血供的ROC曲线分析结果
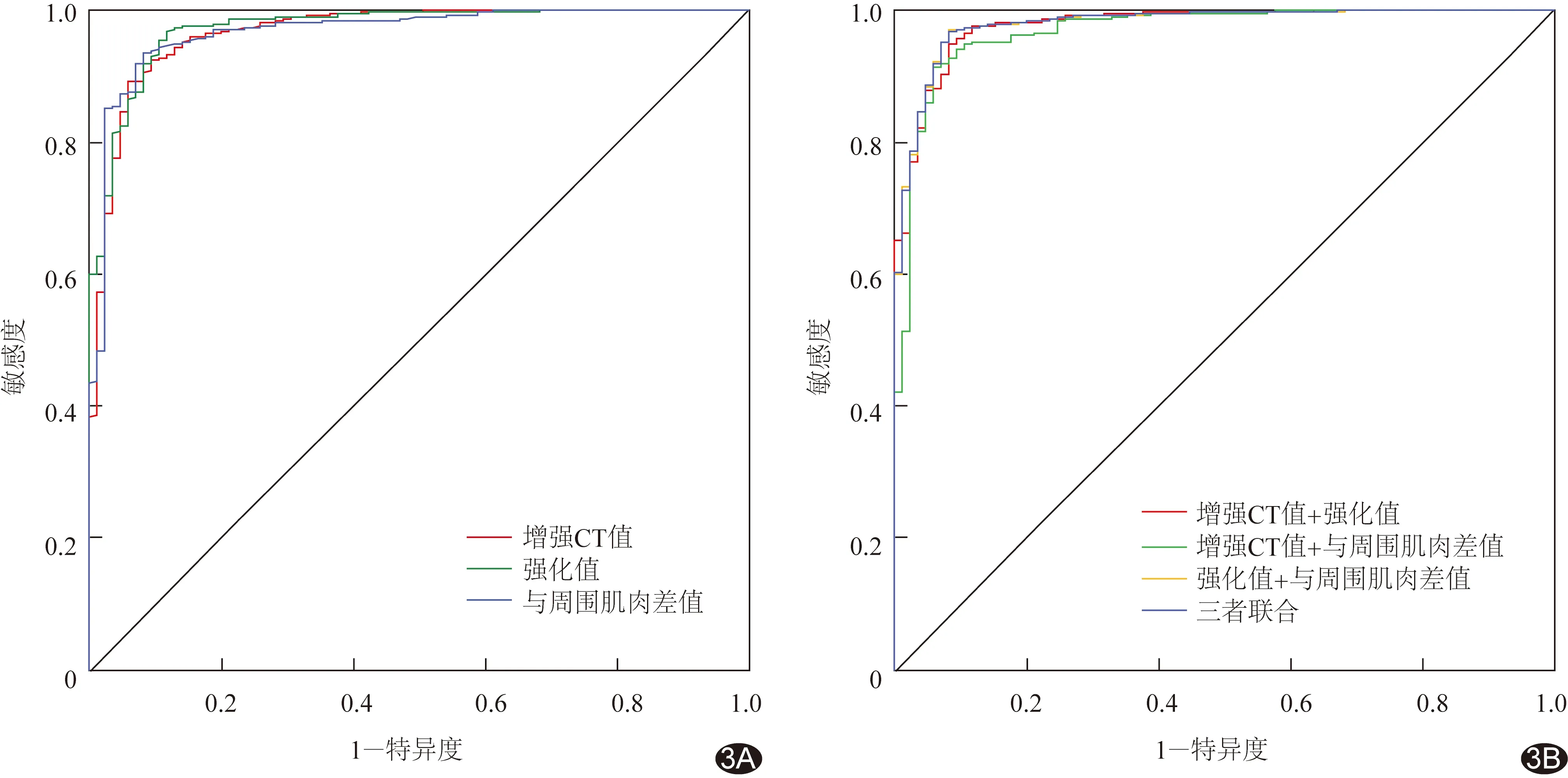
图3 根据增强CT评估骨肿瘤血供的ROC曲线 A.单因素ROC曲线; B.多因素ROC曲线
多因素ROC曲线分析的目的是降低单因素分析造成的误差,提高诊断敏感度和特异度[14-16],先采用Logistic回归对多因素进行计算,得到1个预测概率,再对预测概率进行ROC曲线分析,最终得到预测概率的最优界值。临床应用时,需按Logistic回归公式对测得的多因素进行计算,得到预测概率,再与最优界值进行对比。本研究中,多因素ROC曲线分析得到的AUC最大为0.979,稍高于单因素分析,但过程较为繁琐,不利于临床推广。
综上所述,增强CT可用于术前评估骨肿瘤血供程度,敏感度较高,可重复性良好;其中采用肿瘤强化值进行评价的AUC最高。