对比微波消融、子宫动脉栓塞治疗单发子宫肌壁间肌瘤效果
林俊东,王祖琛,徐绍鹏,叶南芳
(1.漳州市中医院介入科,福建 漳州 363000;2.漳州市芗城区妇幼保健院妇女保健科,福建 漳州 363000)
子宫肌瘤在育龄女性中发生率高达80%,约50%患者因临床症状明显而影响生活质量,包括经期长、经量多、贫血、尿频、尿急、便秘、不孕及反复流产等[1-2]。既往采用子宫切除术治疗难治性子宫肌瘤,但创伤大,术后生育能力丧失,且易致腹腔脏器脱垂、卵巢早衰、性生活质量下降及心理疾病等[3]。腹腔镜下子宫肌瘤剔除术是临床常用保留子宫及其生殖内分泌功能的微创治疗方法,但存在“触觉反馈消失效应”,易致肌瘤残留而复发[4]。近年来微波消融(microwave ablation, MWA)和子宫动脉栓塞(uterine artery embolization, UAE)逐渐用于治疗子宫肌瘤[5-6]。本研究对比分析MWA与UAE治疗单发子宫肌壁间肌瘤的临床效果。
1 资料与方法
1.1 一般资料 回顾性分析2016年4月—2019年12月49例子宫肌瘤患者,其中27例接受MWA治疗(MWA组),年龄29~45岁、平均(39.0±4.2)岁,病程9~32个月、平均(14.23±1.22)个月;22例接受UAE治疗(UAE组),年龄32~43岁、平均(39.0±2.2)岁,病程7~28个月、平均(13.24±2.04)个月。纳入标准:①经临床及影像学检查诊断为单发子宫肌壁间肌瘤;②存在经期长、反复流产等明显症状。排除标准:①肌瘤有恶变可能;②严重心、肝、肾等脏器功能不全;③盆腔感染、粘连;④月经期、哺乳期、孕妇或绝经后妇女;⑤认知障碍;⑥子宫肌瘤手术史。本研究获漳州市中医院伦理委员会批准,患者均签署知情同意书。
1.2 仪器与方法
1.2.1 MWA 采用GE Logiq E9彩色多普勒超声诊断仪,凸阵探头,频率3.5~4.6 MHz,配备穿刺引导架和低机械指数造影功能。术前患者禁食8 h,禁水4 h。 术前30 min予镇静,并建立静脉通路。嘱患者仰卧,施行静脉麻醉或连续硬脊膜外腔麻醉。以常规超声确定皮肤穿刺点,并判断是否需要建立人工液腹;之后行超声造影,观察肌瘤大小、位置,设定进针方向、深度。对直径<3 cm或乏血供肌瘤置入1根微波针行单点消融,直径>5 cm富血供肌瘤置入2根针行多点消融。按照由深到浅、由后至前的原则进行消融治疗,时间420~900 s,输出功率40~60 W,实时监测消融区内及其周围组织回声变化,当高回声到达预定消融区边缘约0.3 cm时停止消融,再次造影观察效果。见图1。
1.2.2 UAE 采用Siemens Atris Zee Ⅲ Ceiling DSA机为引导设备。嘱患者仰卧,以2%利多卡因2 ml局部麻醉后,采用Seldinger技术穿刺右侧股动脉,置鞘后引入5F RUC导管,于DSA引导下选入左侧子宫动脉进行造影,对比剂为碘克沙醇100 ml∶65.2 gI。之后以同轴微导管超选择插管至靶血管,以300~500 μm明胶海绵微粒栓塞靶血管直至肿瘤染色消失。再利用成襻技术将RUC导管引入右侧子宫动脉,以同样方法栓塞靶血管。拔除导管及穿刺鞘,加压包扎穿刺点,嘱患者平卧24 h。见图2。
1.3 相关指标观察 统计术后并发症及症状恢复情况。术后每3个月随访1次至术后12个月,以超声或MRI观察肌瘤大小及体积,检测血清卵泡刺激素(follicle-stimulating hormone, FSH)、黄体生成素(luteinizing hormone, LH)及雌二醇(estradiol, E2)水平,并统计肌瘤复发率。
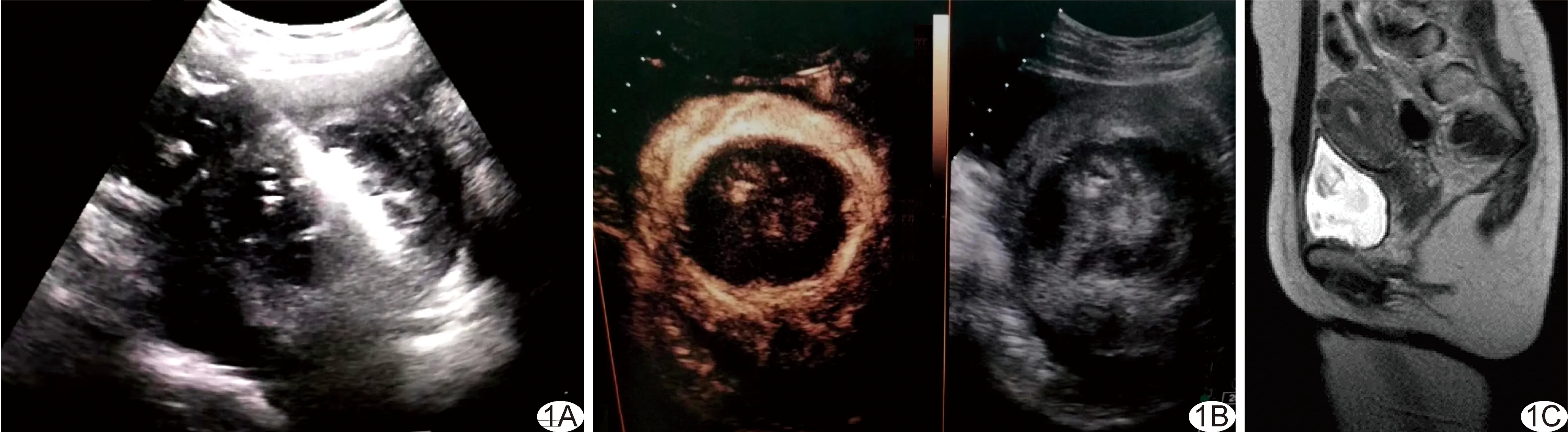
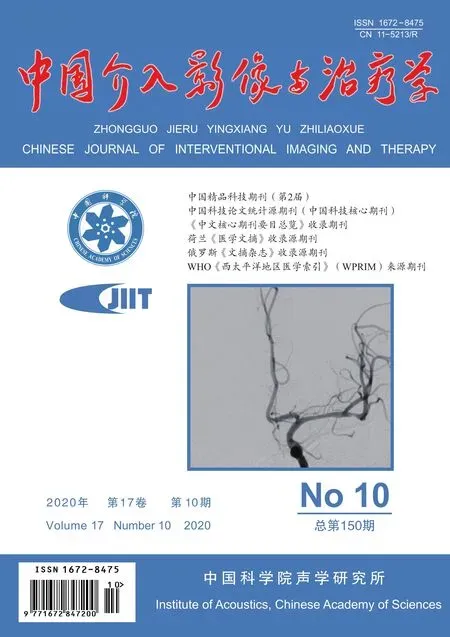
图1 MWA组患者,女,32岁,子宫肌瘤 A.二维超声声像图示子宫肌瘤最大径约9.0 cm; B.MWA后肌瘤呈强回声,超声造影见明显强化; C.术后12个月复查MRI,病灶最大径约0.9 cm, T2WI呈低信号
图2 UAE组患者,女,43岁,子宫肌瘤 A.术前T2WI见肌瘤呈混杂信号,最大径约8.0 cm,占位效应明显,膀胱、肠管及前腹壁被推压; B.术中DSA见子宫动脉卵巢支; C.UAE术后12个月复查T2WI,病灶呈低信号,最大径约1.8 cm,占位效应消失
1.4 统计学分析 采用SPSS 22.0统计分析软件。计量资料以±s表示,组间比较采用独立样本t检验;多个时间点总体比较采用Kruskal-Wallis检验,两两比较采用Nemenyi检验;计数资料组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 2组患者年龄(t<0.01,P>0.05)、病程(t=1.67,P>0.05)及入院时肌瘤最大径(t<0.01,P>0.05)差异均无统计学意义。2组均顺利完成手术,UAE组造影显示1例卵巢动脉参与子宫肌瘤供血,8例见子宫动脉卵巢支(图2B)。
2.2 并发症 2组术中各项生命体征均正常,未见术中并发症;术后月经过多、痛经、贫血等症状均缓解并逐渐消失。
MWA组术后4例发热,体温均<38.5℃,自行恢复正常;27例术后均诉腹痛,17例疼痛视觉模拟评分(visual analogue scale, VAS)<3分、9例4~6分、1例7~10分,予对症处理后3天均缓解;11例阴道排液未特殊处理,术后5周内恢复正常。
UAE组术后7例发热,术后1周内3例(体温>38.5℃)超声显示宫腔内大量潴留物,予清宫加抗生素预防感染后体温恢复;另外4例(体温<38.5℃)经物理降温,术后5天体温均恢复正常。22例术后均诉腹痛,4例VAS<3分、11例4~6分、7例7~10分,经对症处理后10天内均缓解;15例阴道排液未特殊处理,术后6周内恢复正常。
2.3 肿瘤最大径及体积 2组组内术前及术后不同时间点肌瘤体积及最大径比较差异有统计学意义(P均<0.05),术后各时间点均较术前降低(P均<0.05)。术前及术后12个月肿瘤最大径及体积组间差异均无统计学意义(P均>0.05),术后3、6个月MWA组肌瘤体积及最大径均小于UAE组(P均<0.05)。见表1。
2.4 血清FSH、LH及E2水平 组内2组术前及术后6、12个月血清FSH、LH及E2水平差异均有统计学意义(P均<0.05)。术前血清FSH、LH及E2水平组间差异均无统计学意义(P均>0.05);术后6、12个月MWA组血清FSH、LH水平均低于UAE组(P均<0.05),E2水平高于UAE组(P<0.05)。见表2。
2.5 复发率 随访期间MWA组7例复发,复发率为25.93%(7/27),其中5例术前肌瘤最大径≥5 cm;UAE组6例复发,复发率为27.27%(6/22),其中4例术前最大径≥5 cm。2组间复发率差异无统计学意义(χ2=0.011,P>0.05)。
3 讨论
子宫是卵巢的靶器官,为重要生殖器官,分泌多种生物活性物质,参与局部及全身功能调节[7-8]。利用微波对组织“离子加热”和“偶极子加热”原理,MWA可使微波针周围组织温度升至使蛋白质发生不可逆凝固性坏死水平,致瘤体缩小或经自然腔道排出体外[9]。CT及MRI均可作为MWA引导设备,但CT有辐射,且需增强才能分辨肌瘤与正常子宫肌层界限,除可能发生碘对比剂不良反应外,操作时间窗小,且不能实时引导;MR费用较高,较难实现实时引导。超声引导易受患者体型、肠道气体、肌瘤位置及术者主观因素影响,学习曲线较长[5],但无辐射,且具有实时监测功能,故本研究采用超声引导进行MWA治疗。UAE通过阻断子宫肌瘤血供使肌瘤组织变性、坏死,瘤体缩小甚至消失;同时可抑制内膜增生,使月经量减少,月经周期恢复正常,有效缓解患者贫血症状[6]。
表1 2组术前及术后各时间点子宫肌瘤最大径及体积比较(±s)
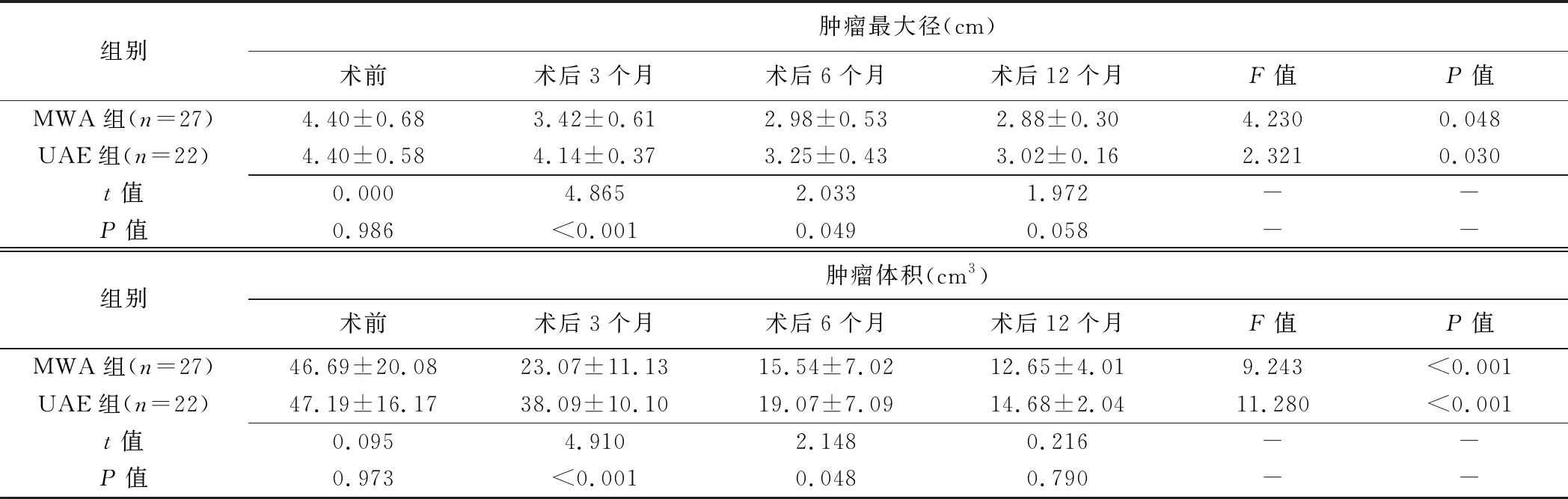
表1 2组术前及术后各时间点子宫肌瘤最大径及体积比较(±s)
组别肿瘤最大径(cm)术前术后3个月术后6个月术后12个月F值P值MWA组(n=27)4.40±0.683.42±0.612.98±0.532.88±0.304.2300.048UAE组(n=22)4.40±0.584.14±0.373.25±0.433.02±0.162.3210.030t值0.0004.8652.0331.972--P值0.986<0.0010.0490.058--组别肿瘤体积(cm3)术前术后3个月术后6个月术后12个月F值P值MWA组(n=27)46.69±20.0823.07±11.1315.54±7.0212.65±4.019.243<0.001UAE组(n=22)47.19±16.1738.09±10.1019.07±7.0914.68±2.0411.280<0.001t值0.0954.9102.1480.216--P值0.973<0.0010.0480.790--
表2 2组血清FSH、LH及E2水平比较(±s)

表2 2组血清FSH、LH及E2水平比较(±s)
组别FSH(U/L)术前术后6个月术后12个月F值P值MWA组(n=27)18.20±1.4220.40±1.9119.53±1.2217.690<0.001UAE组(n=22)18.43±1.9022.81±2.1621.53±1.8615.092<0.001t值0.3344.15510.293--P值0.707<0.001<0.001--组别LH(U/L)术前术后6个月术后12个月F值P值MWA组(n=27)17.72±1.3219.95±1.6818.60±1.2311.095<0.001UAE组(n=22)17.90±1.5221.63±2.1119.70±1.8112.069<0.001t值0.4443.1112.534--P值0.6350.0040.016--组别E2(pmol/L)术前术后6个月术后12个月F值P值MWA组(n=27)286.10±15.32243.90±17.68268.60±18.2228.071<0.001UAE组(n=22)280.43±14.95222.22±20.38245.72±16.5327.993<0.001t值-1.306-3.999-4.570--P值0.1990.001<0.001--
肌瘤缩小程度与患者临床症状改善密切相关[10]。本研究对比观察MWA与UAE治疗子宫肌瘤的效果,发现MWA组术后并发症较UAE组为轻,且持续时间短,恢复快。MWA直接作用于肌瘤,术后3、6个月肌瘤体积及最大径缩小比UAE组更明显,提示MWA组患者可更早获益。
FSH及LH是评估卵巢储备功能、E2为反映卵巢内分泌功能的重要指标。本研究2组内术前及术后6、12个月血清FSH、LH及E2水平差异均有统计学意义,提示2种方法均可影响卵巢功能;术后6、12个月MWA组血清FSH、LH水平均低于UAE组,E2水平高于UAE组,提示UAE对卵巢的刺激更强。文献[11]报道32%~40%子宫肌瘤患者动脉造影可见子宫动脉卵巢支。本研究中UAE组8例见子宫动脉卵巢支,1例造影见卵巢动脉参与子宫肌瘤供血。因栓塞颗粒可通过卵巢支进入卵巢动脉而误栓,降低卵巢血液灌注,引起卵巢功能下降甚至衰竭[6],故UAE后约0.1%患者出现闭经、宫腔粘连、子宫过度萎缩等,影响妊娠结局,或致分娩期并发症增多[12]。本组未见上述并发症,但对有生育要求者仍建议慎重选择UAE。
本研究中术后复发者多数肌瘤最大径≥5 cm。对于MWA而言,较大肌瘤血供丰富,存在“热沉降”,浆膜侧毗邻重要脏器和/或黏膜侧与子宫内膜接触面大,无安全消融边界;此外,肥胖、肠道气体等因素均可影响消融结果。对于UAE而言,大肌瘤有更多侧支血管,易漏栓,尤其存在卵巢动脉供血或子宫卵巢血管吻合支时,术后更易建立侧支循环,难以使肌瘤组织完全缺血、坏死,导致复发率增加[11]。
综上所述,MWA和UAE治疗单发症状性肌壁间子宫肌瘤疗效确切、安全可靠;相对于UAE,MWA效果更优。本研究为回顾性分析,样本量少、随访时间短,有待大样本前瞻性、多中心随机对照研究进一步观察。