盐溶液种类和浓度对α-半水脱硫石膏合成的影响
陈 平,田 宇,胡 成
(1.桂林理工大学,广西建筑新能源与节能重点实验室,广西桂林541004;2.桂林理工大学,广西工业废渣建材资源利用工程技术研究中心;3.武汉科技大学,省部共建耐火材料与冶金国家重点实验室)
脱硫石膏是指含硫燃料(煤、油等)燃烧后产生的烟气进行脱硫净化处理而得到的工业副产石膏。目前,中国脱硫石膏利用率低,且主要以大量堆存和就近掩埋为主,这不仅浪费土地资源,而且严重破坏生态环境[1]。α-半水石膏具有强度大、附加值高的特点,被认为是提高脱硫石膏利用率的有效途径。α-半水脱硫石膏的制备方法主要有蒸压法和水热法。相比于蒸压法,常压盐溶液水热法具备温度低、能耗低、生产效率高的优点[2-5],是高强石膏材料研究的新方向,近年来受到研究者广泛的关注。
岳文海等[6]提出了常压盐溶液法,首次在如90℃左右的盐介质中制得结晶形态良好、试体强度较高、呈短柱状的α-半水石膏晶体。锄本峻司等[7]通过改变盐或酸的种类、含量来增加二水石膏与α-半水石膏在溶液中的溶解度差,从而使α-半水石膏能够在溶液中结晶析出。Wu Xiaoqin等[8]研究了脱硫石膏在常压混合盐溶液中的改性,分析了烟气脱硫石膏晶体的亚显微结构。大量研究表明,FGD石膏转化为α-半水石膏的过程遵从溶解-重结晶机理。在重结晶诱导期内,FGD石膏首先在热的盐溶液中溶解,形成过饱和硫酸钙溶液,在一定的过饱和区域内,α-半水石膏雏晶直接从溶液中析出,随后石膏雏晶继续生长,形成了均匀粗大的棱柱状α-半水石膏晶体[9]。盐溶液的主要作用是增大二水石膏与α-半水石膏之间的溶解度差,提高过饱和度,降低相转变点,促进α-半水石膏的析晶[10-12]。国内现行的常压盐溶液水热法生产α-半水石膏的工艺基本采用上海建材院王瑞麟研究的水热法:将石膏加入蒸馏水配成一定浓度的料浆在常压下反应[13],该方法是生产α-半水石膏应用最多的方法。国外针对水热法制取α-半水石膏的研究最早始于1992年,日本采用了吴羽法通过添加晶种来实现制备α-半水石膏;欧洲则是采用Knauf工艺和POLCAL工艺来制备α-半水石膏[14]。
尽管以脱硫石膏为原料制取α-半水石膏的技术工艺多种多样,但是由于溶解再结晶的条件不够完善,所合成的晶型生长发育成无规则晶体,导致其力学强度相对较低。为了能合成性能更为优异的α-半水石膏,使之进行大规模工业化应用,本文以电厂脱硫石膏为原料,采用常压盐溶液水热法合成α-半水石膏,在合成温度不变的条件下,研究盐溶液的种类和浓度对合成α-半水石膏的影响。
1 原材料与实验方法
1.1 主要原材料
1)脱硫石膏:取自贵州某电厂,颜色为黄褐色,主要化学成分见表1。脱硫石膏综合热分析曲线、粒径分布和晶体形貌如图1所示。
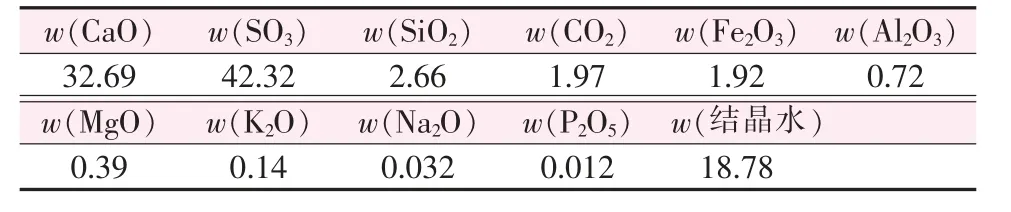
表1 脱硫石膏主要化学成分 %
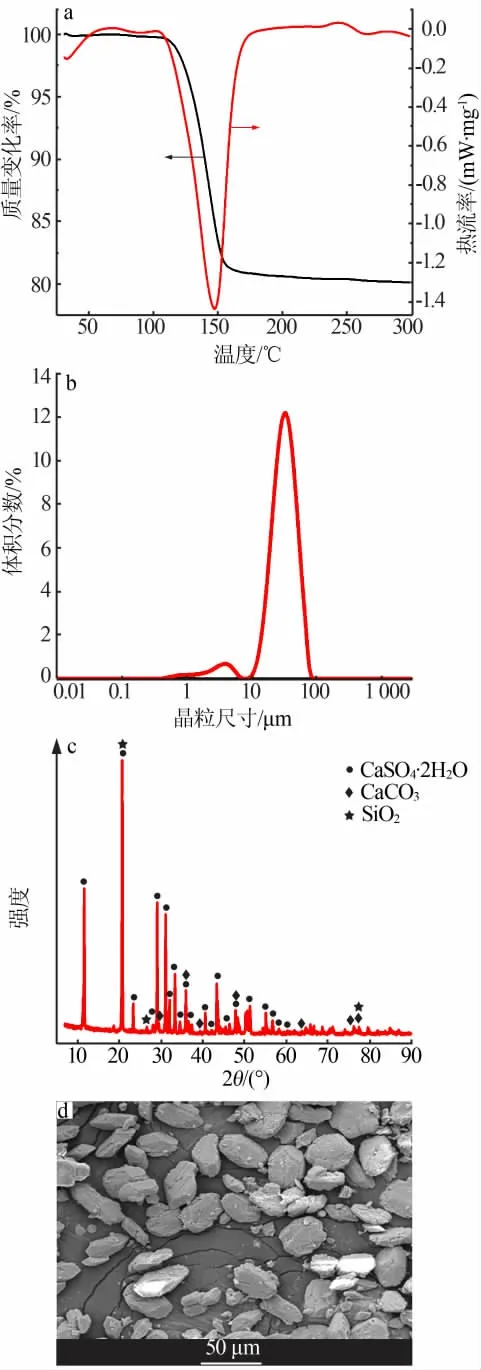
图1 脱硫石膏原料的热分析、粒径及物相组成与晶体形貌
图1 a的结果显示,脱硫石膏原料的含水率大致为19%,且在150℃附近出现二水石膏的特征吸热峰;同时由表1化学成分分析结果大致可估算出,该脱硫石膏样品中CaSO4·2H2O的质量分数约为90.79%;由此证明原矿中主要成分为CaSO4·2H2O。图1c中显示脱硫石膏中两种主要杂质为石英和碳酸钙,其质量分数分别为2.66%和1.97%,同时样品中还存在氧化铁等微量杂质。
由图1b、d可知脱硫石膏晶体一般呈不规则板状或粒状,粒度分布较为均匀,级配较佳,绝大多数颗粒处于10~100μm。
2)化学试剂:氯化钠、六水合氯化镁、氯化钾、无水氯化钙,均为分析纯(AR)试剂;无水乙醇为化学纯(CP)试剂;实验用水为蒸馏水。
1.2 实验方法
1.2.1 α-半水石膏的合成
合成基本原理是二水石膏在一定的温度和盐溶液作用下脱水转化成半水石膏,可表示为式(1):
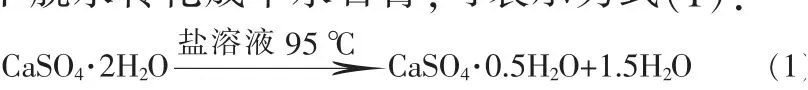
具体合成工艺:采用常压水热法,按照5%、10%、15%、20%的质量分数配制好4种盐溶液(NaCl、KCl、CaCl2、MgCl2)并加入到三口烧瓶中,用集热式恒温磁力搅拌器加热搅拌至80℃左右后,按照固液质量比1∶4加入研磨后的脱硫石膏,在95℃下热处理0~6 h进行脱水反应。按照规定的时间用注射器进行取样,利用真空泵将样品快速抽滤,用两倍取样量的近沸的水洗涤2~3次,加入无水乙醇终止反应,之后放入已恒温至55℃的烘箱中至恒重,放入干燥器中待用。
1.2.2 主要测试方法
根据GB/T 17669.2—1999《建筑石膏结晶水含量的测定》,测试试样的结晶水含量;采用NETZSCH STA 409 Luxx DSC/TG综合热分析仪对样品进行定量分析和定性识别;采用Mastersizer2000激光粒度分析仪测量样品粒径;采用D/MAX2200VPC型X射线衍射仪进行物质成分分析;采用XL30TMP型扫描电镜进行晶体形态分析和能谱分析。
2 实验结果与分析
本实验采用反应产物的结晶水含量表征脱硫石膏的脱水反应过程变化。
图2 a显示了不同浓度CaCl2溶液中生成物结晶水含量随时间变化的规律,结果可知当CaCl2溶液质量分数从5%增加到20%的过程中,随反应时间延长,反应物的结晶水质量分数一直保持在16%以上,说明在该反应条件下产物中并无半水石膏生成。这主要是由Ca2+的同离子效应导致的[15-16],半水石膏是由二水石膏溶解再结晶生成,CaSO4是一种微溶于水的固相,在溶液中存在如式(2)的溶解平衡:

因此当溶液中Ca2+浓度增加时,该溶解平衡会向左移动,同一温度下的硫酸钙的溶解度会相应偏小,导致二水石膏溶解再结晶生成半水石膏的过程受到抑制,最终产物中无半水石膏存在。
图2 b表示不同浓度MgCl2溶液中生成物结晶水含量随时间变化的规律。可以看出,随着反应过程的进行,产物结晶水质量分数始终在16%以上,结果与CaCl2组近似。导致该结果的原因是由于MgSO4离子对的形成[17-18],当MgCl2溶液质量分数介于5%~15%时,溶液中硫酸钙的溶解度普遍比在低浓度的MgCl2溶液中的溶解度要高,由于Mg2+与SO42-在较低浓度时更容易形成稳定的硫酸镁离子对,消耗了较多的SO42-,导致溶液中Ca2+与SO42-结合生成半水石膏的过程被抑制,所以在反应前期结晶水含量会有波动,但是到后期趋于18%左右。
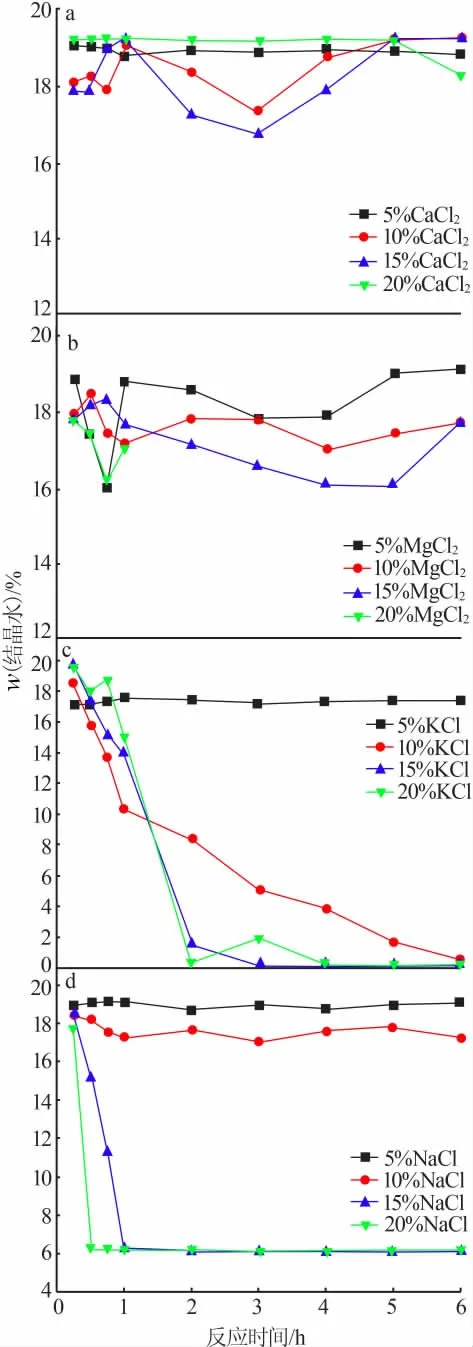
图2 溶液中反应物结晶水含量的变化
图2 c显示了不同浓度KCl溶液中生成物结晶水含量随时间变化的规律。当KCl溶液质量分数为5%时,随着反应时间的增加,产物结晶水质量分数一直保持在17%附近;KCl溶液质量分数介于10%~20%时,随着反应时间的延长,产物的结晶水含量有明显下降趋势,并且在经过一段时间的反应后结晶水质量分数均趋向于0%。
图2 d显示了不同浓度NaCl溶液中生成物结晶水含量随时间变化的规律。当NaCl溶液质量分数为5%~10%时,反应产物的结晶水质量分数维持在18%以上;当NaCl溶液质量分数提高到15%~20%时,经过1 h后两组产物中的结晶水质量分数均降低到6%左右。
由此可知,产物的结晶水含量在10%~20%KCl溶液和15%~20%NaCl溶液中反应0~6 h时可显著降低,为确定最优盐溶液种类和浓度,本文进一步对其合成产物的相组成及微观结构进行了研究。
图3 为在5%~20%KCl溶液中反应2 h合成产物与原料的XRD谱图,根据相组成结果可以得知,1)在5%KCl溶液中,经过2 h的反应,溶液中只存在二水石膏相和少许石英杂质,并无半水石膏生成。2)在10%KCl溶液中,2 h反应时间后,有少部分的脱硫石膏转变为半水石膏,与原料脱硫石膏混杂在一起。同时结合图2c中的结晶水含量变化可知,随着反应时间延长到6 h,产物的结晶水含量降至0%左右,可说明产物是无水相。3)当KCl溶液质量分数介于15%~20%,反应时间为2 h时,合成产物全部 转 变 为 无 水 钾 石 膏[K2Ca5(SO4)6],这 是 因 为 在80~105℃范围内,处于较高浓度的KCl溶液中半水石膏有脱水现象,导致CaSO4和KCl之间发生反应生成钾石膏[19-20],所以在该反应条件下无法生成半水石膏,印证了图2c中的结果。
对10%和15%KCl溶液中反应2 h时合成产物进行晶体形貌分析,SEM图如图4a~b所示。通过对比原料脱硫石膏的SEM图,能发现在该条件下所合成的物质有明显的形貌变化,在10%KCl溶液条件下,产物中块状形貌物质与针状形貌物质共存;随着KCl溶液质量分数提高到15%,产物晶粒形貌几乎全是针状,产物晶粒的纵向长度增加,直径增加,长径比变大,此种形貌对于试样成型后强度的增长并没有有益的改变。

图3 不同浓度KCl溶液中反应2 h合成产物的物相组成

图4 10%、15%KCl溶液中2 h产物SEM分析
图5 为5%~20%NaCl溶液中反应1 h时合成产物与原料的XRD谱图,结合图2d的结果分析可知,1)在5%NaCl溶液中,反应至1 h时,产物中仅存在二水石膏相和杂质石英。2)当NaCl溶液质量分数增加到10%时,有些许二水石膏转变成半水石膏,但此时产物中仍然是二水石膏相居多,所以总体的结晶水质量分数仍然保持在16%以上。3)当NaCl溶液质量分数介于15%~20%时,体系中的二水石膏全部转变为半水石膏,只有少许石英相杂质。
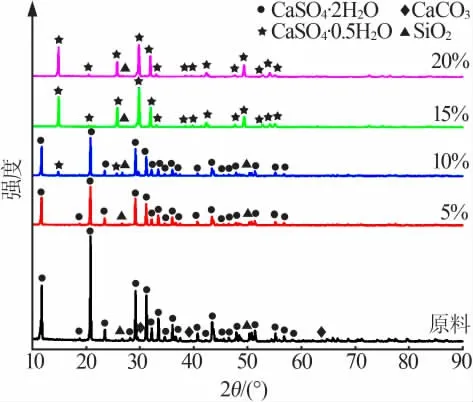
图5 不同浓度NaCl溶液中反应1 h合成产物的物相组成
对15%和20%NaCl溶液中的合成产物进行晶体形貌分析,SEM图如图6a~d所示。可以看出4份样品中的物质均为六角柱状的α-半水石膏,符合α-半水石膏的晶体形貌,可以说明在这两种合成条件下,反应体系中可以合成出α-半水石膏。当NaCl溶液质量分数为15%时,合成的α-半水石膏晶体较粗大,表面更光滑;而当NaCl溶液质量分数增加到20%时,尽管合成α-半水石膏所需的时间更短,但是产物的晶粒更为细长,结晶形态远没有15%NaCl组好。再挑选15%NaCl组中的α-半水石膏进行晶粒长径比的测量,得出产物α-半水石膏长径比大致为5∶1,符合较为优异的α-半水石膏晶体要求。

图6 不同浓度NaCl溶液中生成物的SEM图
由此可知,α-半水石膏的最佳合成工艺是:NaCl溶液质量分数为15%、反应温度为95℃、固液质量比为1∶4、搅拌器搅拌速率为150 r/min、合成时间为3 h,可以合成出长径比为5∶1的α-半水石膏。
3 结论
1)当盐溶液介质为CaCl2、盐溶液质量分数介于5%~20%时,由于Ca2+的同离子效应,致使半水石膏的结晶受到阻碍;在MgCl2盐溶液体系中,当溶液质量分数介于5%~20%时,反应初期二水石膏会有一定的脱水趋势,但由于硫酸镁离子对的生成,导致Ca2+与SO42-结合生成半水石膏变得困难,所以该条件下体系中无半水石膏生成。2)采用KCl作为溶质的合成条件下,当盐溶液浓度较低时,对二水石膏的脱水无促进作用;随着KCl溶液质量分数提高至10%以上时,KCl会导致α-半水石膏脱水,进而生成无水钾石膏。3)常压盐溶液水热法制备α-半水石膏的最佳工艺条件为:盐介质为NaCl、盐溶液质量分数为15%、反应温度为95℃、固液质量比为1∶4、溶液搅拌速率为150 r/min、合成时间为3 h,可合成出长径比为5∶1的六方短柱状α-半水石膏。

