急性缺血性脑卒中的发生与脂蛋白相关磷脂酶A2的相关性分析
姜 旭,李云慧,万 楠
(北部战区总医院 检验医学中心,辽宁 沈阳110016)
脑卒中是引起死亡和长期致残的主要原因之一[1],其中急性缺血性脑卒中是最常见的卒中类型,约占全部脑卒中的60%-80%[2]。缺血性卒中的主要病理基础是动脉粥样硬化(AS),是一种炎性反应性疾病,在粥样斑块形成、进展和最终破裂的过程中均有炎性反应介质参与[3]。脂蛋白相关磷脂酶 A2(Lp-PLA2)是磷脂酶A2家族的重要构成部分,由成熟的巨噬细胞和淋巴细胞合成和分泌,主要与氧化低密度脂蛋白结合,能水解低密度脂蛋白上的氧化卵磷脂,生成促炎物质、溶血卵磷脂和氧化型游离脂肪酸,与内皮功能障碍和斑块炎症有关,从而促进动脉粥样硬化形成[4]。因此本研究主要是探讨新型炎症标志物Lp-PLA2与急性缺血性脑卒中发生的相关性,旨在为脑血管疾病的防治提供新的依据。
1 材料与方法
1.1 研究对象
选取2019年3月至2019年5月于北部战区总医院神经内科治疗的脑卒中患者100例,根据急性卒中Or910172治疗试验(TOAST)病因/发病机制分型[5],其中大动脉粥样硬化型(LAA)54例,小动脉闭塞型(SAO)30例,心源性栓塞型(CE)5例,不明原因型(SUE)11例。收集患者年龄、性别等资料。同期选择年龄、性别与急性缺血性脑卒中组相匹配的健康查体者50例,经病史询问既往无脑血管疾病史,近期未服用任何药物者。
1.2 纳入标准
发病后48小时内入院,所有病例诊断均符合《中国急性缺血性脑卒中诊治指南2014》[2]诊断标准,且同时接受头颅计算机断层扫描(CT)或磁共振成像(MRI)检查确诊。高血压:有高血压病史,正在服用降压药或未用药,安静状态下非同日测量坐位右上臂肱动脉血压2次,取平均值,收缩压(SBP)≥140 mmHg和(或)舒张压(DBP)≥90 mmHg。所有研究对象在入院时均由临床医生对其进行美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)评定。
1.3 排除标准
有凝血机制异常导致的脑卒中,由于先天发育异常造成的脑卒中,研究前3个月罹患脑出血、蛛网膜下腔出血、硬脑膜下出血等,罹患颅内感染后遗症、肿瘤、结核、肝脏疾病和自身免疫病等。严重的全身感染或发病前4周出现潜在感染体征及症状。
1.4 标本处理
血液标本收集后直接测定空腹血糖、总胆固醇(TC)、甘油三酯(TG)等,剩余标本冻存于-80℃冰箱中。检测前将血液标本室温下放置至恢复到常温,再离心取上清检测血Lp-PLA2以及小而密低密度脂蛋白胆固醇(sdLDL-C),结合各组研究对象的其他指标进行分析研究。
1.5 仪器和试剂
血糖、TC、TG、Lp-PLA2、 sdLDL-C等所有检测项目均采用Beckman AU5800自动生化仪测定,Lp-PLA2试剂及质控品购自安徽伊普诺康生物有限公司,sdLDL-C及质控品购自北京九强生物技术有限公司,血糖试剂及质控品购自美国贝克曼库尔特公司,TC、TG、HDL-C、LDL-C、肌酐、HCRP等试剂及质控品购自四川迈克生物有限公司,CyS C、Hcy、脂蛋白a等试剂及质控品购自温州市维日康生物科技有限公司。
1.6 统计学方法

2 结果
2.1 两组研究对象的临床资料
本研究共纳入急性脑卒中患者100例,健康查体者50例,其中与健康对照组相比,病例组的HCRP、CyS C、空腹血糖、Lp-PLA2、sdLDL-C的浓度均明显升高,差异具有统计学意义(P<0.05)。两组研究对象的高血压比例、吸烟比例、肌酐、TC、TG、Hcy、脂蛋白a等指标差异无统计学意义(P>0.05),病例组的NIHSS评分为2.50(1.00-5.25),见表1。
2.2 病例组不同TOAST分型的临床资料
根据TOAST分型,不同组别的NIHSS评分有明显的不同,差异具有统计学意义(P<0.05),其中以LAA组和SUE组中的NIHSS评分较高。四组中的其他指标如HCRP、CyS C、空腹血糖、Lp-PLA2、sdLDL-C的浓度均无明显差异,无统计学意义(P>0.05),见表2。
2.3 急性缺血性脑卒中的风险因素分析
根据病例组与对照组的临床资料比较,HCRP、CyS C、空腹血糖、Lp-PLA2、sdLDL-C浓度的差异有统计学意义,因此,以急性脑卒中为因变量,将以上指标纳入到回归模型中,进行二元多因素Logistic回归,进一步分析急性脑卒中的风险因素:结果显示HCRP(OR=1.304,P=0.037)、Lp-PLA2(OR=1.015,P=0.020)是急性脑卒中发生的风险因素。
3 讨论
急性缺血性脑卒中发病率呈逐年上升趋势,是临床常见的急症重症,因其具有较高的致死率和致残率,严重威胁了人类的生命健康[6]。急性缺血性脑卒中是由于脑部动脉粥样硬化和血栓形成,使管腔狭窄甚至闭塞而导致的局部急性脑供血不足,而引起的一系列病理生理变化。整个动脉粥样硬化的发生发展过程中均有炎症介质的参与,因此通过检测血液中的炎性介质,可以有效地了解动脉粥样硬化斑块的炎症程度以及斑块的稳定性,对于预测以及判断缺血性脑卒中的发生、转归意义重大[7]。

表1 病例组和对照组的临床资料比较
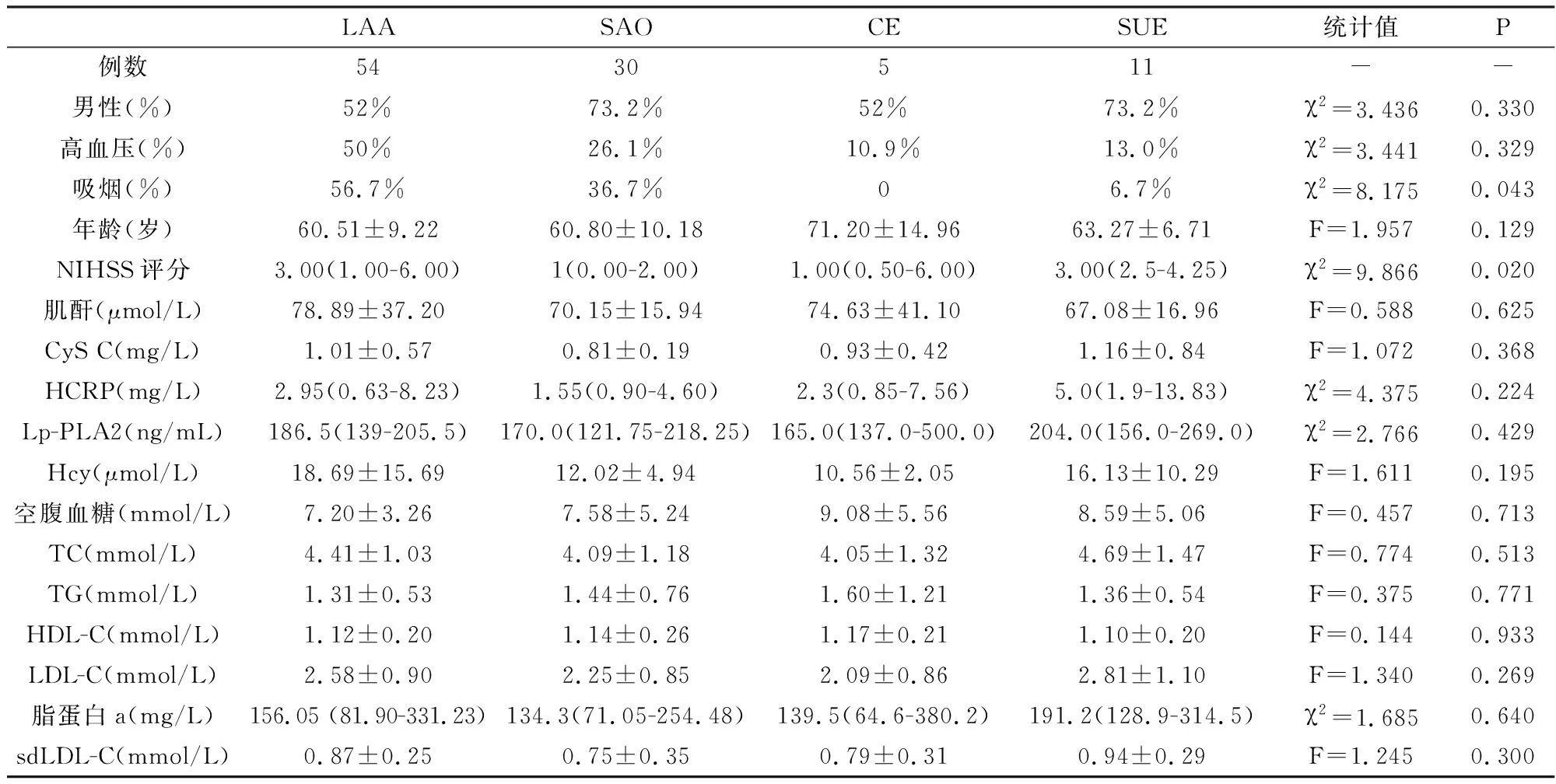
表2 病例组中不同分型的临床资料比较
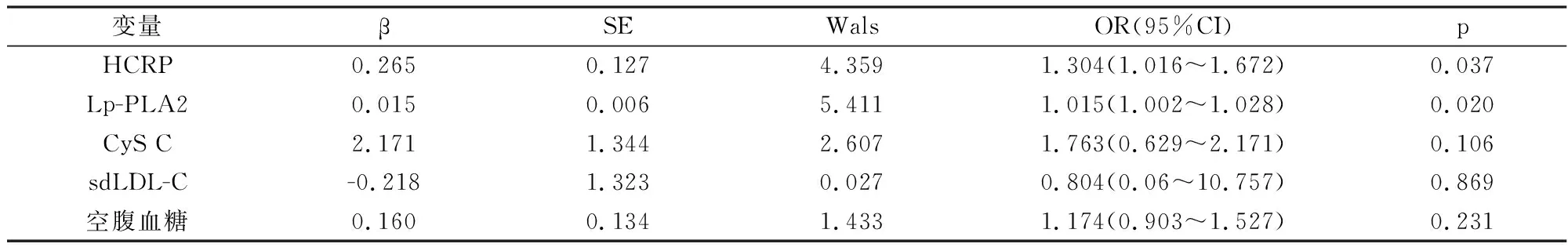
表3 急性脑卒中的风险因素分析
Lp-PLA2作为一种新的炎症介质,近年来被广泛研究。在本研究中发现,急性缺血性脑卒中患者中,Lp-PLA2的水平明显高于健康对照组,这与Ashrafi等[8]的研究一致。另外一些传统的炎症标志物如HCRP等在脑卒中患者中的浓度也有明显的升高。同时本研究发现,相较于健康对照者,急性脑卒中患者的空腹血糖,sdLDL-C以及胱抑素浓度均有所升高,这可能与糖脂质代谢紊乱是动脉粥样硬化的危险因素有关,有研究表明sdLDL-C可能是急性脑卒中的危险因素[9,10]。Hoke等[11]也发现胱抑素C是反映肾功能的较敏感的内源性指标,除了可以评价肾功能,也参与了动脉粥样硬化的发生,还可能是缺血性卒中的危险因素。
依据缺血性脑卒中的不同病因,TOAST分型可分为LAA、SAO、 CE、其他明确病因型(SOE) 及 SUE型。本研究中LAA、 SAO、CE、SUE 占比分别为54%、 30%、 5%、11%,未纳入SOE型。Katan等[12]比较各TOAST分型患者的 Lp-PLA2 水平发现, LAA人群的 Lp-PLA2 水平要显著高于其他亚型。但是在本研究中不同分型的脑卒中患者,Lp-PLA2等其他临床指标并无明显差异,仅NIHSS评分在各组有明显的差异,其中以LAA型和SUE型的NIHSS评分较高,这可能与本研究纳入的病例较少且未纳入SOE型有关。
Logistic回归模型分析表明,在调整了混杂因素以后,HCRP、Lp-PLA2是急性缺血性脑卒中风险预测和评估的危险因素。Oei等[13]通过COX回归风险比例回归模型分析显示,在白种人群中,Lp-PLA2活性越高,发生缺血性卒中风险越高,与本研究结果一致。同时,一项大型队列研究[14]也表明,HCRP可作为卒中再发的危险因素。但是也有研究[9]表明sdLDL-C是急性脑卒中的危险因素之一,然而本研究中未得到类似的结果,这可能与部分脑卒中患者长期服用过降脂药物有关。
Lp-PLA2作为炎症标志物,是急性缺血性脑卒中的风险因素之一,对预测急性缺血性脑卒中发生具有一定意义。

