明胶-羟基磷灰石与明胶-硅羟基磷灰石成骨作用的比较研究*
刘娟 孟国龙 姚瑞娟 何静 吴方*
天然骨是由有机胶原纤维和以纳米羟基磷灰石为主的无机成分组成的。无机成分中还含有微量元素或离子,如硅、锶、锌等,在骨的形成和发育过程中起着重要的作用[1-2]。Thian等[3]的研究表明,硅涂层钛的成骨细胞生长数量明显高于未涂层钛,2.2 wt%的硅含量可能是提高HA生物活性的最佳掺量。Zhao等[4]的研究发现,硅掺杂的Ti O2纳米管能显著增强小鼠前成骨细胞(MC3T3-E1)的成骨相关基因的表达。研究表明微量元素硅能够改善材料的生物活性。
在骨组织工程中,以静电纺丝为基础制备有机和无机复合材料,在结构和功能上模拟天然骨。笔者采用静电纺丝法合成了明胶-HA和明胶-SiHA纤维膜的复合材料,其具有高孔隙率、类似于天然细胞外基质(ECM)材料的纤维结构。研究表明,静电纺丝的纤维形态,包括纤维直径和纤维取向可以直接影响细胞行为[5-6]。除此之外,很多生长因子也能包裹在纺丝纤维的网格中,从而影响细胞行为[7-8]。郭瑞征等[9]的研究发现,经纳米羟基磷灰石矿化的明胶静电纺丝,可促进牙周膜成纤维细胞增殖及向成骨方向分化,且矿化时间越长,效果越明显。
在纯HA、钛、氧化钛等无机材料表面,大量研究表明硅显著提高了HA表面生物活性,而在无机和有机复合的仿生矿化材料上研究硅影响HA表面生物活性机理的较少。因此,本文主要研究微量元素硅对明胶-HA纤维复合材料表面矿化行为的影响以及其提高复合材料生物活性的机理;采用更接近体内环境的方式,共培养小鼠前成骨细胞(MC3T3-E1)和破骨细胞前体细胞(RAW264.7)的条件下,研究硅的掺入对明胶-HA复合材料表面细胞的增殖、铺展及成骨、破骨分化的影响。
1 材料与方法
1.1 实验仪器和试剂
电子天平(Excelence plus xp,梅特勒-托利多有限公司);磁力恒温搅拌器(85-2型,上海司乐仪器有限公司);注射泵(TS2-60,保定兰格恒流泵有限公司);高压静电发生器(DW-P503-2ACCD,天津动员高压电源厂);注射器(10 mL,四川康宁医用器材有限公司);加热器(KHNFJ39PTC,康佳集团股份有限公司);扫描电子显微镜(日本株式会社日立制作所,FESEM,S4800)。
材料制备所需试剂均为分析纯和化学纯(成都市科龙化工试剂厂);明胶(220LB,罗赛洛广州明胶有限公司);碳二亚胺/N-羟基琥珀酰亚胺(EDC/NHS,贝斯特试剂有限公司);模拟体液(自制,×1.2倍);小鼠前颅骨细胞(中国科学院上海细胞库,MC3T3-E1);小鼠破骨细胞前体细胞(中国科学院上海细胞库,RAW264.7);胎牛血清(FBS,HyClone,Thermo Fisher Scientific Inc.,美国);1%抗生素(Gibco,Invitrogen Corporation,美国);DMEM高糖培养基(孟德尔科技公司,成都,中国);CCK-8(同仁化学研究所);二乙酸荧光素(fluorescein diacetate,FDA,适马股份有限公司);鬼笔环肽(phalloidin,西格玛奥德里奇贸易有限公司);4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI,西格玛奥德里奇贸易有限公司);ELISA试剂盒(96T,上海蓝基生物科技有限公司)。
1.2 材料制备
1.2.1 HA和SiHA前驱液的制备
采用湿法化学法合成前驱液。将Ca(NO3)24H2O和正硅酸乙酯(TEOS)加入250 mL去离子水中,在70℃条件下水浴。(NH4)2HPO4溶于去离子水125 mL,磁力搅拌器搅拌30 min。滴加完成后,在70°C水浴中陈化24 h,得到HA-0.8wt%Si的硅羟基磷灰石前驱液。不添加TEOS步骤同上制备HA前驱液,冻干备用。
1.2.2 明胶静电纺丝膜的制备
以13 wt%明胶-2 wt%HA、13 wt%明胶-2 wt%HA-0.8%Si为原料制备纺丝液。将上述制备的纺丝液在超纯水中溶解,加热搅拌4 h,形成10 mL均匀混合物。装入10 mL注射器与不锈钢针(外径0.9 mm,内径0.6 mm)连接。电源为15 kV的高压直流电源。针头距包有一层铝箔的接收板15 cm。以推进速度为0.3 mL/h收集纺丝材料。
1.2.3 材料交联和矿化
将电纺样品剪成1 cm×1 cm小方块。交联时EDC浓度为75 mm,乙醇浓度为90%,EDC/NHS摩尔比为2.5﹕1。将剪好的样品交联12 h(4℃),取出用超纯水洗3次。再将样品浸泡在装有10 mL 1.2×SBF的离心管中矿化,离心管置于37℃水浴1、3、7 d。
1.3 材料表面形貌观察
用场发射扫描电子显微镜分别观察电纺样品、交联样品和矿化样品的表面形貌。
1.4 细胞共培养
将细胞MC3T3-E1(接种密度为1×104/mL)接种于矿化后的样品上。细胞培养基采用含10%血清的DMEM。培养基2 d换1次。培养MC3T3-E1培养至第3 d时,接种小鼠破骨细胞前体细胞RAW264.7(接种密度为10×104/mL)到材料表面进行共培养。
1.5 细胞增殖
细胞培养至1、3、7 d时,采用细胞计数试剂(cell counting kit-8,CCK-8)培养(37℃)4 h后,使用酶标仪(450 nm)测量吸光度(OD值)。
1.6 细胞形态观察
细胞共培养3 d后,分别使用二乙酸荧光素(FDA)、鬼笔环肽(phalloidin)和4',6-二脒基-2-苯基吲哚(DAPI)染色后用激光共聚焦显微镜观察细胞。
1.7 成骨、破骨分化相关标志物检测
细胞在材料表面分别培养2、7、14 d后,用酶联免疫吸附测定(enzyme linked immuno sorbent assay,ELISA)试剂盒测定成骨分化标志蛋白因子碱性磷酸酶(alkaline phosphatase,ALP)、I型胶原(collagen-1,COL-1)和破骨相关蛋白因子白细胞介素1(interleukin-1,IL-1)、破骨分化标志蛋白因子抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRAP)的表达量。用酶标仪(450 nm)测定样品浓度。
2 结果
2.1 材料表征
2.1.1 静电纺丝纤维
两组样品在交联前均有均匀光滑的纤维,无机团聚体散布于纤维间,纳米纤维的直径大多在200~350 nm;样品交联后,纤维仍保持光滑、均匀的结构,但纤维直径为400~500 nm。交联前后电纺明胶-HA、明胶-Si HA样品表面的扫描电镜图如图1所示。

图1 A、B.交联前电纺明胶-HA、明胶-SiHA样品表面的扫描电镜图;C、D.交联后电纺明胶-HA、明胶-SiHA样品表面的扫描电镜图
2.1.2 矿化表征
明胶-HA和明胶-SiHA复合纳米纤维矿化1、3、7 d表面的扫描电镜图如图2所示。两组材料表面均有大量的矿物沉积物。明胶-HA样品纤维表面呈球状沉积,随着时间延长,矿化晶体持续生长,典型的非均匀形核结构。明胶-SiHA样品则沿纳米纤维矿化,样品在整个矿化过程中,纤维结构保持稳定。

图2 A.明胶-HA矿化1 d表面扫描电镜图;B.明胶-SiHA矿化1 d表面扫描电镜图;C.明胶-HA矿化3 d表面扫描电镜图;D.明胶-SiHA矿化3 d表面扫描电镜图;E.明胶-HA矿化7 d表面扫描电镜图;F.明胶-SiHA矿化7 d表面扫描电镜图
2.2 生物活性检测
2.2.1 细胞形态观察
两组材料表面培养3 d后的细胞FDA染色结果如图3A、图3B所示。可以看到,梭形的MC3T3-E1和圆形的RAW264.7共同存在于两组材料表面。明胶-SiHA样品上细胞数量要多于明胶-HA样品。两组材料表面培养3 d后的细胞骨架和细胞核染色结果如图3C、图3D所示。明胶-SiHA样品的细胞数量要多于明胶-HA样品,MC3T3-E1的细胞骨架呈梭形状,同时存在圆形的RAW264.7。
从图3可以看出,相比于明胶-HA组,明胶-SiHA组材料表面的细胞铺展更大,圆形的RAW264.7细胞堆积较明显。
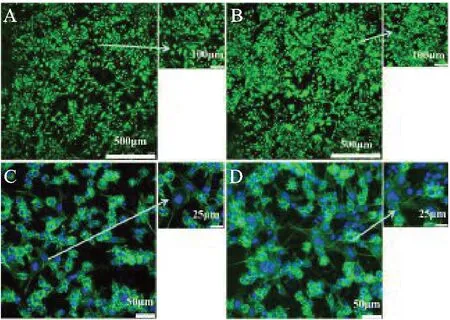
图3 A.明胶-HA表面培养3 d后细胞FDA染色结果;B.明胶-SiHA表面培养3 d后细胞FDA染色结果;C.明胶-HA表面培养3 d后细胞鬼笔环肽染色结果;D.明胶-SiHA表面培养3 d后细胞鬼笔环肽染色结果
2.2.2 细胞增殖测试结果
随着培养时间的增加,两组材料的OD值都逐渐上升,说明两组样品都有良好的生物相容性。在整个共培养过程中,明胶-SiHA样品的增殖情况要大于明胶-HA组。前期(1、3 d)两组材料比较差异有统计学意义,后期(7 d)两组间比较差异无统计学意义。两种细胞接种于不同材料上培养1、3、7 d的增殖测试结果如图4所示。

图4 两种细胞接种于明胶-HA和明胶-SiHA材料共培养1、3、7 d的增殖检测情况:*表示明胶-SiHA组与明胶-HA组比较,P<0.05;**表示明胶-SiHA组与明胶-HA组比较,P<0.01
2.2.3 成骨、破骨分化标志蛋白量检测
随着时间的增加,明胶-HA的ALP表达量逐渐降低,而明胶-SiHA的ALP表达量并未变现出有明显的变化趋势;两组材料的COL-1表达量都随着时间的增加而增多,组间比较差异无统计学意义(P>0.05)。成骨分化标志蛋白ALP、COL-1的检测结果见图5A、图5B。在前期2 d和7 d时,两组材料的TRAP、IL-1表达量差异均无统计学意义,到14 d时,两种破骨分化因子在明胶-SiHA样品的表达量均略高于明胶-HA样品,但差异也无统计学意义(P>0.05)。破骨分化标志物TRAP、IL-1的检测结果如图5C、图5D所示。

图5 共培养细胞分化相关蛋白含量的检测:A、B.成骨分化标志物ALP、COL-1表达量;C、D.破骨分化标志物TRAP、IL-1表达量
3 讨论
深入了解矿化过程有助于笔者更好地模拟天然骨环境,设计先进骨组织材料。然而对硅如何提高HA生物活性的研究较少,笔者推测其可能通过调节明胶纤维的矿化,进而对HA生物活性产生影响。为此,笔者系统研究了硅对明胶-HA复合纤维生物活性的影响。
材料表征结果表明,明胶-HA呈球状矿化沉积物,典型的非均相成核。而明胶-SiHA复合纳米纤维矿化发生在沿纳米纤维方向。整个矿化过程中明胶-SiHA样品保持了良好的纤维结构,而明胶-HA矿化后期几乎没有纤维结构。硅的掺入导致明胶-HA纳米纤维的成核行为发生了显著的变化,从典型的非均匀矿化到纤维内的更均匀的沿丝矿化,材料表面提供了更多的Ca-P沉积成核位点[10]。细胞增殖结果显示,硅元素能促进细胞在早期(1、3 d)的增殖,到7 d时变得不明显[3]。细胞黏附和铺展结果表明,明胶-SiHA表面的细胞数量明显多于明胶-HA样品,并且MC3T3-E1细胞骨架更清晰完整,说明硅对成骨细胞黏附及铺展都有促进作用[3,10]。研究表明电纺丝的纤维形态可以直接或间接影响细胞行为[5-8]。具有良好的纤维结构且表面有均匀的沿丝矿化结构的明胶-SiHA相对于明胶-HA对HA生物活性的促进作用明显。
共培养时,成骨和破骨相关蛋白检测表明,硅对于前成骨细胞向成骨细胞和破骨前体细胞向破骨细胞的分化行为影响不明显。这可能跟细胞的所处的环境相关,成骨细胞和破骨细胞会分泌相关抑制因子,使共培养系统处于相对平衡的状态,这是体内细胞的一种稳定状态。这种平衡一旦打破,就会使某一种细胞处于支配地位,进而导致骨质增生或风湿等疾病。所以在共培养条件下更能模拟体内环境,且更能揭示体内的微量元素硅提高明胶-HA表面的生物活性的机理[11]。
硅能提高材料表面的生物性能,原因是由于其改变明胶-HA表面的矿化行为,使材料表面的矿化呈均匀的沿明胶纤维矿化,且使材料表面有更多Ca-P沉积成核位点。在成骨相关和破骨相关细胞共培养的情况下,硅的掺入能促进明胶-HA表面细胞的早期增殖,但对成骨和破骨细胞的分化影响不明显。因此,在更接近体内环境的共培养条件下,明胶-HA材料表面的生物活性的提高与表面的矿化行为有着重要的联系。研究其对生物活性提高的机理,对将来可能将微量元素用于骨修复,或者作为减少植入材料体炎症等提供一定的基础研究理论。

