富马酸二甲酯肠溶胶囊微生物限度方法学的研究
北京市药品检验所 国家药品监督管理局仿制药研究与评价重点实验室 中药成分分析与生物评价北京市重点实验室(102206)张光华 李玉立 牛振东 刘文杰 江志杰
富马酸二甲酯肠溶胶囊由Biogen Idec公司开发,用于复发型多发性硬化症患者的治疗,FDA于2013年3月27日批准其上市,商品名 Tecfidera[1]。富马酸二甲酯(DMF)具有高效的抗菌的特性,能有效抑制多种霉菌、酵母菌、细菌的生长[2][3]。DMF进入微生物体内,抑制微生物细胞的分裂,并通过对三羧酸循环(TCAC)磷酸已糖途径(HMP)和酵解途径(EMP)的酶活性的抑制来抑制微生物呼吸作用,从而使微生物的生长繁殖被有效控制。微生物限度检查是中国药典 2015 年版胶囊剂项下的检查项,是药品安全性指标之一。中国药典 2015 年版四部通则1107[4]非无菌药品微生物限度标准规定:胶囊剂需氧菌总数不得过103cfu/g、霉菌和酵母菌总数不得过102cfu/g,1g中不得检出大肠埃希菌。本试验按照中国药典 2015 年版四部通则1105、1106[4]的要求,综合考虑消除抑菌性及简便易操作等因素,消除了DMF的抑菌性,建立了科学的微生物限度检查方法,极大地保证了药品的安全性,也为其他有抑菌性的药品建立微生物限度检查方法起到较好的参考作用。
1 仪器与材料
1.1 仪器 LRH-250生化培养箱(上海一恒);电热脉动真空灭菌器(山东新华XG1.DMXD-0.36);生物安全柜(热电1300SERIESA2); PL2002电子天平(梅特勒);Max Q 6000恒温摇床(Thermo),电动吸引器(斯曼峰YX930D;微孔滤膜0.45 μm(Satorius)。
1.2 药品 富马酸二甲酯肠溶胶囊,规格:240mg,批号:GCYEDLSA00,GEREDLS900,GEREDLSC00;由Vifor Pharma,Vifor SA生产。
1.3 试验菌种 枯草芽孢杆菌Bacillus subtilis[CMCC(B)63501]、铜绿假单胞菌Pseudomonas aeruginosa [CMCC(B)10104]、金黄色葡萄球菌Staphylococcus aureus [CMCC(B)26003]、大肠埃希菌Escherichia coli[CMCC(B)44102]、白色念珠菌Candida albicans[CMCC(F)98001]、黑曲霉Aspergillus niger[CMCC(F)98003]。购自中国食品药品检定研究院,菌株传代数为第Ⅲ代。
1.4 培养基和试剂 胰酪大豆胨液体培养基(TSA)、胰酪大豆胨琼脂培养基(SDA)、沙氏葡萄糖液体培养基、沙氏葡萄糖琼脂培养基,由美国BD公司提供。
pH7.0无菌氯化钠-蛋白胨缓冲液、麦康凯液体培养基、麦康凯琼脂培养基,由北京奥博星生物技术有限责任公司提供。
聚山梨酯80由国药集团化学试剂有限公司提供。卵磷脂由 Sigma 公司提供。无菌十四烷酸异丙酯由北京牛牛基因公司提供。
2 方法与结果
2.1 菌液制备 按中国药典2015版四部通则1105[4]微生物计数法进行。
2.2 培养基的适用性检查 所有培养基均在验证合格的灭菌程序下灭菌,并按中国药典 2015 版四部通则1105[4]微生物计数法进行培养基的适用性检查,结果均符合要求。
2.3 供试液制备 萃取法:取本品10g,加pH7.0无菌氯化钠-蛋白胨缓冲液至500mL,振摇使供试品分散均匀,再加入十四烷酸异丙酯50mL,振摇,静置待油水分层,取水层作为1∶50的供试液。
2.4 微生物计数方法适用性试验(薄膜过滤法)。
2.4.1 菌液对照组 取pH7.0无菌氯化钠-蛋白胨缓冲液9.9mL,加入制备好的试验菌液0.1mL(细菌、酵母菌500cfu~1000cfu,霉菌300cfu~600cfu),混匀,使每1mL稀释液中含菌量为30cfu~100cfu。分别取上述菌悬液1mL注入平皿中,测定其每毫升的活菌数,结果见附表1。
2.4.2 试验组 取1∶50的供试液5mL 5份,分别加至含3%聚山梨酯80和0.3%卵磷脂的pH7.0无菌氯化钠-蛋白胨缓冲液100mL中,采用薄膜过滤法,用含3%聚山梨酯80和0.3%卵磷脂的pH7.0无菌氯化钠-蛋白胨缓冲液为冲洗液分3次冲洗(每次100mL),在最后一次冲洗液中平行加入菌液对照组(2.4.1)制备好的枯草芽孢杆菌、铜绿假单胞菌、金黄色葡萄球菌、白色念珠菌、黑曲霉菌液1mL(30cfu~100cfu),取滤膜,测定需氧菌总数,结果见附表1。
另1∶50的供试液5mL 2份,分别加至含3%聚山梨酯80和0.3%卵磷脂的pH7.0无菌氯化钠-蛋白胨缓冲液100mL中,采用薄膜过滤法,用含3%聚山梨酯80和0.3%卵磷脂的pH7.0无菌氯化钠-蛋白胨缓冲液为冲洗液分3次冲洗(每次100mL),在最后一次冲洗液中平行加入菌液对照组(2.4.1)制备好的白色念珠菌、黑曲霉菌液1mL(30cfu~100cfu),取滤膜,测定供试品的霉菌和酵母菌总数,结果见附表1。
2.4.3 供试品组 取1∶50的供试液5mL,加至含3%聚山梨酯80和0.3%卵磷脂的pH7.0无菌氯化钠-蛋白胨缓冲液100mL中,采用薄膜过滤法,用含3%聚山梨酯80和0.3%卵磷脂的pH7.0无菌氯化钠-蛋白胨缓冲液为冲洗液分3次冲洗(每次100mL),取滤膜,测定供试品的需氧菌总数、霉菌和酵母菌总数,结果见附表1。
2.4.4 稀释剂对照组 取菌液对照组(2.4.1)制备好的试验菌液1mL(细菌、酵母菌5000cfu~10000cfu,霉菌3000cfu~6000cfu),加至pH7.0无菌氯化钠-蛋白胨缓冲液100mL中,摇匀,再加入十四烷酸异丙酯10mL,振摇,静置待油水分层,取水层作为稀释剂对照液,取稀释剂对照液1mL,置含3%聚山梨酯80和0.3%大豆卵磷脂的pH7.0无菌氯化钠-蛋白胨缓冲液90mL中,采用薄膜过滤法,以含3%聚山梨酯80和0.3%大豆卵磷脂的pH7.0无菌氯化钠-蛋白胨缓冲液为冲洗液分3次冲洗(每次100mL),取滤膜,测定需氧菌总数、霉菌和酵母菌总数,测定结果附表1。
需氧菌总数测定,取滤膜贴于含3%聚山梨酯80和0.3%大豆卵磷脂的胰酪大豆胨琼脂培养基平板上,置33℃培养5天,逐日观察结果。霉菌和酵母菌总数测定,取滤膜贴于含3%聚山梨酯80和0.3%大豆卵磷脂的沙氏葡萄糖琼脂培养基平板上,置23℃培养7天,逐日观察结果。
由附表1数据可见,稀释剂对照组回收比值均在0.5~2.0范围内,表明用十四烷酸异丙酯萃取和用含3% Tween 80和0.3%卵磷脂的pH7.0无菌氯化钠-蛋白胨缓冲液冲洗及培养基中添加3% Tween 80和0.3%卵磷脂对微生物回收无影响[6][7][8]。
富马酸二甲酯肠溶胶囊的枯草芽孢杆菌、铜绿假单胞菌、金黄色葡萄球菌、白色念珠菌、黑曲霉菌的回收比值均在0.5~2.0范围内,表明采用稀释法、萃取法、中和法及薄膜过滤法联用在本试验中是有效性的,该法进行富马酸二甲酯肠溶胶囊的需氧菌总数计数、霉菌和酵母菌数总数计数方法准确、可行。
2.5 控制菌检查方法适用性试验
2.5.1 供试品组 取1∶50的供试液10mL,加至含3%聚山梨酯80和0.3%大豆卵磷脂的pH7.0无菌氯化钠-蛋白胨缓冲液90mL中,采用薄膜过滤法,以含3%聚山梨酯80和0.3%大豆卵磷脂的pH7.0无菌氯化钠-蛋白胨缓冲液为冲洗液分3次冲洗(每次100mL),取滤膜,置含3%聚山梨酯80和0.3%大豆卵磷脂的胰酪大豆胨液体培养基100mL中,制备5份,33℃培养24小时。
2.5.2 阴性对照组 取稀释液10mL,置含3%聚山梨酯80和0.3%大豆卵磷脂的胰酪大豆胨液体培养基100mL中,33℃培养24小时。
2.5.3 阳性对照组 取1∶50的供试液10mL,加至含3%聚山梨酯80和0.3%大豆卵磷脂的pH7.0无菌氯化钠-蛋白胨缓冲液90mL中,采用薄膜过滤法,以含3%聚山梨酯80和0.3%大豆卵磷脂的pH7.0无菌氯化钠-蛋白胨缓冲液为冲洗液分3次冲洗(每次100mL),在最后一次冲洗液中加入不大于100cfu的大肠埃希菌,置含3%聚山梨酯80和0.3%大豆卵磷脂的胰酪大豆胨液体培养基100mL中, 33℃培养24小时。分别取上述预培养物1mL ,加至麦康凯液体培养基100mL中,42℃培养24小时后,再分别划线于麦康凯琼脂平板上,33℃培养24小时,观察结果,具体情况见附表2。
从附表2结果可以看出,阳性对照菌生长良好,表明富马酸二甲酯肠溶胶囊在该条件下对大肠埃希菌无抑菌作用或其抑菌作用可以忽略不计。说明采用该法进行富马酸二甲酯肠溶胶囊的大肠埃希菌检查可行。
3 讨论
3.1 无菌十四烷酸异丙酯的应用 富马酸二甲酯(DMF)为白色结晶或结晶粉末,溶于乙酸乙酯、氯仿、丙酮和醇类,微溶于乙醚,不溶于水。基于这一特性,本试验选取无菌十四烷酸异丙酯作为萃取液[5][6],使供试液中的DMF含量达到最低。
3.2 中和剂Tween80和 卵磷脂的应用Tween 80和卵磷脂是中国药典、欧洲药典收载的常用中和剂,可添加至稀释剂、冲洗液、或培养基中。Tween 80为非离子表面活性剂,卵磷脂为两性离子表面活性剂,可降低季按类化合物、酚、醛、对羟基苯甲酸类、碘酒、洗必太类、石炭酸类的药物的活性[4]。
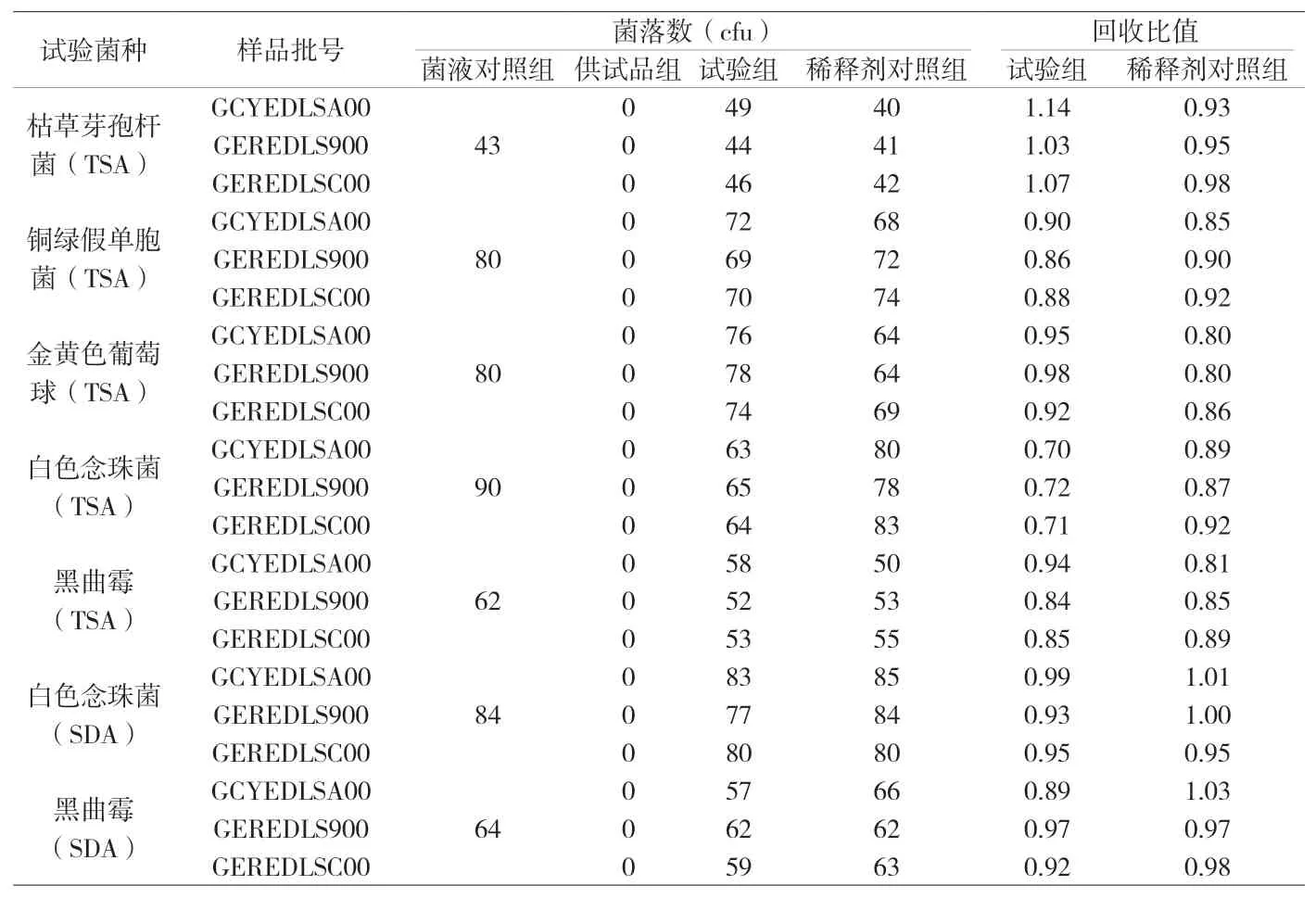
附表1 微生物计数方法适用性试验回收结果

附表2 控制菌检查方法适用性试验结果
卵磷脂是细胞膜上最主要的脂质,其所拥有的脂肪酸种类会影响细胞的流动性及通透性;卵磷脂也通过影响细胞膜上许多酵素的功能来调控细胞生长;卵磷脂能改变细胞膜功能;是细胞膜修复的营养剂[7][8]。实验证明冲洗液和培养基中添加3% Tween 80、0.3% 卵磷脂起到了降低抑菌作用的效果。
3.3 试验中遇到的问题 微生物计数适用性试验初期采用了单一的平皿法、培养基稀释法进行,各验证菌株回收率均为0,改用普通薄膜过滤法,并用不同的冲洗量进行试验,各验证菌株回收率仍小于0.5,查阅DMF的特性后增加了萃取步骤。为了使萃取效果达到最佳,将供试液制备为1∶50的供试液。冲洗液和培养基中添加3% Tween 80、0.3%卵磷脂起到了增加DMF的溶解性及中和作用两种效果。
控制菌检查要求1g中不得检出大肠埃希菌,验证试验中曾尝试过滤1∶50的供试液50mL,并用不同的冲洗量进行试验,冲洗量达到1000mL时,阳性对照菌大肠埃希菌仍然不能生长,说明滤膜上残留的DMF对大肠埃希菌仍有抑制。由于药典规定每张滤膜冲洗量不得大于1000mL,故将1∶50的供试液50mL分5张膜进行薄膜过滤,制备5份进行试验。
本文只将最后确认的方法进行了体现。