CDCA3在下咽鳞癌中的表达及临床意义
吴俊福 代立媛 崔萌 杜伟 刘善廷 娄卫华
下咽鳞癌的恶性程度较高,5年总生存率仅为15%~45%,近几十年无较大的改善[1],在治疗上具有挑战性。下咽鳞癌侵袭性强,早期易发生黏膜下扩散,颈部转移风险高。据报道约60%~80%患者发生同侧颈部淋巴结转移,40%患者有对侧颈部淋巴结隐匿性转移,而且疾病的早期即可出现颈部淋巴结和远处转移,是影响预后的重要因素[2]。因此,寻找与下咽鳞癌生长、转移及预后相关的分子标记物对研究其发生发展、生物学行为及治疗具有十分重要的临床意义。
细胞的快速生长和分裂是包括下咽鳞癌在内的所有恶性肿瘤的共同特征。细胞周期调节蛋白的不适当表达可以促进肿瘤的发生[3]。大量研究报道了癌变与细胞周期相关基因的关系。特别是近期的研究表明,对G1/S 阶段靶点的Skp1-cullin-F-box(SCF)控制的放松也可能有助于肿瘤的发生。作为SCF 组分之一的细胞分裂周期相关蛋白3(cell division cycle associated protein 3,CDCA3)与肿瘤的关系近年来受到关注。研究发现,CDCA3在多种肿瘤中表达上调,与肿瘤预后存在密切的关系,有可能成为治疗的新靶标。但是CDCA3在下咽鳞癌中的表达情况及与预后的关系国内外鲜见相关报道。
本研究从Oncomine肿瘤芯片数据库中的肿瘤基因组图谱(TCGA)数据集中分析得到CDCA3 在头颈部鳞癌及癌旁正常组织中存在DNA 表达差异,结合患者的临床病理特征及随访资料,分析CDCA3 与下咽鳞癌患者临床病理特征及预后之间的关系。
1 材料与方法
1.1 病例资料
下咽鳞癌组织和癌旁正常黏膜组织均取自2018年9月至2019年9月郑州大学附属肿瘤医院手术切除的15 例下咽鳞癌患者(表1)。切除的组织标本在手术离体后快速冷冻,液氮保存。其它肿瘤组织进行常规病理诊断。并扩大样本量收集临床资料完整的80 例下咽鳞癌患者的石蜡切片进行免疫组织化学检测。标本选自2010年7月到2015年7月本院手术的下咽鳞癌患者。所有入选病例均符合条件:1)术前未进行放、化疗的初治患者;2)术后病理诊断为下咽鳞癌;3)接受包括手术切除在内的标准治疗。所有病例临床资料均完整可靠,均签署书面知情同意书,获得本院伦理委员会批准。所有患者通过门诊或住院就诊、电话、微信等方式随访,确诊时间为起点,均进行5年随访,期间若有肿瘤复发、转移或死亡则终止随访。
1.2 方法
1.2.1 主要试剂及抗体 RNA提取试剂盒购自上海普飞公司,M-MLV 试剂盒购自美国Promega 公司,BCA 蛋白定量试剂盒购自上海Beyotime 公司,dNTPs购自美国Promega公司,辣根过氧化物酶标记的兔抗羊二抗购自美国Cell Signaling Technology 公司,GAPDH 抗体购自美国Santa-Cruz 公司,CDCA3 抗体购自美国Sigma 公司,预染蛋白Marker 购自美国Thermo Fisher Scientific公司
1.2.2 实验方法 1)qRT-PCR检测CDCA3在下咽鳞癌和癌旁组织中的mRNA 表达:CDCA3 引物长度为261 bp,上游引物为5′-ATTGCACGGACACCTATGA-3′,下游引物为5′-TGTGGGCTGTCTTGCTTC-3′。GAPDH的引物长度为121 bp,上游引物为5′-TGACTTCAACAG CGACACCCA-3′,下游引物为5′-CACCCTGTTGCTGT AGCCAAA-3′。取15例下咽鳞癌组织和癌旁正常黏膜组织,Trizol提取总RNA,反转录获得cDNA,进行qPCR扩增,使用2-△△cT法计算并分析CDCA3的mRNA相对表达量。
2)应用Western blot 法检测CDCA3 在下咽鳞癌和癌旁组织中的蛋白表达:随机选取5对下咽鳞癌组织和癌旁正常黏膜组织检测CDCA3 蛋白表达水平。组织样品在冰上剪碎后用RIPA 裂解液提取蛋白质,用BCA蛋白定量试剂盒(上海碧云天公司)定量。将提取的蛋白样品用SDS-PAGE 分离并转移至PVDF膜上,然后用特定的一抗和适当的二抗进行免疫印迹。使用ECL-PLUS试剂盒检测蛋白条带。
3)采用免疫组织化学法检测CDCA3在下咽鳞癌中的表达:将80 例下咽鳞癌石蜡块连续切片,切片厚度约4 μm,置入60℃烘箱内烤片。在柠檬酸缓冲液中进行抗原修复之前,梯度酒精中水化。切片与抗CDCA3(1:150 稀释度)一抗在4℃下孵育过夜。PBS洗涤3次后,将辣根过氧化物酶标记的抗兔二抗在37℃孵育1 h。本院病理科两位病理医师各自在光学显微镜下判读所有的IHC 染色切片。根据细胞染色的强弱直观评分:0 分阴性(无染色),1 分弱阳性(淡黄色),2分阳性(棕黄色),3分强阳性(棕色)。阳性细胞染色率评分:0分(<5%),1分(5%~30%),2分(31%~50%),3分(5l%~75%),4分(>75%)。CDCA3染色评分由CDCA3 染色强度与百分比总分之和确定。总分≥4分为CDCA3阳性表达,总分<4分为阴性表达。
1.3 统计学方法
采用SPSS 20.0软件进行统计学分析。数据为计数资料,组间比较用χ2检验。生存率估计采用Kaplan-Meier法,生存时间间比较用对数秩检验。单因素Cox 回归模型分析影响预后的因素,多因素Cox 回归模型进一步分析影响预后的因素。所有统计学分析均为双侧,以P<0.05为差异具有统计学意义。
2 结果
2.1 CDCA3 DNA拷贝数在头颈鳞癌组织中的表达
在Oncomine 肿瘤芯片数据库的TCGA 数据集中进行差异分析,结果显示CDCA3 在头颈鳞癌组织和正常组织之间差异显著,相比全血及头颈部正常组织,CDCA3的DNA拷贝数在头颈鳞癌组织中显著上调(P=3.81E-13,图1)。
2.2 CDCA3 mRNA及蛋白在下咽鳞癌组织中的表达
通过在Oncomine肿瘤芯片数据库中进行差异分析,本研究采用实时荧光定量反转录PCR 检测了15对新鲜下咽鳞癌组织及癌旁正常黏膜中CDCA3的表达情况。结果显示与配对癌旁正常下咽黏膜相比,下咽鳞癌组织中CDCA3 的mRNA 相对表达水平升高,差异具有统计学意义(P<0.05,图2)。同时随机选择5 对下咽鳞癌及癌旁正常组织应用Western blot法检测CDCA3的蛋白表达情况,结果显示CDCA3在下咽鳞癌组织中的相对蛋白表量较癌旁正常组织显著升高(图3)。

表1 15例下咽鳞癌患者的临床特征
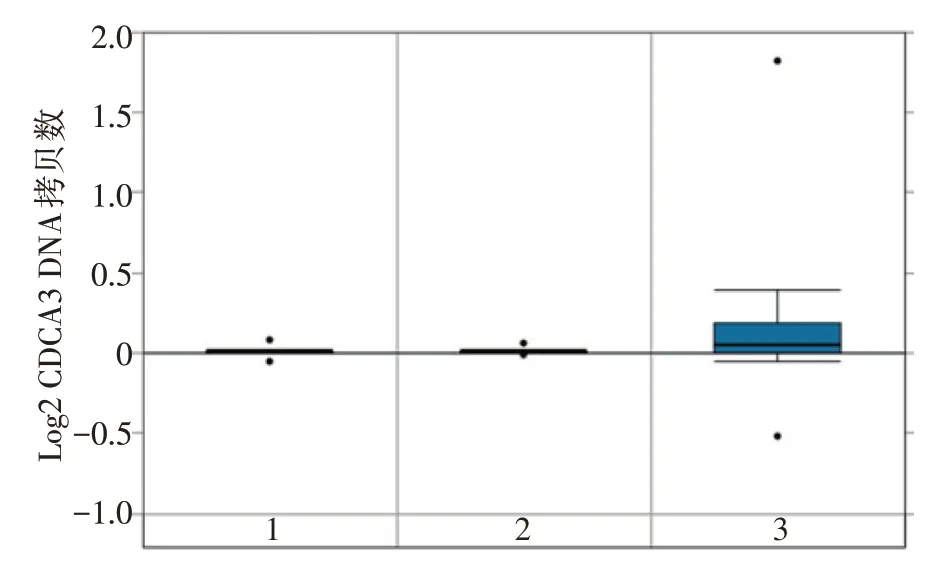
图1 CDCA3 基因的DNA 拷贝数在头颈鳞癌组织、全血及正常头颈部组织中的表达
2.3 CDCA3在下咽鳞癌中的表达与临床病例特征的相关性分析
采用免疫组织化学法检测80例患者的临床病理特征(表2)。CDCA3在下咽鳞癌中的表达,结果显示CDCA3 蛋白主要在胞质中表达(图4)。CDCA3 在81.2%(65/80)的下咽鳞癌组织中阳性表达,在18.8%(15/80)阴性表达。分析CDCA3 与下咽鳞癌临床病理特征的关系(表3),结果表明T1~T2 组CDCA3 的相对表达水平低于T3~T4 组,差异具有统计学意义(P<0.05)。无淋巴结转移组CDCA3的相对表达水平低于淋巴结转移组,差异具有统计学意义(P<0.05)。Ⅰ+Ⅱ期组中CDCA3 的相对表达水平低于Ⅲ+Ⅳ期组,差异具有统计学意义(P<0.05)。CDCA3 的相对表达水平与患者的性别、年龄、肿瘤的原发部位、吸烟饮酒史、病理分级等无关(P>0.05)。
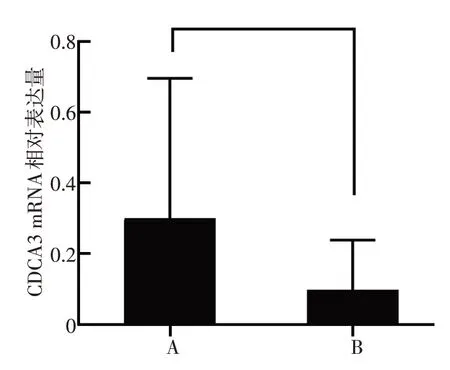
图2 CDCA3 mRNA在下咽鳞癌组织及癌旁正常组织的表达
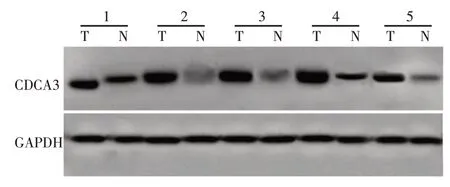
图3 CDCA3蛋白在下咽鳞癌组织及癌旁组织的表达
2.4 CDCA3表达与下咽鳞癌患者预后的关系
采用Kaplan-Meier 生存曲线分析结果提示,CDCA3表达上调与生存时间显著相关。CDCA3阳性表达组患者的总生存期显著低于CDCA3阴性表达组(P=0.001,图5)。CDCA3阳性表达病例组5年生存率为16.4%,而CDCA3阴性表达病例组为35.6%。单因素Cox 比例风险回归分析提示,CDCA3 表达、肿瘤大小、临床分期和淋巴结转移是影响预后的因素。多因素Cox比例风险回归分析表明,CDCA3表达是影响下咽鳞癌患者生存状态的独立预后因素(P<0.05),而肿瘤大小(T分期)、区域性淋巴结转移情况及TNM分期均不能作为患者的独立预后危险因素,其协同发挥作用影响下咽鳞癌患者的预后(表4)。
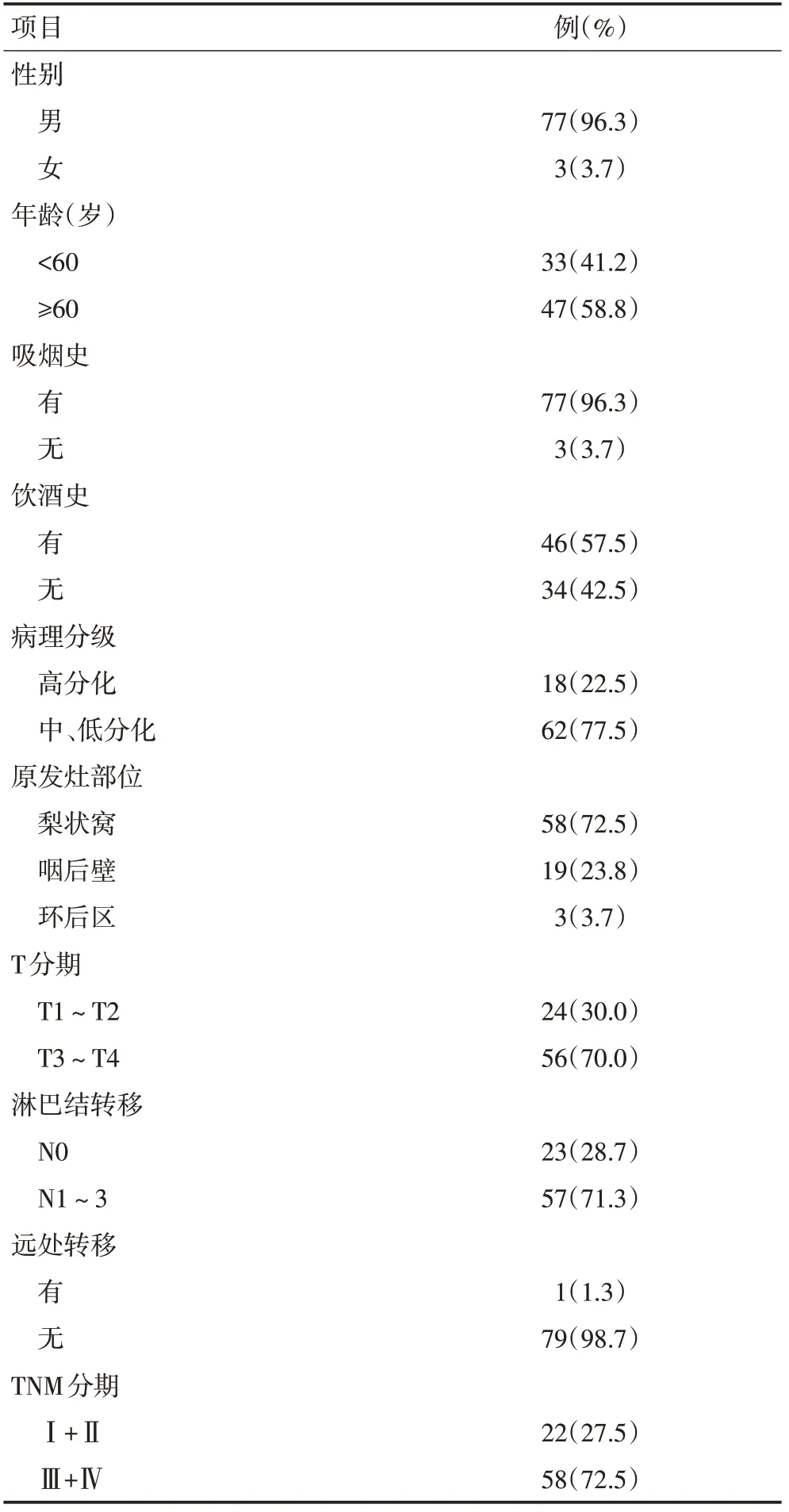
表2 80例下咽鳞癌患者的临床病理特征
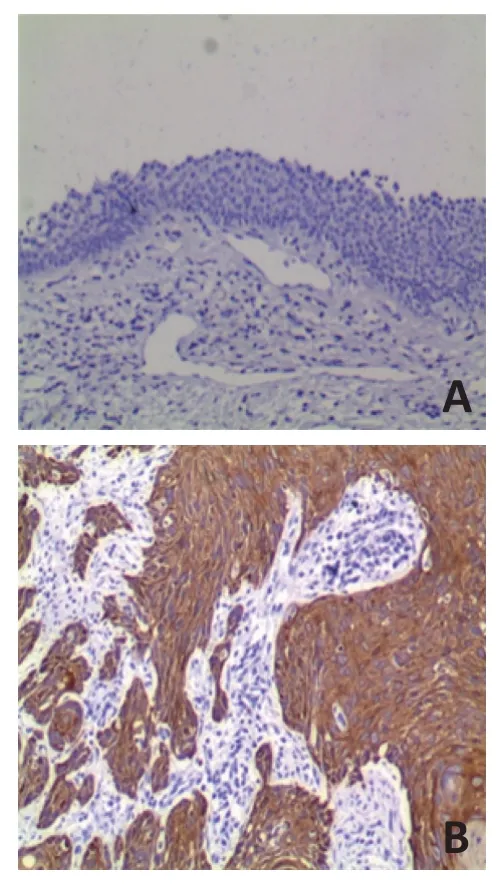
图4 CDCA3在下咽鳞癌中的表达(IHC×100)
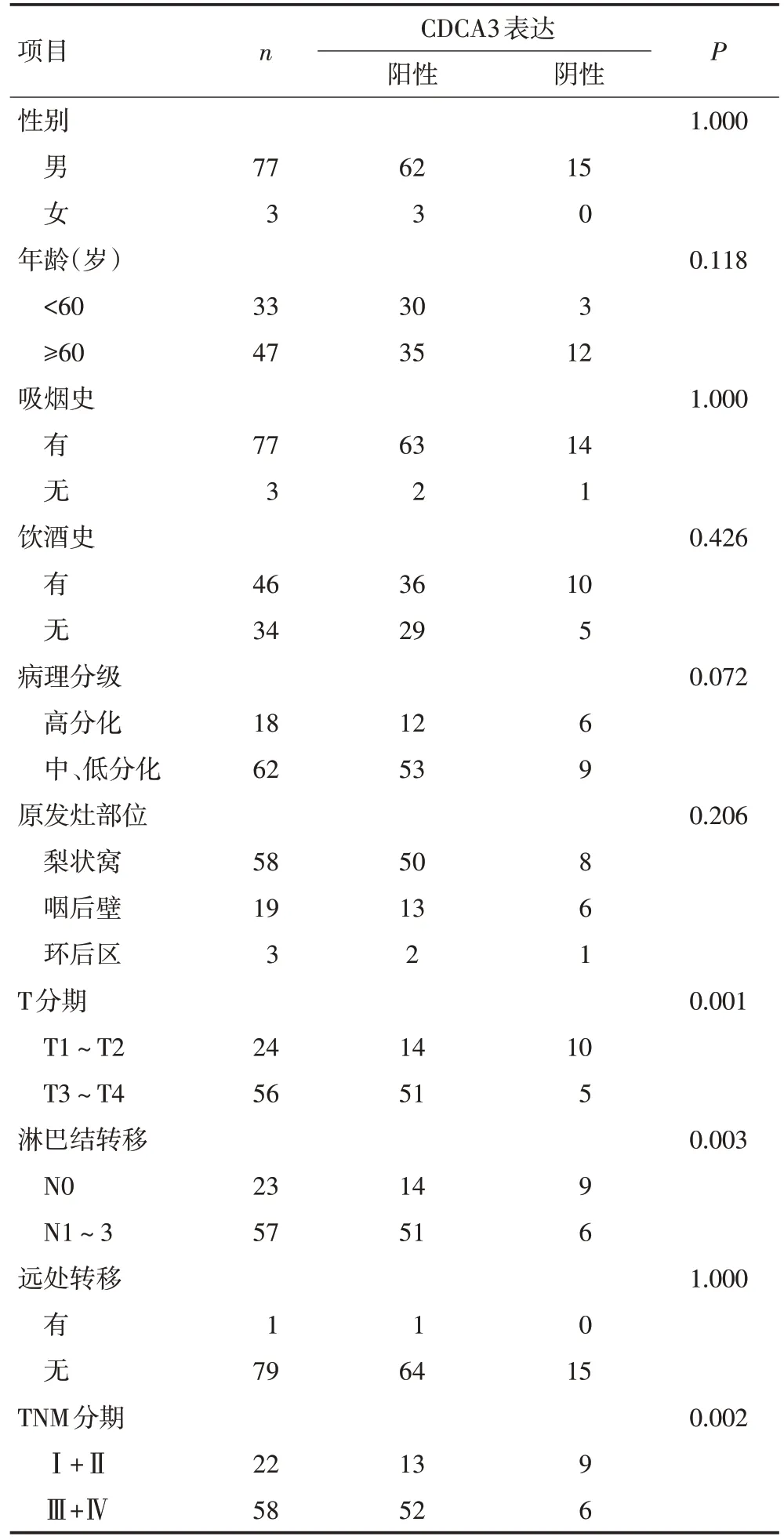
表3 下咽鳞癌组织中CDCA3 的表达与患者临床病理特征的关系 例
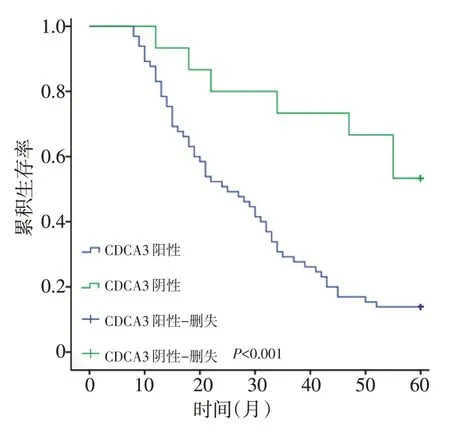
图5 CDCA3表达水平与下咽鳞癌患者预后之间的关系

表4 下咽鳞癌患者预后相关因素的单因素及多因素Cox回归分析
3 讨论
CDCA3 也称为Tome-1(有丝分裂进入的触发器)。CDCA3含有1个F-box基序,可与Skp1和cullin结合,通过刺激某些蛋白质如细胞周期调节蛋白、转录因子和信号转导分子的降解来调节人体内的许多生理和病理过程。最近的研究表明,CDCA3 在各种癌症的发生发展中起着关键作用[4-13],并且与肿瘤预后存在密切的关系,可能是一种致癌F-box 蛋白,有可能成为治疗肿瘤的新靶标。
Itzel 等[11]在对163 种肿瘤的微阵列数据集的生物信息学研究中,发现了1 个严密调控的基因网络,包括具有预后重要性的CDCA3。该研究通过RT-qPCR 法验证了生物信息学分析结果,并证明与正常组织中的表达水平相比,CDCA3 在乳腺癌、肾癌、肺癌和卵巢癌中的转录水平上调。目前,鲜见CDCA3 在下咽鳞癌中的报道,其表达情况与下咽鳞癌患者预后的关系以及可能的作用机制不清。本研究首先应用qRT-PCR 及Western blot 技术检测发现,下咽鳞癌组织中CDCA3的表达与癌旁组织相比在转录及翻译水平均明显上调,同时采用免疫组织化学法检测结果显示,在80 例下咽鳞癌组织标本中,65 例标本CDCA3 阳性表达,与CDCA3 在胃癌、结直肠癌、非小细胞肺癌、口腔鳞癌等多种恶性肿瘤中表达情况一致[4,6-10]。Qian等[8]对结直肠癌组织中CDCA3表达与临床病理因素进行分析后发现,CDCA3 的高表达与肿瘤大小、TNM分期和淋巴结侵犯显著相关。Zhang等[4]研究胃癌组织中CDCA3的表达情况发现,CDCA3高表达与肿瘤大小、分化程度、原发肿瘤、淋巴结转移和TNM 分期有关。本研究结合80 例下咽鳞癌中CDCA3 表达情况,分析CDCA3 阳性表达与临床病理参数之间的关系,发现CDCA3阳性表达与肿瘤大小、淋巴结转移、TNM 分期显著相关。上述研究结果均提示CDCA3 阳性表达与下咽鳞癌的发生发展有关,CDCA3可能在下咽鳞癌中起到癌基因的作用。
下咽癌由于其发病位置较深且隐蔽,早期症状不典型,出现症状后就诊的下咽癌患者中,超过70%患者为Ⅲ期和Ⅳ期[14],肿瘤往往已经向周围组织器官侵犯,如喉、舌根、食管等部位,同时伴有颈部淋巴结转移,预后较差。Hall等[15]开展的一项包括595例下咽癌的临床研究发现,接受治疗的患者中20%有残留,47%患者在3年后肿瘤无复发,50%患者在治疗后的第1年内复发,其中50%出现远处转移。下咽鳞癌的恶性程度较高,治疗上具有挑战性,术后常造成呼吸和吞咽等功能受损。影响下咽鳞癌的预后因素较多,如肿瘤大小、淋巴结转移和TNM 分期等因素,为了研究CDCA3 是否与下咽鳞癌预后相关,本研究应用单因素Cox比例风险回归分析发现,CDCA3的阳性表达、肿瘤大小、临床分期和淋巴结转移是影响预后的因素,经过多因素Cox 比例风险回归分析,表明CDCA3表达是影响下咽鳞癌患者生存的独立预后因素,而原发肿瘤大小(T 分期)、区域性淋巴结转移情况及TNM 分期均不能作为预后的独立危险因素,其协同作用影响下咽鳞癌患者的预后。进一步证明了CDCA3参与了下咽鳞癌发生发展过程。然而,CDCA3在下咽鳞癌中的促癌作用的具体机制及分子通路尚未明确,将是后续研究工作的主要方向。
综上所述,CDCA3 在下咽鳞癌组织中表达显著增加,其阳性表达与患者的原发肿瘤大小、TNM分期以及颈部淋巴结转移情况相关。而且下咽鳞癌CDCA3的阳性表达是影响患者预后的独立危险因素,本研究结果表明CDCA3在下咽鳞癌中可能起到癌基因的作用,可能成为下咽鳞癌分子治疗的新靶点。

