3D打印钛合金多孔材料对体外成骨细胞系MC3T3-E1的生物安全性
景 丽,史 文,曹 雨,刘瑞赛,刘 璐,李建宇,刘 辉*
(1. 天津市第三中心医院 肝胆疾病研究所 天津市重症疾病体外生命支持重点实验室, 天津 300170;2.嘉思特华剑医疗器材(天津)有限公司 天津市骨植入物界面功能化与个性化研究重点实验室, 天津 300190)
人工关节假体的设计开发一直是国内外医疗器材领域的研发热点,其中研发的关键问题是如何选择具有骨组织相容性的生物医用材料。钛合金材料由于具有突出的耐腐蚀性、较低的弹性模量及良好的生物相容性,成为近年来众多生物医用金属材料的首选[1-2]。3D打印技术是一种与传统加工方法截然不同的增材制造工艺,此工艺主要基于三维数据逐层打印出所需的实体模型,利用3D打印技术可以快速并准确地制作出满足设计要求的开发产品[3]。本课题组将钛合金材料(Ti6Al4V)用于骨关节假体的设计开发,利用3D打印技术将钛合金粉料逐层叠加,并通过其内部设计的多孔结构,优化其材料的弹性模量,提高材料的细胞黏附性,旨在提高钛合金假体材料与骨组织的整合性与相容性,从而满足患者对假体生存率的要求。
本课题组前期通过阿卡姆公司的工业级金属3D打印机,利用电子束熔成型技术 (electron beam melting, EBM),设计了3种拓扑单元的多孔钛合金打印结构,使其多孔结构的孔径、孔隙率及弹性模量均利于骨组织的细胞长入与血管化要求。但作为金属材料,钛合金植入人体后也会析出一些金属离子,这些金属离子进入体液后可能会对人体造成损伤。因此,本实验是在前期研究基础上,制备上述3种拓扑结构多孔钛合金材料的浸提液,并用于成骨细胞(osteoblast,OB)的体外培养,通过检测材料浸提液孵育下成骨细胞的增殖与分化活性,观察3D打印钛合金多孔材料的生物安全性。
1 材料与方法
1.1 材料
利用阿卡姆工业级金属3D打印机(Q20PLUS, Arcam公司);MC3T3-E1成骨细胞系(中国科学院典型培养物保藏委员会细胞库)。
DMEM高糖培养基、胎牛血清、胰蛋白酶(Gibco公司);细胞增殖MTT试剂(上海麦克林生化科技有限公司);HE染色试剂、碱性磷酸酶(alkaline phosphatase,ALP)检测试剂盒(北京雷根生物技术有限公司);I型胶原(collagen I,Col Ⅰ)免疫荧光染色试剂盒(北京中杉金桥生物技术有限公司)。
1.2 方法
1.2.1 细胞系传代培养:将成骨细胞系进行体外培养,加入DMEM高糖培养基,添加1.5 g/L NaHCO3、43.2 mg/L肌醇、8.82 mg/L叶酸、7.8 mg/L β-巯基乙醇,加入10%优质胎牛血清,置于6孔板内进行传代培养,在37 ℃、5% CO2培养箱内孵育,传至第2代用于后续实验。
1.2.2 制备材料浸提液:通过电子束熔融成型(EBM)技术,在真空环境中采用电子束作为热源来逐层融化钛合金金属粉末,以增材制造的工艺方法3D打印3种拓扑单元结构的钛合金多孔支架材料。三维钛合金打印试样及最小单元拓扑结构如图所示(图1),3种拓扑单元结构分别为3D打印库中2.0 mm、2.25 mm及2.5 mm的Dode-Medium单元结构,各试件的尺寸保持一致,均为20 mm×20 mm×3.5 mm。3种钛合金多孔材料的丝径约300 μm,孔径800~1 000 μm,孔隙率75%~80%,弹性模量440~760 MPa。

A.three-dimensional titanium alloy porous scaffold;B. minimum unit topology图1 3D打印成型的钛合金多孔材料及单元拓扑结构Fig 1 3D-printed titanium alloy porous material and its topological structure
将3D打印的钛合金多孔支架材料置于医用高压锅中,高温、高压灭菌消毒后,按照材料表面积/浸提液体积=(1 cm×1 cm)/1.25 mL的标准[4],将钛合金多孔支架材料完全浸泡于DMEM培养液中,并置于37 ℃、5% CO2恒温培养箱中浸提,3种拓扑单元多孔材料的浸提时间都分设24、48、72及96 h,到达各浸提时间后,利用涡流振荡器进行振荡,吸取各组材料浸提液并过滤除菌,无菌保存备用。
1.2.3 细胞增殖活力测定:将传代的成骨细胞系进行胰蛋白酶消化,调整细胞浓度为5×103个/L,接种于96孔板,置于37 ℃、5% CO2培养箱中孵育24 h。待细胞完全贴壁后,在每孔中添加100 μL钛合金多孔材料浸提液,作为各材料浸提液组,每组设6个细胞复孔;另设6个细胞复孔,添加100 μL DMEM培养液,作为阴性对照组;再设6个细胞复孔,添加100 μL 2.5%二甲基亚砜(dimethyl sulfoxid,DMSO)溶液,作为阳性对照组。将各组细胞继续培养48 h,取出培养板,每孔加入20 μL MTT(5 g/L),于培养箱中孵育4 h,终止培养,倒板,加入150 μL DMSO溶液裂解,振摇15 min后,用酶标仪于波长490 nm处,测定各孔吸光度(A)值。并通过各组细胞的A值,计算细胞相对增殖率(RGR=实验组吸光度值/阴性对照组吸光度值×100%)。依据细胞毒性评定标准[5],对各组材料的细胞毒性进行评估:相对增殖率(relative growth rate, RGR)≥100%为0级,75%~99%为l级,50%~74%为2级,25%~49%为3级,1%~24%为4级,0为5级,细胞毒性分级程度≤1为无毒性。
1.2.4 细胞形态学HE染色:用6孔板接种传代的成骨细胞系,经各组材料浸提液、DMEM培养液(阴性对照)、2.5% DMSO溶液(阳性对照)孵育后,弃去上清并用PBS冲洗,加入95%乙醇固定(15 min),蒸馏水浸洗,苏木精染色(5 min),蒸馏水浸洗,稀盐酸酒精溶液快速分色后,淡氨水返蓝(5 min),蒸馏水浸洗,伊红染色(10 min),经乙醇梯度脱水、二甲苯透明后,用中性树胶封片,置于光学显微镜下照相。
1.2.5 细胞碱性磷酸酶ALP活性测定:用24孔板接种传代的成骨细胞系,经各组材料浸提液、DMEM培养液(阴性对照)、2.5% DMSO溶液(阳性对照)孵育后,取各组细胞培养上清液200 μL,利用微板法于520 nm处测定ALP活性,具体操作按试剂盒说明书进行。
1.2.6 细胞免疫荧光染色:经各组材料浸提液、DMEM培养液(阴性对照)、2.5% DMSO溶液(阳性对照)孵育后,弃去上清用PBS冲洗,4%多聚甲醛固定(20 min),PBS洗后,0.5% Triton X-100孵育(30 min),PBS洗,加入1% BSA封闭(30 min),滴加Col Ⅰ一抗工作液(1∶200),4 ℃过夜,PBS冲洗,避光条件下加入荧光标记的二抗工作液(1∶400),室温孵育(60 min),弃去染液,PBS润洗3次,荧光显微镜观察并摄片,使用Image pro-Plus(IPP)软件进行图像分析。
1.3 统计学分析
2 结果
2.1 细胞增殖活力及材料毒性评价
各组材料浸提液孵育的成骨细胞增殖活跃,各浸提时间点下3组钛合金多孔材料的细胞A值,与DMEM阴性对照组比较无显著性差异,而DMSO阳性对照组孵育的成骨细胞A值显著下降 (P<0.01) (图2)。计算各组细胞的相对增殖率(RGR),并依据细胞RGR评估各组材料浸提液的细胞毒性,结果显示各组浸提液的细胞毒性程度均≤1 (表1)。
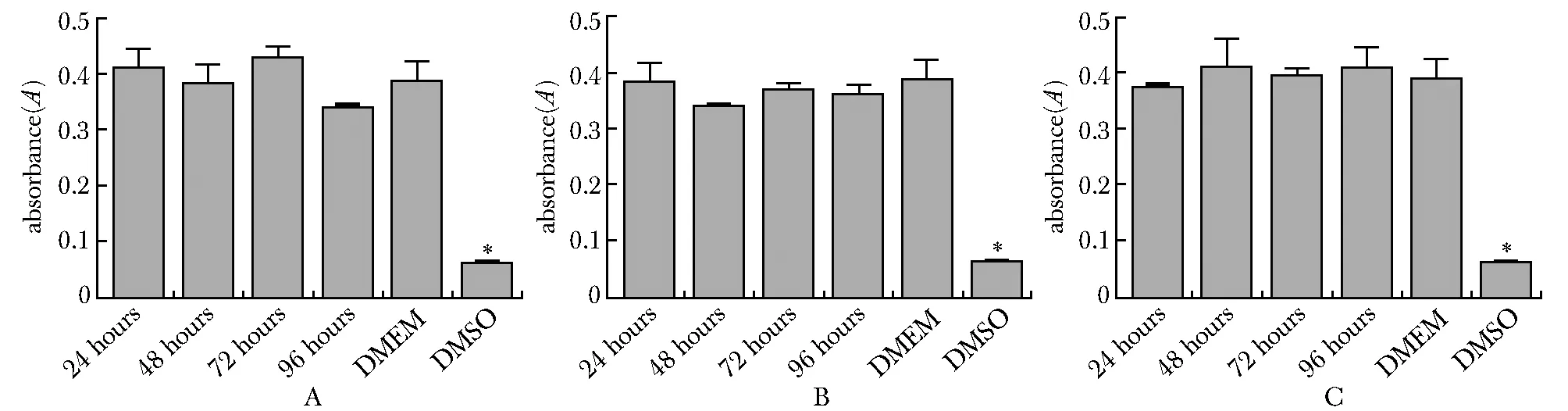
*P<0.01 compared with each extract experimental group;A.2.0 mm material extract group; B.2.25 mm material extract group; C.2.5 mm material extract group图2 各组成骨细胞的增殖活力Fig 2 Cell proliferation activity of osteoblasts in each n=6)
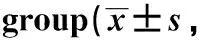
表1 各材料浸提液组成骨细胞的相对增殖率Table 1 The relative growth rate (RGR) of osteoblasts in each extract n=6)
2.2 细胞HE染色结果
各组材料浸提液孵育后,可见成骨细胞生长旺盛、增殖活跃,细胞贴壁伸展、分布均匀,形态呈梭形、三角形或多角形,细胞间突起明显,成铺路石样排列连接。各材料浸提液组与DMEM阴性对照组比较,成骨细胞生长状态同步,细胞形态无显著改变。DMSO细胞毒阳性对照组中,可见成骨细胞的数量显著减少,胞质皱缩,胞体固缩变小,细胞间突起缩短或消失,细胞间连接断裂 (图3)。
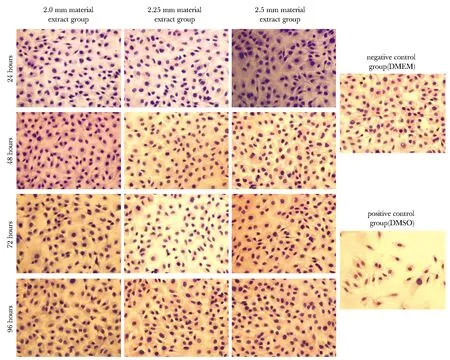
图3 各组成骨细胞的HE染色结果 Fig 3 HE staining of osteoblasts in each group (×400)
2.3 细胞ALP活性检测结果
各组材料浸提液孵育后,成骨细胞分泌的ALP活性为7.97~9.13 U/L。各浸提时间点下3组钛合金多孔材料的细胞ALP活性与DMEM阴性对照组比较差异无统计学意义,而DMSO阳性对照组孵育的成骨细胞ALP活性显著降低 (P<0.01) (图4)。
*P<0.01 compared with each extract experimental group;A.24 hous material extract group; B.48 hous material extract group; C.72 hous material extract group; D.96 hous material extract group图4 各组成骨细胞的ALP活性Fig 4 ALP activity of osteoblasts in each n=6)
2.4 细胞Col Ⅰ荧光染色结果
各组成骨细胞的I型胶原蛋白(Col Ⅰ)阳性表达于细胞质中,呈红色荧光均匀分布。各浸提时间点下3组钛合金多孔材料的Col Ⅰ阳性细胞表达面积与DMEM阴性对照组比较无显著性差异,而DMSO阳性对照组中Col Ⅰ阳性细胞表达面积显著减少 (P<0.01) (图5,6)。
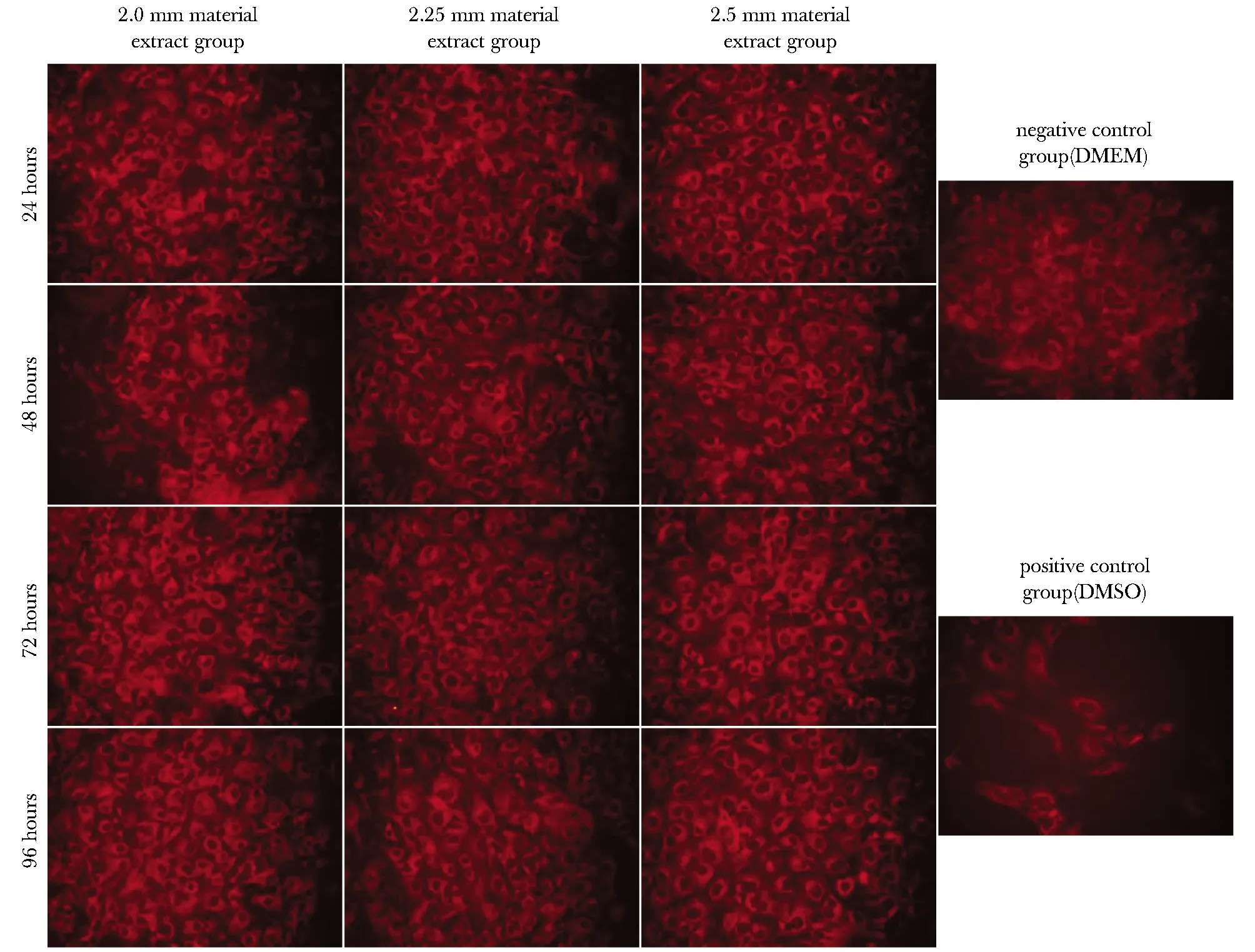
图5 各组成骨细胞的Col Ⅰ免疫荧光染色 Fig 5 Col Ⅰ immunofluorescence staining of osteoblasts in each group (×400)
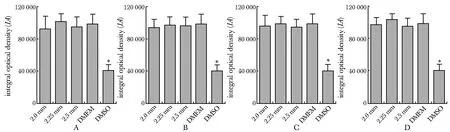
*P<0.01 compared with each extract experimental group; A.24 hours material extract group; B.48 hours material extract group; C.72 hours material extract group; D.96 hours material extract group图6 各组成骨细胞的Col Ⅰ表达水平Fig 6 Expression level of Col Ⅰ in osteoblasts of each n=6)
3 讨论
在目前的骨植入研究中,常用的金属植入材料主要包括不锈钢、钴合金及钛合金等。其中,钛合金材料具有耐腐蚀性高、力学性能好、弹性模量低、生物相容性佳等优点,成为植入领域中广泛应用的生物医用材料[6]。以往金属材料的加工工艺常采用传统的机械加工方式,不但工艺复杂、周期长、难度高,而且很难达到“个性化定制”的设计要求[7]。3D打印技术作为一种新兴的增材制造工艺,可以快速并准确地制备出满足个体设计要求的金属植入材料的技术要求及安全性等方面尚缺乏权威的评价标准。
本课题组前期通过阿卡姆金属3D打印机,以EBM技术打印了3种拓扑单元的钛合金多孔材料,使其结构参数与力学性能满足骨长入及血管化要求。同时,经过前期体外离子析出实验,发现钛合金打印材料在浸提3~4 d内,钛、铝、钒3种金属离子析出量快速增加,而这些离子可能会对人体造成损伤。因此,为了评价上述3种拓扑结构钛合金打印材料的生物安全性,本实验通过制备各组钛合金多孔材料的浸提液,用于成骨细胞系MC3T3-E1的体外培养,观察各材料浸提液对成骨细胞增殖与分化活性的影响。
本实验首先从形态学方面,通过HE染色观察各材料浸提液孵育下成骨细胞的生长状态,结果发现各组材料浸提液并不影响成骨细胞的生长,成骨细胞依然贴壁牢固,并显示良好的增殖活性,与DMEM孵育的阴性对照组比较,各组细胞生长状态无差异。MTT实验是通过检测线粒体呼吸链的琥珀酸脱氢酶活性,反映细胞增殖活力的检测技术。本课题组通过MTT法检测各材料浸提液组成骨细胞的增殖活力。实验结果表明,各组材料浸提液并不减缓成骨细胞的增殖速度,与DMEM孵育的阴性对照组比较,各组细胞增殖率无显著差异,同时通过计算其相对增殖率,评价各组材料的细胞毒性,结果提示3D打印的3种钛合金多孔材料对成骨细胞无毒性。
ALP是成骨细胞早期分化的重要标志物,在骨重建中发挥水解磷酸脂的作用,促使磷酸基团与钙离子结合,启动骨组织的钙化过程,从而促进新生骨的形成[9-10]。Col Ⅰ是骨基质的主要组成部分,是由成骨细胞分泌的特异性胶原蛋白,成骨细胞矿化功能的实现依赖Col Ⅰ蛋白形成的网状结构[11-12]。本实验结果表明,各组钛合金多孔材料浸提液并不影响成骨细胞的ALP分泌和Col Ⅰ表达,且与DMEM阴性对照组成骨细胞比较无显著差异,提示3种钛合金多孔材料不会影响成骨细胞的分化活性。
综上所述,本课题组设计的3种钛合金多孔打印材料,其浸提液对成骨细胞的增殖与分化活性无影响,显示其良好的生物安全性。诚然本实验还存在一定的局限性,由于体外浸提实验的周期较短,无法观察金属材料长期植入的生物安全性。因此,本课题组将通过动物原位植入实验,进一步验证钛合金多孔材料对骨组织细胞的生物安全性。

