三七皂苷R1-PLGA 纳米微球的制备及优化研究*
杨 丹,姜 岚,黄 娟,陈晓莉,杨娇娜
(1.玉溪师范学院 化学生物与环境学院,云南 玉溪 653100;2.昆明医科大学第一附属医院 超声科/云南省超声诊断质量控制中心/云南省超声影像研究中心,云南 昆明 650032)
前 言
三七皂苷R1 来源于中药三七(Panaxnotoginseng)的干燥根及根茎,研究显示其内的有效成分三七皂苷R1 对急性心梗的大鼠心肌具有保护作用,其作用机制可能与减少心肌酶释放以及抑制心肌细胞凋亡有关[1]。但是生物体对药物的吸收、代谢、排泄是一个极其复杂的过程,中药产生的药理效应不能唯一的归功于该药物的化学组成成分,还应与药物的物理状态等密切相关。纳米中药是指运用纳米技术制造的中药有效成分、原药及其复方制剂[2]。PLGA 是一种可降解的功能高分子有机化合物,具有良好的生物相容性、无毒、良好的成囊和成膜的性能,被广泛应用于制药、医用工程材料和现代化工业领域[3],目前国内外有很多学者们使用PLGA 作为壳载体来包埋药物制作纳米微球[4~6]。PLGA 作为纳米粒微球成膜材料,将其内的药物与外界隔开,减少外界环境与药物之间的相互影响,达到较高的包封率,是亲水性药物的理想载体[7~9]。
1 材料和方法
1.1 试剂与仪器
三七皂苷R1(上海源叶生物科技有限公司);聚乳酸- 羟基乙酸共聚物(PLGA,相对分子质量,LA∶GA=50∶50,Aladdin industrial Corporation);二氯甲烷、聚乙烯醇(Polyvinyl alcohol,PVA,Sigma-Aldrich Corporation)。
超声波细胞粉碎机(宁波新芝生物科技股份有限公司,SCIENTZ-IID);高效液相色谱仪(Agilent1260 Infinity);Hypersil GOLD 液相色谱柱(250×4.6mm×5μm,Thermoscientific);Malvern 激光粒度分析仪(英国马尔文公司);磁力搅拌器(温州标诺仪器有限公司,78-1)、低温冷冻离心机(AllegraR X-15R);超纯水仪(西安优普仪器设备有限公司,UPT-I-5/10/20T);电子天平(Precisa ES225SM-DR)。
1.2 三七皂苷R1-PLGA 微球的制备及参数优化
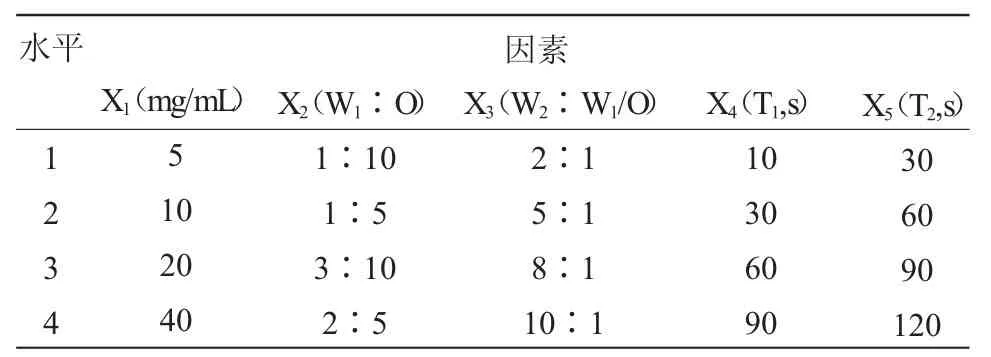
表1 正交实验因素水平表Table 1 The factors and levels for the orthogonal experiment
采用复乳- 溶剂挥发法制备以PLGA 为携药载体的纳米粒微球。精密称取一定质量的PLGA 并放入一定体积的二氯甲烷中,振荡使其充分溶解,制成PLGA- 二氯甲烷溶液(油相O);称取一定质量的三七皂苷R1 并制成相应浓度的PNS 水溶液作为内水相 W1;PVA 水溶液(1%)作为外水相 W2。以一定体积比混合W1相与O 相,将混合乳液置入超声波细胞粉碎机进行第一次超声乳化(300W,T1),制得初乳(W1/O),将初乳W1/O 快速加入到一定体积的外水相W2中,再次置入超声波细胞粉碎机进行第二次超声乳化(300W,T2),即可得到复乳。将得到的复乳置于室温下搅拌4h,使得有机溶剂挥发,即得三七皂苷R1-PLGA 纳米微球混悬液。将上述液体分装入离心管内,高速离心(4000r/min)5min,收集上清液,蒸馏水洗涤三次收集全部上清液。洗涤后的混悬液沉淀干燥后收集即得纳米粒干粉,置4℃冰箱中保存、备用。在前期预实验单因素分析后筛选出在制备过程中对包封率及粒径有影响的五种因素,X1(O 相PLGA 浓度,mg/mL)、X2(W1与O 相体积比)、X3(外水相 W2与初乳 W1/O 体积比)、X4(第一次超声乳化时间,T1)、X5(第二次超声乳化时间,T2);每个因素选4 个水平,按L16(45)正交表安排实验,水平重复每一相同实验三次,见表1。
1.3 三七皂苷R1 含量测定
使用仪器:高效液相色谱仪(Agilent 1260 Infinity)及HypersilGOLD液相色谱柱(250×4.6mm×5μm,Thermoscientific)。以乙腈为流动A 相,水为流动B相,按照下表2 进行梯度洗脱;进样量20μL;流速1.0mL/min;检测波长203nm。
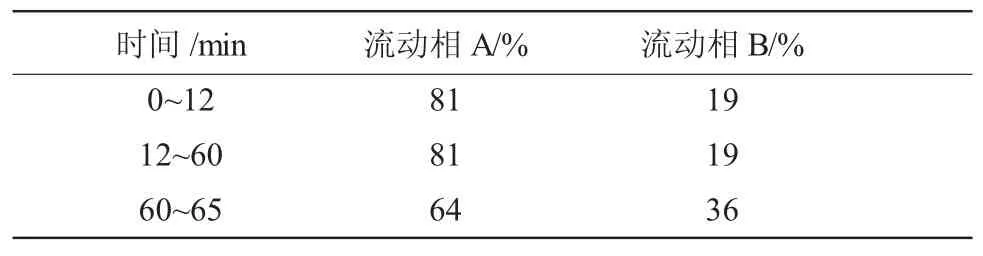
表2 高效液相梯度洗脱条件Table 2. Gradient elution conditions in high performance liquid phase
1.4 标准曲线的制备
三七皂苷R1 标准曲线的制备:分别称取一定质量三七皂苷R1,配制不同浓度三七皂苷R1 溶液,按照前述1.3 色谱条件得到的结果,以峰面积(A)对质量浓度(ρ)进行线性回归,得到三七皂苷R1 标准曲线:A=2.9943ρ+3.2929(r=0.9803)。
1.5 包封率的测定
取1.2 项下离心收集的所有上清液,据1.3 色谱条件,测定游离药物量(cfree),按以下公式计算包封率(entrapmentefficiency,EE%)=(ctotal-cfree/ctotal)×100%。
2 结果与讨论
2.1 正交试验结果及统计学分析
以正交试验各序号对应试验条件制备的三七皂苷R1-PLGA 微球的包封率(%)及平均粒径为指标,结果如表3。马尔文粒径分析仪得出的微球粒径如图1 所示。

图1 三七皂苷R1-PLGA 微球粒径分析图Fig. 1 The analysis of particle size of PLGA loaded panax notoginseng saponin R1 nanoparticles
使用SPSS 13.0 对表3 数据进行统计分析,结果如表 4~7。

表3 三七皂苷R1-PLGA 包封率及粒径正交实验结果表Table 3 The orthogonal experiment results of the encapsulation rate and particle size of PLGA loaded panax notoginseng saponin R1 nanoparticles
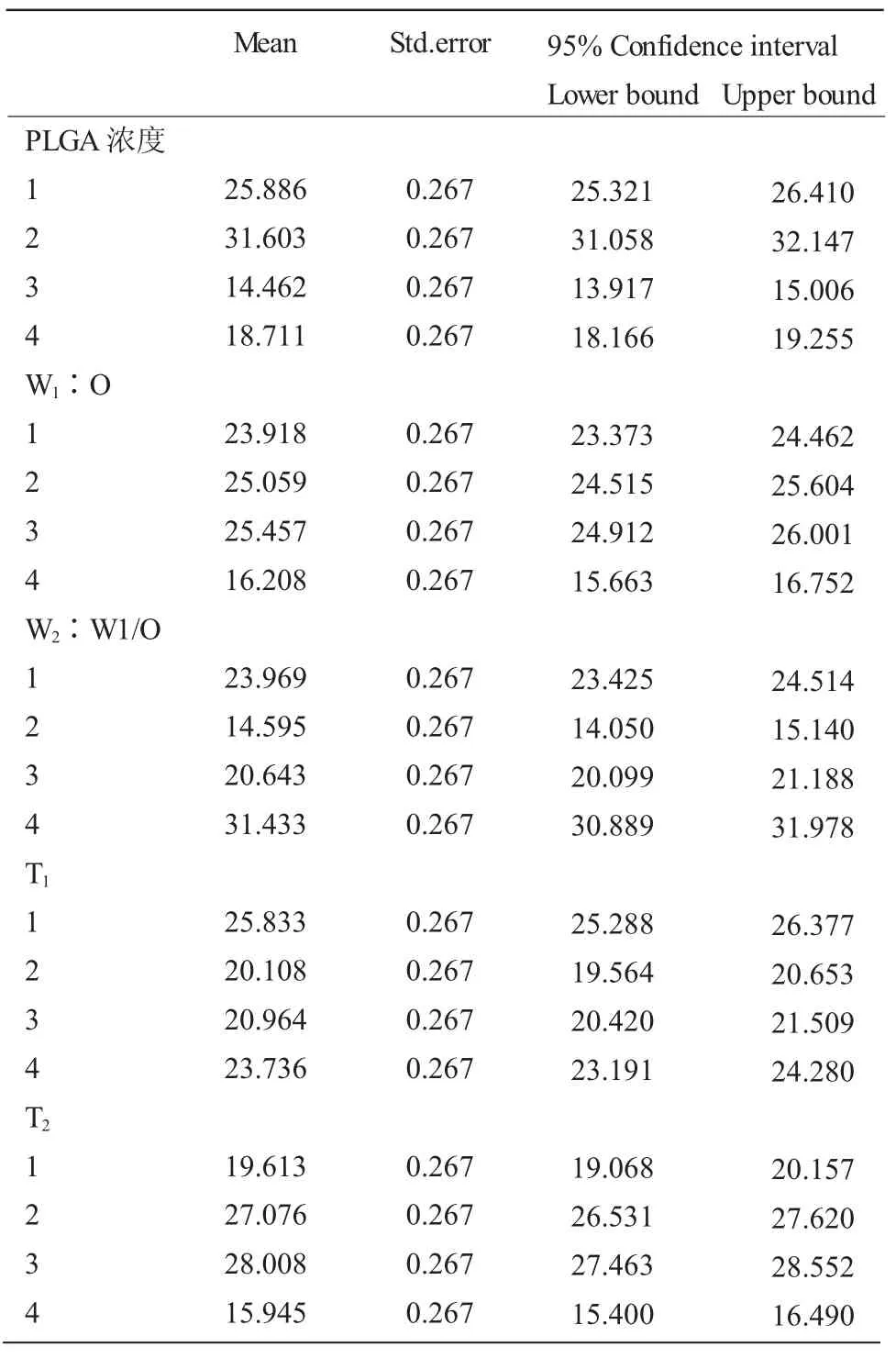
表4 三七皂苷R1-PLGA 微球包封率单因素分析表Table 4 The single factor analysis of encapsulation rate of PLGA loaded panax notoginseng saponin R1 nanoparticles
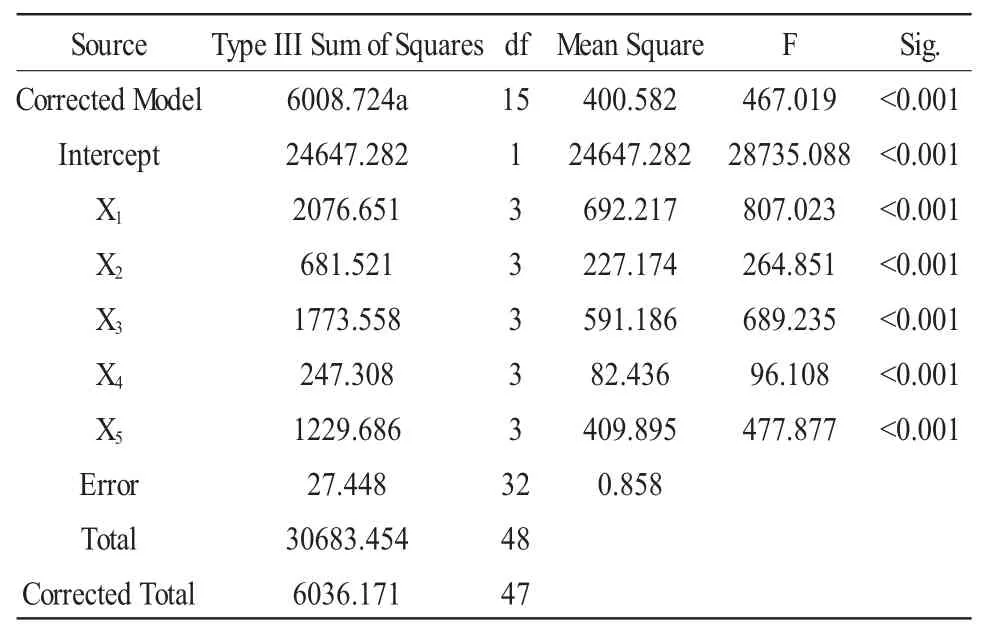
表5 三七皂苷R1-PLGA 微球包封率正交实验方差分析结果表Table 5 The variance analysis of encapsulation rate of PLGA loaded panax notoginseng saponin R1 nanoparticles

表6 三七皂苷R1-PLGA 微球粒径单因素分析表Table 6 The single factor analysis of particle size of PLGA loaded panax notoginseng saponin R1 nanoparticles

表7 三七皂苷R1-PLGA 微球粒径正交实验方差分析结果表Table 7 The variance analysis of particle size of PLGA loaded panax notoginseng saponin R1 nanoparticles
由表 4~7 可知,对于包封率和粒径来说,X1、X2、X3、X4、X5五个因素均有统计学意义(P<0.001)。对于包封率的影响,五个因素次序依次为X1>X3>X5>X2>X4。对于包封率来说,要达到最佳包封率,每个因素最佳的水平分别为:PLGA 浓度10mg/mL,W1∶O为 3∶10,W2∶W1/O 为 10∶1,第一次超声乳化时间(T1)10s,第二次超声乳化时间(T2)90s;对于粒径的影响,五个因素次序依次为X1>X2>X3>X5>X4。对于粒径来说,要达到最小粒径,每个因素最佳的水平分别为:PLGA 浓度 20mg/mL,W1∶O 为 2∶5,W2∶W1/O 为 2∶1,第一次超声乳化时间(T1)10s,第二次超声乳化时间(T2)120s。
3 结 论
本实验构建的纳米粒由PLGA 包覆三七皂苷R1,由于三七皂苷R1 是水溶性药物,因此采用了适宜水溶性药物包封的复乳- 溶剂挥发法。并且在外水相中加入了一定浓度的PVA 作为乳化剂,使得有机相在乳化剂作用下于水相中分散成细小液滴,保证足够的表面活性剂分子覆盖有机相与外部水相界面,提高液滴的聚结保护作用[5]。通过正交实验设计考察各因素,以包封率及粒径为指标进行优化制备工艺。正交设计五因素四水平实验结果显示,对于包封率和粒径来说,PLGA 浓度,W1与O 相体积比、外水相W2与初乳W1/O 体积比、第一次超声乳化时间、第二次超声乳化时间对其均有影响。PLGA浓度过低,不足以完全包封体系中的三七皂苷R1,而当PLGA 浓度过高时,体系内的三七皂苷R1 浓度不变,PLGA 相对过剩,反而不能有效提高包封率,故当PLGA 浓度在20mg/mL 时包封率达到最佳;内水相体积增大,在一定范围内包封率上升,但当上升至一定程度时反而包封率下降,最佳的内水相与油相比值为3∶10,这与文献报道的相符[10]。而随着外水相与初乳(W1/O)体积比的增加,包封率上升,并且在300W 超声乳化下,第一次内水相油相混合乳化时间为10s,第二次外水相与初乳混合乳化时间为90s 时则包封率最高。对于纳米粒微球粒径来说,随着PLGA 浓度的增加,粒径逐渐减小,与相关文献报道的相符[11];内水相、油相比也影响着粒径的大小,当比值较大时粒径较大,减小比值则粒径减小;而外水相与初乳的比值增大,则粒径也增大。随着第一次超声乳化时间的延长,粒径增加,这与文献相符[4],因此内水相与油相超声乳化时间选择10s 为佳。
综上所述,可以使用复乳- 溶剂挥发法成功制备三七皂苷R1-PLGA 纳米粒微球,其包封率及粒径大小会受PLGA 浓度,W1与O 相体积比、外水相W2与初乳W1/O 体积比、第一次超声乳化时间、第二次超声乳化时间影响。要获得最大包封率,优化后的实验条件为:PLGA 浓度 10mg/mL,W1∶O 为 3∶10,W2∶W1/O 为10∶1,第一次超声乳化时间(T1)10s,第二次超声乳化时间(T2)90s。如果要获得最小粒径,则优化实验条件为:PLGA 浓度 20mg/mL,W1∶O为 2∶5,W2∶W1/O 为 2∶1,第一次超声乳化时间(T1)10s,第二次超声乳化时间(T2)120s。

