DB-WAX 毛细管柱气相色谱法检查藿香正气水中乙醇量
吴丽荣,陈肇娜,苏丽婷,石焱芳
(泉州医学高等专科学校 药学院,福建 泉州 362000)
前 言
藿香正气水是一种由苍术、陈皮、甘草浸膏、厚朴(姜制)、白芷、茯苓、广藿香油、大腹皮、生半夏、紫苏叶油等十味药,以乙醇和水作为溶剂经过一系列工序制得的酊剂[1]。采用气相色谱法检查藿香正气水的乙醇量(应为40%~50%),采用氰丙基苯基-二甲基聚硅氧烷(6∶94)为固定液的毛细管柱(属于中等极性柱),以正丙醇为内标物[2]气相色谱法进样量非常小,进样量很难保证准确。内标法的优点是进样量和色谱操作条件的微小变化对定量结果的影响不大,只要保证不超过柱的装载量,且被测组分和内标物都能出峰并完全分离即可[3]。外标法由于色谱条件很难保持一致,容易发生误差[4]。本文采用以键合交联聚乙二醇(PEG-20M)为固定液的石英毛细管柱(强极性柱[5],简称DB-WAX)气相色谱仪,以正丁醇为内标物的内标法测定乙醇量,方法快速、简便,适用于藿香正气水中乙醇量的检查。
1 仪器与试药
1.1 仪器
美国安捷伦7820A 气相色谱仪(配置EZChrome操作系统);美国安捷伦DB-WAX 石英毛细管柱(30.0m×0.25mm,0.25μm);氢火焰离子化检测器。
1.2 试药
无水乙醇(优级纯,含量大于99.8%)和正丁醇(分析纯)均为西陇化工股份有限公司生产;藿香正气水为云南白药集团有限公司生产,批号为WTDA1711。
2 试验方法与结果
2.1 溶液的配制
2.1.1 正丁醇溶液的配制
精密量取恒温至20℃的正丁醇(内标物质)5mL,置100mL 量瓶中,用水稀释至刻度,摇匀,用0.45μm 微孔滤膜滤过。
2.1.2 乙醇溶液的配制
精密量取恒温至 20℃的无水乙醇 5mL,置100mL 量瓶中,用水稀释至刻度,摇匀,用0.45μm微孔滤膜滤过。
2.1.3 对照品溶液的配制
按照药典规定,精密量取恒温至20℃的无水乙醇5mL,置100mL 量瓶中,精密加入恒温至20℃的正丁醇5mL,用水稀释至刻度,摇匀,用0.45μm 微孔滤膜滤过。
2.1.4 供试品溶液的配制
按照药典规定,精密量取恒温至20℃的供试品10mL,置100mL 量瓶中,精密加入恒温至20℃的正丁醇5mL,用水稀释至刻度,摇匀,用0.45μm 微孔滤膜滤过。
2.2 色谱条件
美国安捷伦DB-WAX 石英毛细管色谱柱(30.0m×0.25mm,0.25μm);载气:氮气(纯度 >99.99%);进样口温度:200℃;压力:9.2723psi;进样量:1μL;分流进样,分流比为 20∶1;FID 检测器温度:250℃;氢气流量:30mL/min;氮气流量:40mL/min;空气流量:300mL/min;柱箱温度按表1 采用程序升温的控制模式。

表1 柱箱温度程序升温设置参数Table 1 The programming temperature parameters for column box
2.3 系统适用性试验
在2.2 项所述色谱条件下进行测定,分别进样正丁醇溶液、乙醇溶液、对照品溶液各1μL,记录色谱图。根据正丁醇溶液和乙醇溶液的保留时间,确定对照品溶液中第一个峰为乙醇,第二个峰为正丁醇(图1)。其中对照品溶液中:乙醇峰的保留时间tR1=3.60min;峰宽 W1=0.11min,根据公式计算出乙醇的理论塔板数为17146;正丁醇峰的保留时间tR2=5.27min;峰宽W2=0.10min,根据公式R=计算出乙醇与正丁醇的分离度为15.9。

图1 对照品溶液的色谱图Fig. 1 The chromatogram of reference substance solution
2.4 工作曲线的绘制
按照文献[6]方法:精密量取无水乙醇1.0、2.0、4.0、6.0、8.0mL分别置100mL量瓶中,各精密加入5mL正丁醇(内标物质),用水稀释至刻度,摇匀,用0.45μm微孔滤膜过滤。各取1μL 注入气相色谱仪中,在2.2项所述色谱条件下,记录色谱图。以乙醇的浓度为横坐标,以乙醇峰面积与正丁醇峰面积的比值为纵坐标,绘制工作曲线,得回归方程为y=17.3380x-0.0086(r=0.9998,n=5)。
2.5 精密度试验
按照文献[7]方法,在2.2 项所述色谱条件下分析2.1.3 所配制的对照品溶液,记录色谱图。进样量为1μL,连续进样6 针。测得乙醇峰面积与正丁醇峰 面 积 的 比 值 分 别 为 0.8615、0.8572、0.8726、0.8702、0.8751 和 0.8618,其 RSD=0.83%(n=6)。
2.6 重复性试验
取同一批号的藿香正气水6 份,按2.1.4 项下方法配制后,在2.2 项所述色谱条件下分别进样分析,进样量为1μL,每份各进一针,记录色谱图,测得乙醇峰面积与正丁醇峰面积的比值分别为0.7617、0.7532、0.7546、0.7625、0.7706 和 0.7483,其 RSD=1.1%(n=6)。
2.7 稳定性试验
按照文献[8]方法,取同一份藿香正气水按2.1.4项下方法配制后,在2.2 项所述色谱条件下,分别隔0、1、2、4、6、12h 测定一次,其中乙醇峰面积与正丁醇峰面积的比值分别为 0.7711、0.7689、0.7785、0.7804、0.7726 和 0.7684,其 RSD=0.65%(n=6)。表明供试品溶液在12h 内稳定。
2.8 校正因子测定
按《中国药典》(2015 年版)四部规定方法,按2.1.3 项下方法配制两份对照品溶液,在2.2 项所述色谱条件下平行测定。每份对照品溶液进样3 针,记录乙醇峰面积与正丁醇峰面积,测得数据见表2,计算出平均校正因子为1.16(RSD=1.1%)。

表2 校正因子测定的相关数据Table 2 The relevant data of the determination of correction factor
2.9 供试品测定
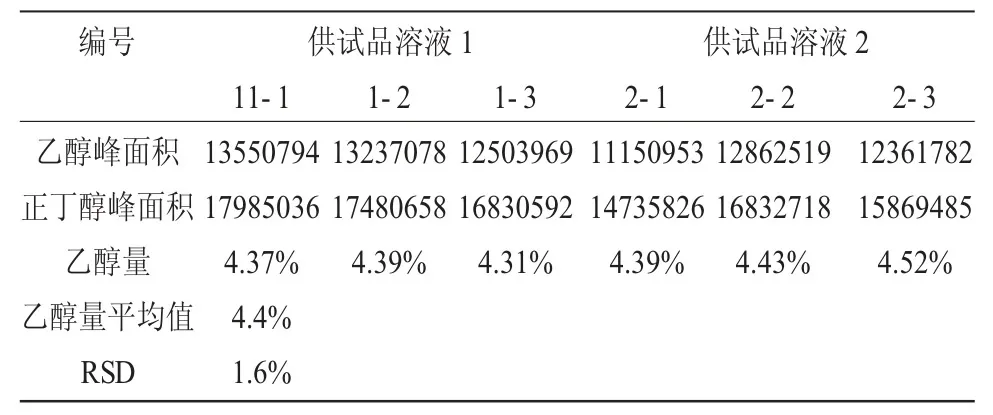
表3 供试品中乙醇量测定的相关数据Table 3 The relevant data of the determination of ethanol in the samples
按《中国药典》(2015 年版)四部规定方法,按2.1.4 项下方法配制两份供试品溶液,在2.2 项所述色谱条件下平行测定。每份供试品溶液进样3 针,记录乙醇峰面积与正丁醇峰面积,测得数据见表3。根据表2 中平均校正因子为1.16,可计算出供试品溶液中乙醇量平均值为4.4%,再乘以稀释倍数10,则该批供试品藿香正气水中乙醇量为44%。
3 讨 论
《中国药典》(2015 年版)一部中收载的藿香正气水质量标准,要求检查乙醇量,并规定应为40%~50%。本文按照药典的配制方法,以水为溶剂,以正丁醇为内标物。水的极性非常大,故尝试选择DB-WAX 极性柱;正丁醇的沸点比正丙醇高,毒性较小,故尝试作为内标物。经验证,本文报道的方法可行,操作简便,分离效果好,结果准确,重现性好,具有参考价值。

