新时代土壤化学前沿进展与展望*
李芳柏徐仁扣谭文峰周顺桂刘同旭石振清方利平刘承帅刘芳华李晓敏冯雄汉吴云当
新时代土壤化学前沿进展与展望*
李芳柏1,2†,徐仁扣3,谭文峰4,周顺桂5,刘同旭1,2,石振清6,方利平1,2,刘承帅1,2,刘芳华1,2,李晓敏7,冯雄汉4,吴云当1,2
(1.广东省科学院广东省生态环境技术研究所广东省农业环境综合治理重点实验室,广州 510650;2. 华南土壤污染控制与修复国家地方联合工程研究中心,广州 510650;3. 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008;4. 华中农业大学资源与环境学院,武汉 430070;5. 福建农林大学资源与环境学院,福州 350002;6. 华南理工大学环境与能源学院,广州 510006;7. 华南师范大学环境研究院,广州 510631)
土壤化学是重要的土壤学基础分支学科。在回顾了土壤化学发展历程的基础上,梳理了土壤化学的四个前沿交叉方向,并展望了土壤化学与其他相关学科的交叉发展趋势,以期寻求新的学科增长点。土壤化学经历了从恒电荷到可变电荷土壤学说演变,我国在土壤电化学、根际土壤化学、土壤化学-物理-微生物界面反应等方向逐步领跑。新时代中国已经发展成为国际土壤化学的研究中心之一,尤其在土壤化学与微生物学、地球化学、矿物学、环境化学等交叉领域取得了突破性发展。同时,发展并运用同步辐射、微流控联用光谱能谱、高分辨显微镜、光谱电化学等实时、原位、高精度研究方法,推动土壤化学研究取得了长足的进步。新时代的土壤化学具有三个重要发展趋势,首先系统揭示地球表层系统中物质循环与能量交换的土壤化学机制,实现“0到1”的土壤化学原创性成果的突破;其次需要综合运用地球表层系统理论,从多界面、多要素、多过程的“三多”交互耦合;再次,需要加强与地球宜居性这一人类重大命题的交叉融合,为生态文明建设、土壤污染防治攻坚战、全球变化等国家重大需求提供理论支持。
土壤化学;植物营养元素化学;生物电化学;反应动力学;界面反应;土壤矿物
土壤化学是重要的土壤学基础分支学科。土壤化学的研究以地球表层系统为对象,涉及土壤的形成与发育、土壤生产力、土壤环境自净能力、养分循环、温室气体排放等关键过程或效应的化学机制。自20世纪80年代以来,土壤化学的研究方向逐渐向可变电荷土壤、土壤电化学、土壤化学-物理-微生物界面反应、土壤生物电化学等前沿主题不断深入。同时,随着先进仪器、分析表征方法以及数值模拟手段的快速发展,中国作为当前世界土壤化学研究的中心之一,推动土壤化学与微生物学、地球化学、环境化学、矿物学等多学科交叉发展[1],尤其在土壤(生物)电化学[2-3]、根际土壤化学[4-5]、土壤化学-物理-微生物相互作用[6]等前沿主题做出了重要的贡献。随着新时期国家对生态文明、地球宜居环境的重大需求,为新时代土壤化学的综合研究与发展带来了新的机遇和挑战,迫切需要进一步加强原始创新、服务地球宜居性、土壤污染防治等重大命题与国家需求。鉴于此,笔者结合自身多年的研究工作与心得,重点梳理了中国学者在重要的交叉方向所取得的主要成果,探讨了未来发展趋势,以期寻求新时代土壤化学分支学科的新增长点。
1 土壤化学的发展历程与中心转移
1850年,英国的Way首次发现北温带土壤的离子交换现象,并提出了土壤胶体带恒定负电荷量的学说,标志着国际土壤化学的起源[7]。之后150年来,国际土壤化学研究中心逐步从欧洲转移至美国;新时代,中国逐步发展成为继欧美之外的国际土壤化学研究中心。
1.1 可变电荷土壤与土壤电化学
1929年,瑞典学者Mattson提出土壤胶体电荷是可变的,即土壤两性说,从此引发土壤化学界的争论。虽然1939年Schofield进一步证明了土壤电荷的可变性,但依然未能动摇“恒电荷土壤学说”的地位;直到1972年,Cornell大学的Peech和他的巴西学生Raji在研究热带土壤氧化铁时再次发现了可变电荷土壤,才使得“可变电荷土壤学说”得到应有的承认。1981年,国际土壤学会在新西兰召开了“可变电荷土壤”国际会议,正式确立了“可变电荷土壤学说”的历史地位。由于可变电荷土壤主要分布在世界上的欠发达地区,对它的研究很少,认识不足。根据国际土壤学的发展趋势结合我国土壤的分布特点,经过多年土壤化学的探索,于天仁先生于1961年选择可变电荷土壤和水稻土作为主要研究对象,开启了土壤电化学的原创研究,并率先建立了国际上第一个土壤电化学研究室。1965年出版了《土壤的电化学性质及其研究法》,创立了以土壤中带电的胶体颗粒与离子、质子和电子之间相互作用及其化学表现为中心的土壤电化学研究体系[8]。20世纪70年后期至80年度初,又重点开展水稻土的电化学特性研究,于1983年出版了《水稻土的物理化学》。同时创建了一系列独特的电化学方法,研制了专门的仪器设备;先后出版《土壤和水研究中的电化学方法》和《可变电荷土壤的电化学》等系列中英文专著。这些研究成果在国内外产生了广泛和深远的学术影响,使得我国土壤氧化还原研究和可变电荷土壤电化学研究跻身世界领先行列。进入新世纪,进一步开创了可变电荷土壤中带电颗粒之间双电层相互作用及其效应研究,揭示铁铝氧化物通过双电层作用抑制可变电荷土壤酸化的机制,修正了传统土壤酸化理论[9-10]。
1.2 根际土壤化学
根际是植物与土壤接触最密切、土壤-植物相互作用最活跃的微区。植物根系分泌种类繁多的有机物,使得这一微区的土壤化学过程具有明显的独特性。针对根系分泌物收集与分离的难题,我国学者创建了交换螯合法、专一性阳离子交换树脂法[11],分离和纯化专一性根系分泌物,并探索出一种微生物抑制剂,避免了根分泌物的快速分解,获得了天然根系分泌物,解决了上述难题。并将根系分泌物划分为专一性、非专一性两类。利用上述方法,发现禾本科植物分泌大量的专一性分泌物:植物铁载体[4],这些铁载体具有活化土壤铁、锌、铜等微量元素的功能[12]。根据土壤化学原理,发现了我国河南的玉米-花生间作体系正是国际上梦寐以求的铁高效作物与铁低效作物间作、前者帮助后者克服缺铁黄化问题的典型案例[13]。研究发现,在单作条件下花生缺铁黄化,而花生与玉米间作下,由于禾本科植物-玉米能够分泌植物铁载体,通过这一根分泌物不仅使自身获得足够的铁营养,而且还可通过根际作用,使与其间作的花生也能获得更多的铁营养,使花生缺铁黄化现象明显消失[13-14]。这一成果发表后,被广泛应用到以色列花生生产、西班牙弥猴桃生产、巴西柑橘生产体系中,也被国际上许多大学和研究单位作为植物营养学和植物生理生态学的教学范例,相关成果被(第3版)[15]等专著或教科书收录。上述根际化学原理进一步指导了植物高效利用土壤难溶性磷素资源的生物学潜力挖掘。发现酸性土壤上,肥田萝卜根系分泌大量酒石酸高效活化土壤难溶性磷;石灰性土壤上,植物主要分泌柠檬酸和苹果酸并促使钙磷溶解[16]。上述根际土壤化学进展入选2009年出版的专著《根际生态学:过程与调控》[5],在国内外产生了重要的学术影响,并引领该领域的发展。
1.3 土壤化学-物理-微生物界面反应
土壤中最活跃的固相组分矿物、有机质和微生物相互作用,包含了土壤化学、土壤物理、土壤微生物过程,这些过程往往同时发生,呈现相互作用的耦合特征。这一耦合过程,也就是土壤化学-物理-微生物界面反应,控制着土壤中养分的有效性和污染物质的行为,决定着土壤健康与质量;也是揭示地球表层系统中元素生物地球化学循环、过程与机制的重大前沿科学问题。1982年,第12届国际土壤学大会正式成立了土壤化学专委会下的“土壤胶体表面”工作组;1986年,在比利时根特举办了“土壤胶体-土壤溶液界面间的反应”学术研讨会;1990年,国际土壤联合会成立了“土壤矿物-有机质-微生物相互作用工作组”,土壤化学的研究逐步从物理化学机制为主发展为物理化学、生物化学机制并重;2004年,工作组升级为“土壤化学-物理-微生物界面反应专业委员会”,多界面、多过程耦合机制的研究得到前所未有的重视,使土壤由物质间的相互作用转向了土壤界面的物质与能量相互作用过程。在这一前沿主题,我国一批科学家发挥着重要的作用[17-21]。
2 新时代土壤化学前沿
在新时代土壤化学的发展历程中,微生物逐渐成为土壤物质循环的引擎,也成为土壤化学发展的重要动力。中国在土壤化学与微生物学、地球化学、矿物学、环境化学等几个学科交叉取得了突破,为推动学科发展做出了重要的贡献。
2.1 土壤化学与微生物学交叉
(1)土壤矿物-微生物的吸附过程。土壤矿物-微生物-有机物多界面的形成与稳定机制是理解土壤关键过程的前提与基础。我国学者发现细菌表面蛋白/磷脂与赤铁矿表面形成化学键,导致细胞膜损伤及胞内活性氧(ROS)产生,从而使细胞失活[22]。针铁矿可促进枯草芽孢杆菌在气液界面形成生物膜,蒙脱石可促进细菌的游动性,抑制大肠杆菌生物膜形成以及降低生物膜胞外聚合物(EPS)的黏性,高岭石可提高细菌不可逆黏附,促进菌毛和荚膜异多糖的分泌,同时诱导细菌群体密度感应信号分子(Autoinducer-2)的释放,促进生物膜的形成[17-23]。细菌与蒙脱石复合可增加重金属吸附位点,而与针铁矿复合导致吸附位点减少。革兰氏阳性菌对细菌-矿物复合体吸附行为的影响程度远大于革兰氏阴性菌。这种差异揭示了作用力和结合方式是控制复合体吸附特性的决定因子[24-25]。揭示了重金属在矿物-细菌复合体上的配位构型及分配特征[26-27];构建了营养元素与污染元素在土壤组分表面的配位与多表面模型[28-30],这对于深入理解土壤微界面特征、重金属环境行为的调控有重要意义[31]。
(2)土壤矿物-微生物的胞外电子传递过程。土壤生物电化学起源于土壤化学与微生物学的交叉融合,其核心理论是微生物胞外呼吸。根据电子传递的方向,胞外呼吸微生物包括产电微生物(Electrogen)和电营微生物(Electrotroph),两者合称电活性微生物。1987年,Lovley等首次发现异化铁还原菌GS-15[32],随后Nealson等发现MR-1[33]。近年来,我国学者分离获得了系列电活性微生物,经鉴定发现分属于50个属、128个种[34,36-37]。微生物胞外呼吸的研究迄今已有20余年(图1),微生物胞外电子产生与传递机制是土壤生物电化学最本质的科学问题。Lovley首次证实了的鞭毛具备高效导电性能,则通过外膜细胞色素(MmcA)完成胞外电子传递[38-39]。我国学者以为模型,构建菌毛缺失突变株(Δ),发现胞外细胞色素是微生物种间直接电子传递(DIET)的主要贡献者,揭示了胞外细胞色素单独介导的DIET新途径,深化与拓展了胞外呼吸理论[40]。近期研究发现GSU1497 蛋白的分子伴侣功能,证实它以三聚体的形式介导了导电菌毛的分子组装过程,为理解土壤微生物-矿物的电子交换途径提供了微观依据[31]。构建了鞭毛恢复表达的突变株,发现地杆菌鞭毛作为生物膜骨架(Biofilm scaffold)介导胞外电子传递的新功能,改变了鞭毛仅仅作为细菌运动器官的传统认识,为电活性生物膜调控提供了新的方向[41]。
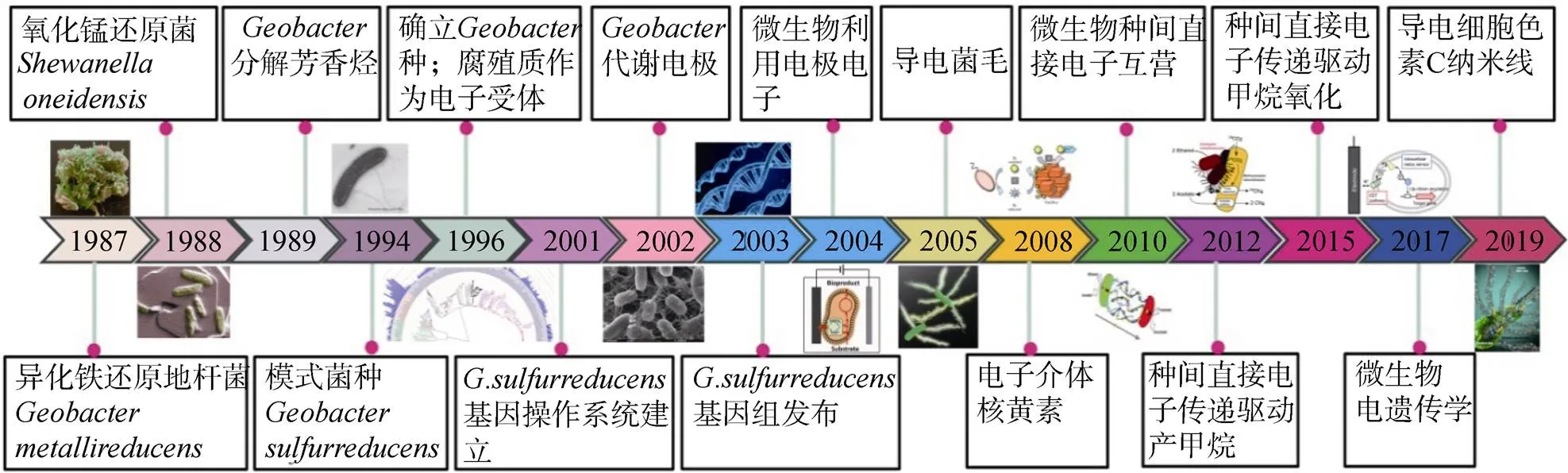
图1 微生物胞外呼吸(胞外电子转移)理论研究的里程事件
2.2 土壤化学与地球化学交叉
(1)土壤腐殖质与矿物介导的生物地球化学过程。腐殖质等典型土壤有机质,可作为电子穿梭体加速电活性生物膜与氧化铁矿物之间的胞外电子转移。自从天然腐殖质的电子穿梭属性被发现以来[42],具有腐殖质类似结构的物质(如醌、嗪、噁嗪等)被作为典型电子穿梭体进行了广泛研究。与可溶的醌类相比,吩噁嗪的穿梭机制有显著的差异:不仅能够自沉积在电子受体表面,还能强化并稳固微生物胞外电子传递[43-44]。除了电子穿梭体的性质,近期研究发现,腐殖质作为电子受体,可以显著促进生物膜形成的效应,并揭示了其生物电化学机制,深化了矿物-穿梭体-微生物的电子传递机制的理解,为自然界中腐殖质类电子穿梭体角色与功能研究提供了新的认识[45]。矿物是微生物胞外电子传递的重要电子受体,同时也能够作为电子传递的介质,增强微生物远距离的电子传输。但半导体矿物具体通过何种机制介导微生物的电子转移一直是当前土壤生物电化学方向一个难题。我国学者基于近年来建立的漫透射光谱电化学研究方法[46],揭示了矿物半导体导带在介导电子转移过程中的作用。在细胞色素与亚铁作用下,赤铁矿的平带电位发生偏移,空间电荷层发生能带弯曲,形成内建电场,加速并介导亚铁到细胞色素之间的电子转移过程[47]。从热力学角度提出并证实了矿物半导体介导亚铁到细胞色素的电子转移机制,是土壤生物电化学领域的新进展。以铁还原菌和产甲烷菌互营共生体系为切入点,提出并证实了铁还原菌与产甲烷菌间基于DIET的“电子驱动微生物产甲烷”新机制[48-49]。我国学者发现外源纳米导电磁铁矿可以同时促进CO2还原和乙酸裂解两条途径及环境效应[50-53]。此外,我国学者将土壤胶体电荷所产生的电场引入到量子力学的薛定谔方程中,对具有2s2p(如-N、-O、Mg2+等)和3s3p(如-P、-S、Ca2+等)为外层轨道的离子/原子的量子力学方程重新进行求解,发现界面存在新的强极化作用和极化诱导共价作用[54]。该理论成功地描述了水分子以及一些阳离子在土壤胶体表面上的独特化学行为。基于第一性原理的密度泛函分析,将量子力学应用于土壤化学过程研究,有助于揭示小分子和离子在土壤矿物或有机胶体表面上独特的反应机制[54-55]。
(2)土壤元素耦合过程及其环境效应。土壤元素循环和污染物转化包含了微生物、化学以及微生物-化学耦合过程[56-57]。如何解析土壤典型元素的生物地球化学过程,是土壤化学与地球化学等多领域学科交叉的前沿主题。近年来我国学者主要在新的研究方法、机制模型与环境效应方面,取得了系列进展。针对硝酸还原-亚铁氧化耦合机制难以区分的难题[58-59],自从1996年首次报道第一株微生物以来[40],前十年主要认为是微生物过程,而近十几年来化学反硝化过程引起广泛重视[56]。如何定量评估微生物机制、化学机制及其微生物-化学耦合机制及其相对贡献也一直是国际性难题。采用同位素分馏和基元反应模型,定量阐明了硝酸盐还原耦合亚铁氧化过程中的微生物-化学耦合机制和同位素分馏机制[60]。这一基于实验测试与机制模型结合的思路为定量评估生物化学相对贡献这一国际性难题提供了新的范式。微生物介导的铁、氮元素循环具有重要而广泛的环境意义。研究表明,在水稻土中,添加硝酸盐和亚铁可以富集更多的硝酸还原-亚铁氧化微生物(NRFO),导致根际土壤溶液中溶解态Fe(II)浓度大大降低。NRFO菌还可导致As共沉淀或吸附于土壤中Fe(III)矿物,从而降低水稻对还原态As的吸收[61]。我国学者还分离了硝酸盐还原型的砷氧化微生物,包括自养型砷氧化菌[21]和异养型砷氧化菌[62]。该菌能够驱动硝酸盐和氧气耦合砷氧化和亚铁氧化过程,而硝酸盐到厌氧砷污染稻田土壤中,能够通过大幅提高砷氧化基因的相对丰度和改变微生物群落的结构,进而有效降低As(III)的含量,降低了As在水稻植株中的积累[62-63]。此外,土壤腐殖质不仅能够加速微生物铁还原,而且可以直接介导微生物与砷之间的电子传递,促进砷还原,增加砷的移动性和环境风险[64],生物炭的研究中也得到了类似的结果[65]。由于生物炭具备固态穿梭体的性质,利用纯生物炭进行土壤调理,可能会增加土壤砷的毒性,从而引起次生环境风险。Fe(II)氧化对硝酸盐还原和温室气体N2O排放的非生物反应影响鲜有报道[66]。研究者提出铁轮假说,硝酸盐在森林土壤中的非生物固定化是由硝酸盐和亚铁之间的生物和非生物过程造成的[67]。虽然还不清楚非生物和生物反应是如何发生的,但研究结果强调了NRFO在公认的N循环中的存在和重要性。铁与氮的相互作用在河岸森林沉积物的铁和氮循环动力学中得到了进一步的阐述[68]。我国学者对稻田土壤的氨氧化耦合铁循环过程开展了一系列研究,通过估算,铁氨氧化过程造成氮素损失约占稻田土壤中氮素总投入的3.9%~31%[69]。并且发现生物炭和醌类化合物等电子穿梭体均显著促进了土壤中的铁氨氧化过程,并且具有协同作用[70],而土壤的理化性质显著影响微生物的群落组成,进而导致了不同土壤中的铁氨氧化效率的差异[71]。上述研究表明,铁的氧化还原转化与氮素的循环密切相关,尤其是在氧化还原发生动态变化的富铁环境中[72],这对于加深自然界中氮循环机制的认识有显著推动作用。
2.3 土壤化学与矿物学交叉
矿物是土壤中重要的固相组分,与有机质和微生物等相互作用及其界面反应,深刻影响着土壤的物理、化学和生物过程与性质,控制着土壤中养分的有效性和污染物质的行为,决定着土壤健康与质量。土壤矿物与有机物、微生物界面过程是土壤的核心过程,也是揭示地球表层系统中元素生物地球化学循环、过程与机制的重大前沿科学问题。国际上土壤化学与土壤矿物交叉研究热点可概括为在土壤多组分界面上,组分的互作机制及其对土壤性质、养分有效性、重金属化学行为与生态效应的影响等方面,主要针对人类活动和全球变化引起的土壤生态效应及其生态服务功能。我国的土壤化学与矿物学的交叉研究以土壤胶体化学和界面过程为基础,围绕土壤矿物-有机物-微生物互作界面的发生、形成及其功能,在土壤矿物与微生物、生物大分子互作过程与机制、以及土壤重金属和有机污染物在土壤-生物系统中迁移、转化方面均取得了重要进展[6,73]。为避免与2.1小节内容重复,本节将不涉及微生物与矿物互作的内容。
(1)土壤矿物-有机物互作的结合机制。联合化学分析、X-射线光电子能谱(XPS)和激光共聚焦显微镜技术(CLSM),研究者发现枯草芽孢杆菌EPS中蛋白质通过氢键优先吸附在蒙脱石和高岭石表面,而其中的核酸通过配位交换特异性识别针铁矿表面;进一步阐明了EPS中不同基团在针铁矿表面吸附的优先顺序,随着体系盐浓度的增加,EPS中蛋白质结构由弱刚性的长链结构向强刚性的螺旋结构转变[74]。利用ATR-FTIR/2D-COS技术、结合微滴定热量计法,量化了不同环境条件下层状硅酸盐矿物与腐殖酸相互作用驱动机制的相对贡献,阐明了矿物多表面对多相异质性胡敏酸的选择吸附行为[75]。高岭石边面、铝氧基面和针铁矿表面选择吸附大于12.9 kDa组分的胡敏酸,由静电引力和配体交换驱动;高岭石硅氧基面选择吸附小于12.9 kDa的组分,由疏水作用驱动[76]。土壤肥力状况深受土壤酶活性的影响,土壤腐殖酸与溶菌酶以静电吸附和疏水作用为主,该过程受热焓驱动、部分可逆,主导作用力取决于环境条件[77];腐殖酸与酶在溶液体系和土壤固相表面分别形成3D和2D两种空间结构不同的复合体,但二者形成机制和表面特性基本一致;腐殖酸-酶复合体对酶的活性与稳定性均有保护作用,该作用与腐殖酸表面疏水性、静电作用强度、以及腐殖酸与酶间的包被程度相关[78],这些结果为合理调控土壤生物活性、提升地力和修复污染土壤提供了技术保障。
(2)亚铁催化氧化铁的晶相转变与环境效应。基于氧化铁表面电子转移的异化铁还原和亚铁氧化两个过程,通常被认为组成了完整的土壤铁循环链[56]。但是,近年来研究发现,厌氧土壤体系中共存的游离态Fe(II)(Fe(II)aq)与氧化铁中结构态Fe(III)(Fe(III)oxide)之间的直接作用过程及其导致的氧化铁晶相重组,也是铁循环的重要组成,这一过程对土壤中重金属的固定脱毒具有重要作用[79-82]。诸多研究从氧化铁矿物相的“宏观”角度证实这一过程中Fe原子交换及氧化铁晶相重组的发生[83-86],但是在Fe(II)aq吸附到氧化铁表面并给出电子后,Fe(II)aq中的Fe原子在氧化铁表面(或体相中)的传递及结构取代过程、以及氧化铁晶相重组过程中重金属的吸附/固定等环境行为,是全面阐释这一过程及其环境意义的基础。我国学者采用Fe稳定同位素结合低温穆斯堡尔谱表征手段,研究了厌氧土壤中Fe(II)aq与氧化铁矿物的作用过程,发现Fe(II)aq与Fe(III)oxide的化学势差为驱动力,Fe(II)aq的Fe原子进入到氧化铁中,给出电子转变成新的Fe(III)oxide,氧化铁中的部分Fe(III)oxide则还原释放,形成Fe(II)aq[87]。Fe原子交换过程中,氧化铁的Fe-O键及Fe-Fe键发生重排,共存污染金属可取代重排后的Fe结构位或包裹于氧化铁矿物相重构后的晶格单元之间,通过同晶替代和晶格包裹两个机理途径实现固定脱毒[88-89]。土壤环境条件影响该过程氧化铁晶相重组速率以及固定重金属的效率,金属元素自身亲附性能(logK)与以上速率成正相关关系,提高固定重金属效率[90],氧化铁中共存杂质元素以及pH、有机质等土壤条件在在一定程度通过降低Fe(II)活性降低体系的反应效率[91-92]。此外,近期研究发现天然氧化物存在晶体缺陷的现象,这种缺陷被认为是加速氧化物电子传递,促进有氧条件活性氧物种产生的关键因素,有效提高了土壤砷的解毒和固定的效率[93]。这些研究进展显著提升了在分子或原子水平对氧化铁晶相转变的认知,为土壤重金属等污染调控提供了理论支撑。
2.4 土壤化学与环境化学交叉
土壤化学动力学是土壤化学与环境化学交叉形成的研究方向,是研究土壤体系化学反应速率和反应机制的重要内容。研究内容主要包括反应速率如何随反应条件变化、微观反应机制、以及建立定量模型来描述和预测动力学过程[94],涉及不同时间尺度下的多种反应,包括离子交换和吸附等快速反应、沉淀溶解以及矿物转化等慢速反应,这些动力学反应的动态耦合共同控制着宏观土壤动力学现象和污染物的环境行为。土壤化学动力学的研究对于理解土壤体系化学反应分子机制、预测地表土壤过程、养分元素循环及污染物环境行为,具有重要的科学意义。
近年来,随着先进的地球化学仪器分析手段的应用,以及与环境分析化学的交叉,基于非均质、多组分的土壤化学反应动力学理论逐渐形成。国内外土壤化学动力学研究在土壤微观界面动力学过程、化学反应分子机制、污染动力学行为等方面取得了较好的进展。
(1)土壤组分化学非均质性对化学反应动力学影响。土壤含有不同组分(如有机质和矿物组分),含有多个不同化学官能团形成的反应点位,然而对多点位动力学反应的描述需要大量的动力学参数,难以在实验中独立确定。因此,由于土壤组分的复杂性和环境条件的多变性,土壤化学动力学的定量研究一直是难点。近年来,一些机理性的热力学化学形态模型已经被建立[31,95-96],这些平衡模型能够很好的解释土壤组分化学非均质性对土壤离子平衡分布的影响。通过将热力学平衡和动力学反应有机整合,基于热力学反应机制的动力学模型已经逐渐发展起来[97-99],重点解决了土壤介质的非均质性、土壤组成和反应条件复杂性等瓶颈问题,克服了传统动力学模型在复杂土壤体系缺乏通用性的难点。比如,不同腐殖质官能团点位对重金属离子络合和释放速率具有很大的差异,而基于腐殖质官能团微观反应机制的动力学模型可以比较准确的预测不同重金属离子从溶解性有机质的释放速率[98],对预测重金属的生物有效性和毒性具有重要意义;而不同晶型矿物、不同表面反应点位,也对不同重金属的吸附解吸动力学行为起着重要的影响[99-100]。这些微界面动力学模型的发展,为发展现场条件下的综合动力学模型提供了坚实的理论基础。
(2)多过程耦合反应动力学和定量模型。土壤体系含有多个生物地球化学过程(如吸附-解吸、氧化-还原、沉淀-溶解、矿物转化等),这些过程同时又受到微生物过程的影响。多过程耦合动力学定量研究的难点在于对多个耦合反应过程和速率在微观层次上进行机理性定量描述,最近的一些定量研究在这个领域也取得了较快的进展,定量阐明了不同尺度下多个化学动力学过程的耦合和反馈共同控制污染物的环境行为[101-105]。作为一个重要的土壤污染物,研究表明,三价As在锰矿物上氧化动力学,受到三价As吸附解吸,三价As在矿物表面氧化,以及五价As的吸附解吸一系列反应的动态耦合控制,而这些过程对总体速率的影响,取决于具体的反应条件[101]。同时,微生物也广泛参与到土壤动力学过程中,介导多个化学动力学过程的耦合和反馈。最近的模型研究表明,微生物可以加强五价As从铁氧化物表面的释放,进一步在溶液中还原五价As(V),从而影响As在铁氧化物体系的化学形态和动态分布[102],这大大拓展了我们对As动力学行为的理解。除了界面反应,污染物的动力学行为也受到矿物转化的影响。铁矿物的转化对As的环境行为起着关键性的影响[106],相关的数值模型也已经发展起来[103-105],可以用于综合评估铁矿物转化过程中As的分布和传输。总体上,多过程耦合动力学定量方面的深入研究,将会使土壤动力学研究从微界面反应层次进一步拓展到多尺度多过程耦合层次,大大提高我们对现场条件下污染物环境行为的预测能力。因此,研究不同时间和空间尺度下土壤污染物形态变化和动态分布、阐明微生物介导下土壤化学过程的多尺度耦合,将是土壤化学动力学定量研究的关键难题之一。
(3)复杂土壤体系化学反应动力学过程和预测模型。由于土壤组成的复杂性和环境条件的多变性,传统的动力学模型主要是基于简单的化学级数反应方程和经验性模型[94],对实验数据进行拟合,获得的模型参数在复杂土壤体系经常缺乏通用性和预测能力;一些机理性的理论动力学模型,主要还是基于简单的单一反应介质体系的界面反应[107-108],尚未应用到复杂土壤体系中。预测复杂土壤体系化学反应动力学,需要具体考虑地区土壤的差异性和环境条件的变化,解决模型参数从模式体系到实际土壤体系的转换。最近的一些进展,采用组分叠加的方法,将模式体系的机理性动力学模型,扩展到复杂土壤体系,能够较好地描述实际土壤多组分共存情况下的宏观动力学过程,从而克服了传统动力学模型在复杂土壤体系缺乏通用性的难点[97,109-111]。将来的工作需要进一步考虑现场土壤的复杂性,以及土壤化学反应和其他物理和生物过程的耦合,从而最终建立适用于现场条件下的综合性的土壤动力学模型体系。
3 现代分析技术促进土壤化学的纵深发展
现代分析技术的快速发展是实现土壤化学与多学科交叉融合的保障与桥梁,促进了新时代土壤化学的快速发展。例如,快速停留光谱与电化学联用等技术应用于微生物胞外电子传递的实时监测与机制解析;应用同步辐射X射线吸收光谱(XAFS)、快速原位吸收光谱(Quick-XAFS)、微区X射线荧光光谱(µ-XRF)和微区吸收光谱(µ-XAFS)等技术,在土壤中重金属污染物形态及分布、污染物在土壤矿物表面的快速反应动力学特性、弱晶质氧化物鉴定等土壤化学研究前沿领域进行了深入研究;微流控技术和原子力显微镜推动了土壤矿物-有机物-微生物相互作用的原位研究;傅里叶变换离子回旋共振质谱(FT-ICR-MS)、球差校正扫描透射电子显微镜(Cs-STEM)等先进技术也逐渐应用到土壤化学的研究中,在有机质分子组成、元素空间分布方面提供了超高分辨率的信息。
3.1 研究界面反应过程的现代分析技术
(1)基于生物电化学的电子传递过程。如何方便快捷、定量化地表征多组份多界面土壤体系中电子转移的微观过程,是土壤胞外呼吸研究的基础与关键。国内研究者在传统土壤电化学的基础上,将微生物(电活性细菌)与电活性物质(腐殖质/氧化铁等)引入研究体系,弥补了传统土壤电化学局限于非生物体系的缺陷,创建了“功能基因→蛋白→细胞→生物膜”的生物电化学研究新方法,为阐明微生物-矿物/腐殖质间的微观电子交换过程(电子转移容量与转移速率)提供了有效手段,主要包括:微生物胞外呼吸活性高通量测定[112]、土壤复杂体系电子供给/接受容量测定[113-114]、土壤生物膜电活性快速表征[115]等。解析细胞色素氧化还原过程中的热力学与动力学机制,是理解胞外电子传递能量变化与物质转化的关键。我国学者构建漫透射紫外可见光谱测试技术,实现了活菌外膜细胞色素氧化还原状态的实时原位测试,构建了穿梭体介导胞外电子传递过程的热力学模型,证实了细胞色素与穿梭体两者之间反应的能量损失是造成不同穿梭体的电子介导能力存在差异的原因[116]。并从热力学角度解析了氢离子影响胞外电子传递的内在原因,证实了pH对微生物生存活性的影响较pH对电子传递势能的改变更为关键[117]。由于细胞色素反应为秒级反应[118],传统光谱手段难以捕获中间过程,通过建立快速漫透射光纤光谱测试法,研究者获得了电活性微生物外膜蛋白状态的秒级反应动力学数据,从而解析了从电子供体到细胞色素再到电子受体的基元反应动力学,确证了供体与细胞色素之间的反应是电子传递的定速步骤[119]。
(2)微流控技术及其与光谱能谱技术的联用。微流控技术是基于微米级的、能精确控制各项参数的流体工程系统,可以模拟土壤微生物的特定生长条件,实现在土壤颗粒尺度下模拟并操纵土壤微环境的空间结构和化学性质变化[120]。微流控技术与共聚焦拉曼光谱、红外光谱等技术结合,可以实现对微观样品进行非扰动原位分析。此外,O2、CO2、pH微电极等设备的应用[121],进一步实现了对微生物代谢活性等生理指标的实时监测,为土壤矿物和微生物的相互作用的可视化原位研究提供了有力的技术保障。近期,微流控芯片技术结合X-射线光电子能谱被用于原位研究土壤生物地球化学界面中碳、氧、氮等元素的行为。Coyte等[122]结合微流控、模型和博弈论三种方法,探讨了微环境对多孔介质中细菌生物膜形成的影响,结果表明,流体力学性质显著影响多孔环境中细菌之间的竞争和群体的进化。利用玻璃刻蚀的微孔结构,模拟土壤团聚体中氧气和营养物质的分布特征,Borer等[123]发现好氧菌与兼性厌氧菌可分别自动分布在孔隙网络的外侧富氧区域和中心缺氧区域,且细菌数量随孔隙连通性的降低而下降。
(3)土壤化学反应动力学研究方法。土壤环境中的化学反应具有不同速率,对动力学研究方法提出了不同的要求,不同研究方法可以用于不同的时间和空间尺度微观和宏观动力学过程的研究。最常用的方法就是传统的批量法(batch method),其最大的优点是操作简单,但是由于样品的分离通常需要一定的时间,批量反应最大的缺点是缺乏高精度的时间分辨率,从而不能准确地测定快速反应的速率(比如离子交换和快速吸附过程);同时,在批量反应器里,溶液中不断累积反应产物,也可能造成了其他额外反应的发生。流动反应器的发展可以用于解决批量反应器的一些缺点,通过连续将反应产物移出反应器,避免反应产物在反应器的积累,探索反应条件变化下的化学反应动力学。流动搅拌反应器(Stirred-flow reactor)是一个代表性的反应系统[124-125],这些年来被广泛应用于土壤及其组分的化学反应动力学的研究中[99,126-127]。总体上,发展基于先进电子显微镜、光谱和质谱技术的微观观测技术,对化学动力学过程在纳米和亚纳米尺度下进行观测,是土壤化学动力学新的发展方向之一[128-131]。如果能解决土壤环境条件下组分复杂、低浓度、原位测量等方法难点,这些先进仪器分析技术将大力推动土壤化学动力学的发展,使得在原子分子层次上直接研究复杂土壤动力学反应成为可能。
(4)非传统(金属)稳定同位素示踪。以金属稳定同位素分馏与示踪为基础,土壤化学学科呈现出微观机制跟踪、反应过程定量化示踪、以及区域迁移过程贡献定量化解析等发展态势。在土壤体系中,利用镁同位素发现铁氧化物和低镁黏土矿物可富集轻镁同位素,揭示了镁由惰性态转变为可利用态的关键地球化学过程[132];此外,采用Fe同位素分馏研究不同种植条件下水稻吸收转运Fe的过程机制,证实不同条件下水稻吸收Fe的机制性差异[88]。金属稳定同位素更是对重金属区域迁移过程的示踪性研究提供了强有力的手段。比如,通过对我国西南都匀闪锌矿核心矿区、地表径流、目标农田土壤等重金属迁移体系中的不同环境介质锌同位素组成结合多端元模型研究,可定量解析Zn通过尾矿中细粒物质的长期风散以及采矿粉尘的直接物理传输进入农田土壤,明确了其平均贡献比达到19.5%[133]。
3.2 研究矿物结构的现代分析技术
(1)同步辐射X射线技术。XAFS谱包含X射线吸收近边结构光谱(XANES)和扩展X射线吸收精细结构光谱(EXAFS)。XANES谱能确定目标元素的氧化态和对称性、配体电负性等信息。吸收边能量位置会随氧化态的增加而增加,如As(III)吸收边的能量低于As(V)吸收边能量数个电子伏。而利用EXAFS技术可准确揭示各种金属离子在铁氧化物、锰氧化物中的赋存机制,以及重金属在土壤腐殖质上的结合机制[134-136]。此外,在主成分分析的基础上,借助于XANES和EXAFS谱的线性拟合分析(LCF),可以揭示污染物不同价态的比例或复杂多相体系中污染物的赋存形式。针对处于复杂多相体系的环境样品中目标元素,需要借助同步辐射微区技术如μ-XRF和μ-XAFS。例如,应用μ-XRF和μ-XANES技术研究发现Pb2+主要吸附于水铁矿-芽孢杆菌复合物中的细菌表面[137]。
随着X射线吸收光谱(XAS)技术的发展和谱图采集速度的加快,快速原位XAS技术已经被用于测量元素在矿物表面上动力学反应速率,有力推动了微观动力学反应分子机制的研究。Quick-XAFS技术被用于研究环境界面快速氧化还原过程,如锰氧化物对As(III)、Cr(III)的氧化[138-139]。原位XAS光谱技术可以广泛应用于研究矿物-水界面间的氧化还原速率、金属沉淀物的形成,在分子层次上提供了直接动力学反应的证据,促进了对动力学反应分子机制的理解。
(2)高分辨显微镜技术。原子力显微镜(AFM)作为一项重要的表面可视化技术,以其独特的优势(具有纳米级的空间分辨率、皮牛级力灵敏度、免标记、可在溶液环境下工作)被广泛应用于矿物-微生物互作的研究。AFM不仅可以在近生理环境下对微生物表面超微形貌进行可视化表征,同时还可以通过纳米压痕对微生物的机械特性(弹性和黏性)进行定量测量,利用AFM单细胞和单分子力谱技术可以获得生物膜形成过程中细胞-基底以及细胞-细胞之间的相互作用力,为生物膜的实时原位系统研究提供了可行性。近年来建立的AFM与红外光谱联用技术(AFM-IR)可以对微区中有机质的化学组成和结构进行成像,分辨率可达100 nm,远高于传统的显微红外技术(micro-FTIR),该技术已在材料和生命科学领域应用。Yang等[140]首次将AFM-IR应用于地球科学领域,在纳米尺度原位表征新鲜页岩中天然有机质的地球化学和地质力学性质,揭示了页岩中单个显微组分的地球化学演变过程。
此外,球差校正扫描透射电子显微镜(Cs-STEM)技术发展迅速,能够在纳米甚至原子尺度观测化学反应,为在微观尺度下解析动力学反应机制提供了新的工具[141-142]。利用Cs-STEM技术,可以追踪有机质-铁矿物-重金属的动态反应过程,揭示不同时间和空间尺度下的有机碳和重金属与铁矿物的反应行为[128,143-144]。
(3)傅里叶变换离子回旋共振质谱(FT-ICR-MS)技术。随着傅里叶变换离子回旋共振质谱(FT-ICR-MS)技术的发展,FT-ICR-MS逐渐被应用于土壤有机质化学的研究中。土壤溶解性有机质(DOM)的组成和特性可以在分子层次上得以揭示,大大提高了我们对土壤有机质分子生物地球化学过程的理解。在微观层次上,FT-ICR-MS被用于研究土壤DOM分子的特性,如DOM在氧化还原界面或者矿物与水相界面的分子分馏行为[145-146]和DOM的微生物降解[147],有力促进了对土壤矿物与有机质分子相互作用以及土壤有机质分子形成和降解的认识。在宏观尺度下,利用FT-ICR-MS得到的分子组成信息,结合统计模型分析,阐明了关键环境条件对土壤DOM分子多样性的影响[148-149],加深了对控制土壤有机质分子多样性的机制的理解。此外,FT-ICR-MS可以在分子层次上研究DOM与重金属的反应特性[150-151],从而有助于深化对重金属在土壤中动态行为的理解。
(4)穆斯堡尔谱分析技术。穆斯堡尔谱已逐渐发展为土壤结构及其变化、土壤铁循环及金属元素环境行为的重要研究手段。利用穆斯堡尔谱研究土壤黏粒矿物组成及其比例可反映出成土条件和成土过程的变化。利用穆斯堡尔谱结合稳定铁同位素标记,可对土壤铁循环过程中Fe原子的转化过程进行跟踪性研究。以57Fe标记游离态Fe(II),可以揭示游离态Fe(II)与氧化铁中的结构态Fe(III)可发生Fe原子的交换过程[87,89]。穆斯堡尔谱也可以用于解析土壤中Fe(II)与各种金属取代的铁氧化物进行原子交换和电子迁移,以及所伴随着的金属固定与释放[88];对Fe(II)与Ni取代的针铁矿体系的穆斯堡尔谱研究显示,Fe(II)驱动针铁矿的再结晶过程能诱导Ni元素的循环转化,对于研究土壤中重金属的地球化学过程有着重要意义[88]。
4 学科展望
进入新时期以来,人类活动影响下各圈层环境系统相互作用的过程、机理、效应和风险复杂程度是始料未及的。土壤化学作为地球表层系统的核心过程之一,面临着如何加强与地球宜居性这一人类所面临的重大命题的交叉融合。迫切需要综合运用地球表层系统科学理论[152],发展先进的土壤化学结构与过程表征的新方法,获取土壤化学过程的新科学证据和新科学认知,实现“0到1”的原创性成果的突破。未来的研究需要进一步加强与微生物学、地球化学、环境化学等学科的交叉融合,从水-土、根-土、土-气等多界面,矿物、微生物、有机质以及氧气、质子、电子等多要素,离子交换、氧化-还原、络合-配位、沉淀-溶解、吸附-解吸等多过程,这“三多”交互耦合的维度,系统揭示地球表层系统中物质循环与能力交换的土壤化学机制,寻求学科新的增长点,并形成国际领衔的方向;并为地球宜居性、区域环境生态可持续性、全球变化、土壤污染防治等国家重大需求提供理论支撑(图2)。具体需重点关注以下几个方面:
(1)土壤化学的多学科交叉发展与新的增长点。首先,土壤化学与微生物学的交叉融合,土壤生物化学、土壤生物电化学可能发展为新的分支学科。需重点关注:土壤中电活性微生物的物种多样性、模式菌株及其功能挖掘;土壤生物电化学模式体系及其胞外电子转移研究新方法的创建;微生物-矿物-腐殖质间胞外电子传递新机制及生态环境效应;土壤化学与微生物相互作用驱动碳循环、氮循环及重金属转化的过程及效应;基于土壤生物电化学原理的新型土壤及地下水原位修复技术及设备研发。其次,土壤化学与环境科学、生态学等多学科交叉,运用现代分析技术,侧重于土壤中有机质和矿物这两大关键组分在土壤微生物驱动下的交互作用,注重定量化研究和原位监测,综合观测与研究地球关键带中所发生的土壤化学界面反应与生物地球化学循环过程,并依托野外台站开展与土壤化学有关的综合性重大科学问题研究,以期引领在国际上引领该主题的发展。
(2)复杂环境条件下的土壤化学过程定量研究。首先,土壤化学反应动力学研究的发展受益于地球化学和环境化学方面先进仪器分析手段的发展,在预测土壤元素循环和污染物动态环境行为的研究中起着核心作用,将来的发展要兼顾国际科研的前沿领域和国家对土壤污染控制的重大需求,从微观到场地开展多尺度研究,具体考虑与土壤物理和环境地理学的学科交叉。应深入阐明土壤矿物-有机质-微生物动态相互作用的动力学过程;探索全球变化影响下土壤物质循环与能量转换的化学动力学过程及预测模型;发展和完善土壤体系多组分多过程动力学反应理论;阐明土壤多尺度、多过程耦合反应动力学机制,定量阐明物理扩散-化学反应-微生物过程的动态耦合,发展适用于污染场地和田间环境条件下的土壤多尺度多过程动力学行为预测模型。其次,要充分考虑土壤剖面与景观尺度的结构异质性,以及实际环境中土壤-植物系统中发生的土壤化学过程,建立反应动力学模型,计算在实际环境中的反应速率,定量解析各要素、各过程的作用机制。
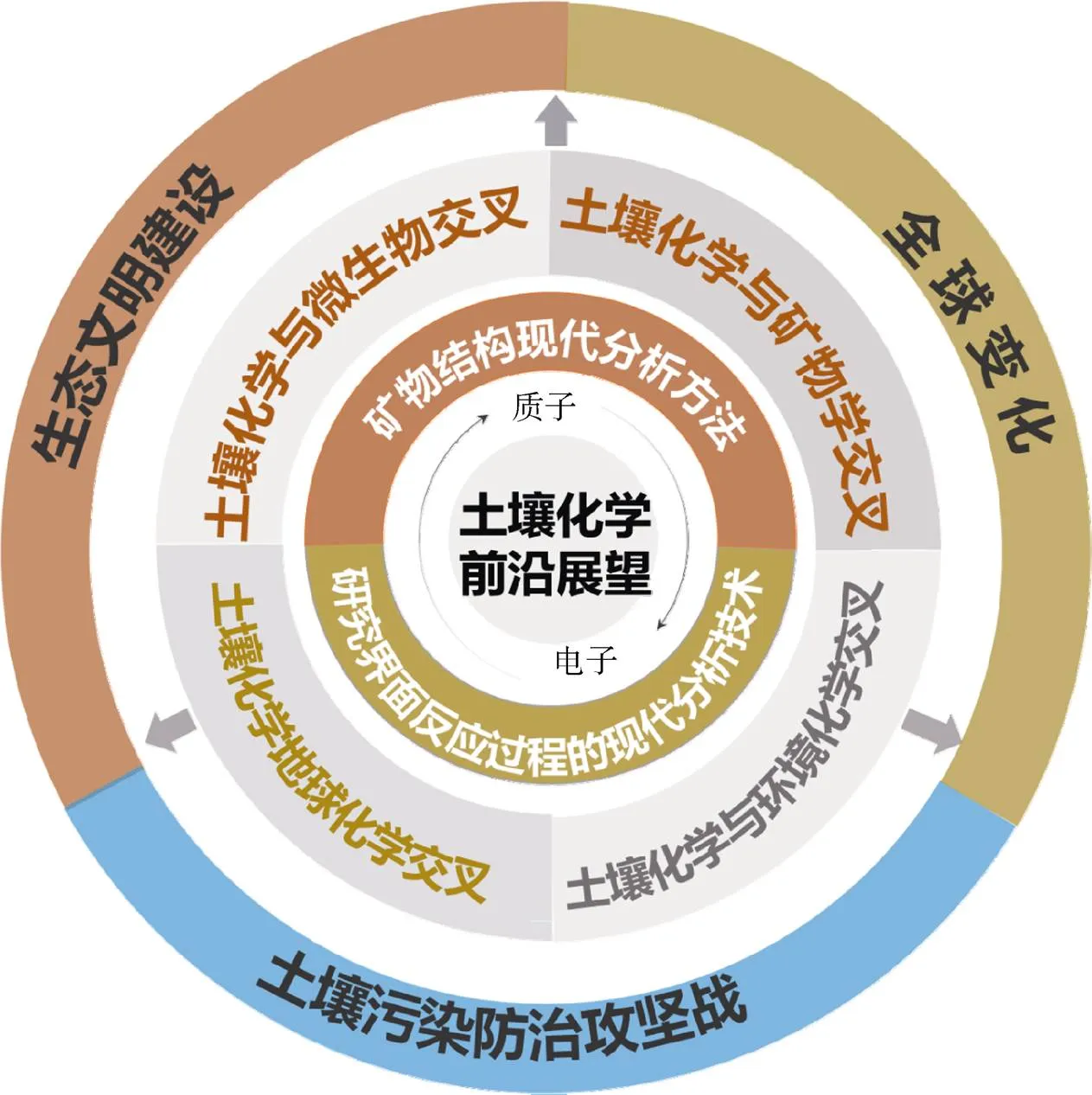
图2 新时代土壤化学前沿展望
(3)土壤化学服务国家需求。土壤作为地球的皮肤,是地球表层系统的重要组成,而土壤化学是地球表层系统的基本过程。土壤化学作为环境地球科学的基础性分支学科,在服务国家需求方面可发挥重要的作用。当今,我国社会经济高度发展,同时高强度的人类活动导致环境面临着巨大的压力,大气、水体、土壤与农产品的环境质量堪忧,全球变化加剧,地球宜居性与区域环境生态可持续性面临重大挑战。土壤化学需要从三个方面发挥服务国家需求的功能:第一,提升土壤的化学固碳能力,降低甲烷、氧化亚氮等问题气体的排放,特别是提升土壤对水分的固持能力,发挥其应对全球变化的功能;第二,改善土壤的化学与物理结构,提升土壤对氮、磷等营养盐的固持能力,提高土壤-植物体系的氮磷利用率,减少其向水体的排放,为地表水污染防治发挥作用;第三,提高土壤的重金属容量,抑制土壤酸化,降低土壤中重金属的活性,提升农产品的安全达标率,服务于土壤污染防治行动计划。
[ 1 ] Xu J M,Jiang X,Liu F,et al. Soil chemistry science in China and its perspective[J]. Acta Pedologica Sinica,2008,45(5):817—829. [徐建明,蒋新,刘凡,等. 中国土壤化学的研究与展望[J]. 土壤学报,2008,45(5):817—829.]
[ 2 ] Wu Y D,Li F B,Liu T X. Mechanism of extracellular electron transfer among microbe–humus–mineral in soil:A review[J]. Acta Pedologica Sinica,2016,53(2):277—291. [吴云当,李芳柏,刘同旭. 土壤微生物—腐殖质—矿物间的胞外电子传递机制研究进展[J]. 土壤学报,2016,53(2):277—291.]
[ 3 ] Ma C,Zhou S G,Zhuang L,et al. Electron transfer mechanism of extracellular respiration:A review[J]. Acta Ecologica Sinica,2011,31(7):2008—2018. [马晨,周顺桂,庄莉,等. 微生物胞外呼吸电子传递机制研究进展[J]. 生态学报,2011,31(7):2008—2018.]
[ 4 ] Römheld V,Marschner H. Evidence for a specific uptake system for iron phytosiderophores in roots of grasses[J]. Plant Physiology,1986,80(1):175—180.
[ 5 ] Zhang F S,Shen J B,Feng G. Rhizosphere Ecology:Processes & Management[M]. Beijing:China Agricultural University Press,2009. [张福锁,申建波,冯固. 根际生态学:过程与调控[M]. 北京:中国农业大学出版社,2009.]
[ 6 ] Song C Q,Tan W F. The historical venation of soil science in the past 30 years—Based on the bibliometric analysis[J]. Acta Pedologica Sinica,2015,52(5):957—969. [宋长青,谭文峰. 基于文献计量分析的近30年国内外土壤科学发展过程解析[J]. 土壤学报,2015,52(5):957—969.]
[ 7 ] Yu T R. Some views on the development of soil chemistry abroad[J]. Soils,1987,19(4):169—176. [于天仁. 对国外土壤化学发展的一些看法[J]. 土壤,1987,19(4):169—176.]
[ 8 ] Yuan K N. Review of soil chemistry researches in China(1949-1989)[J]. Acta Pedologica Sinica,1989,26(3):249—254. [袁可能. 我国土壤化学研究工作的回顾(1949—1989)[J]. 土壤学报,1989,26(3):249—254.]
[ 9 ] Adsorption properties of subtropical and tropical variable charge soils:Implications from climate change and biochar amendment//Xu R-k,Qafoku N P,van Ranst E,et al. Advances in Agronomy[M]. Elsevier,2016:1—58.
[ 10 ] Xu R K,Li J Y,Jiang J. Progresses in research on special chemical phenomena and their mechanisms in variable charge soils[J]. Acta Pedologica Sinica,2014,51(2):207—215. [徐仁扣,李九玉,姜军. 可变电荷土壤中特殊化学现象及其微观机制的研究进展[J]. 土壤学报,2014,51(2):207—215.]
[ 11 ] Zhang F,Romheld V,Marschner H. Release of zinc mobilizing root exudates in different plant species as affected by zinc nutritional status[J]. Journal of Plant Nutrition,1991,14(7):675—686.
[ 12 ] Zhang F. Mobilisation of iron and manganese by plant-borne and synthetic metal chelators[J]. Plant and Soil,1993,155(1):111—114.
[ 13 ] Zuo Y,Zhang F,Li X,et al. Studies on the improvement in iron nutrition of peanut by intercropping with maize on a calcareous soil[J]. Plant and Soil,2000,220(1-2):13—25.
[ 14 ] Xiong H,Kakei Y,Kobayashi T,et al. Molecular evidence for phytosiderophore-induced improvement of iron nutrition of peanut intercropped with maize in calcareous soil[J]. Plant,Cell and Environment,2013,36(10):1888—1902.
[ 15 ] Marschner H. Mineral Nutrition of Higher Plants[M]. 3nd ed. Academic Press,2011.
[ 16 ] Zhang F,Ma J,Cao Y. Phosphorus deficiency enhances root exudation of low-molecular weight organic acids and utilization of sparingly soluble inorganic phosphates by radish(L.)and rape(L.)plants[J]. Plant and Soil,1997,196(2):261—264.
[ 17 ] Cai P,Liu X,Ji D,et al. Impact of soil clay minerals on growth,biofilm formation,and virulence gene expression ofo157:H7[J]. Environmental Pollution,2018,243:953—960.
[ 18 ] He Y,Xu J,Lv X,et al. Does the depletion of pentachlorophenol in root-soil interface follow a simple linear dependence on the distance to root surfaces? [J] Soil Biology and Biochemistry,2009,41(9):1807—1813.
[ 19 ] Li F,Wang X,Liu C,et al. Reductive transformation of pentachlorophenol on the interface of subtropical soil colloids and water[J]. Geoderma,2008,148(1):70—78.
[ 20 ] Li H,Yang X,Zhang Z,et al. Nitrogen loss by anaerobic oxidation of ammonium in rice rhizosphere[J]. The ISME Journal,2015,9(9):2059—2067.
[ 21 ] Zhang J,Zhou W,Liu B,et al. Anaerobic arsenite oxidation by an autotrophic arsenite-oxidizing bacterium from an arsenic-contaminated paddy soil[J]. Environmental Science & Technology,2015,49(10):5956—5964.
[ 22 ] Qu C,Qian S,Chen L,et al. Size-dependent bacterial toxicity of hematite particles[J]. Environmental Science & Technology,2019,53(14):8147—8156.
[ 23 ] Ouyang K,Walker S L,Yu X Y,et al. Metabolism,survival,and gene expression of pseudomonas putida to hematite nanoparticles mediated by surface-bound humic acid[J]. Environmental Science:Nano,2018,5(3):682—695.
[ 24 ] Fang L,Yang S,Huang Q,et al. Biosorption mechanisms of Cu(II)by extracellular polymeric substances from bacillus subtilis[J]. Chemical Geology,2014,386:143—151.
[ 25 ] Tian H,Fang L,Duan C,et al. Dominant factor affecting Pb speciation and the leaching risk among land-use types around Pb-Zn mine[J]. Geoderma,2018,326:123—132.
[ 26 ] Du H,Qu C,Liu J,et al. Molecular investigation on the binding of Cd(II)by the binary mixtures of montmorillonite with two bacterial species[J]. Environmental Pollution,2017,229:871—878.
[ 27 ] Chen H,Xu J,Tan W,et al. Lead binding to wild metal-resistant bacteria analyzed by ITC and XAFS spectroscopy[J]. Environmental Pollution,2019,250:118—126.
[ 28 ] Koopal L,Tan W,Avena M. Mixed ad/desorption kinetics unraveled with the equilibrium adsorption isotherm[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects,2019,577:709—722.
[ 29 ] Xu J,Koopal L K,Fang L,et al. Proton and copper binding to humic acids analyzed by XAFS spectroscopy and isothermal titration calorimetry[J]. Environmental Science & Technology,2018,52(7):4099—4107.
[ 30 ] Zhao W,Tan W,Wang M,et al. CD-MUSIC-EDL modeling of Pb2+adsorption on birnessites:Role of vacant and edge sites[J]. Environmental Science & Technology,2018,52(18):10522—10531.
[ 31 ] Xiong J,Weng L,Koopal L K,et al. Effect of soil fulvic and humic acids on Pb binding to the goethite/solution interface:Ligand charge distribution modeling and speciation distribution of Pb[J]. Environmental Science & Technology,2018,52(3):1348—1356.
[ 32 ] Lovley D R,Stolz J F,Nord G L,et al. Anaerobic production of magnetite by a dissimilatory iron-reducing microorganism[J]. Nature,1987,330(6145):252—254.
[ 33 ] Myers C R,Nealson K H. Bacterial manganese reduction and growth with manganese oxide as the sole electron acceptor[J]. Science,1988,240(4857):1319—1321.
[ 34 ] Wu C Y,Zhuang L,Zhou S G,et al.sp. Nov.,an alkaliphilic,humic acid-reducing bacterium isolated from a microbial fuel cell[J]. International Journal of Systematic and Evolutionary Microbiology,2011,61(4):882—887.
[ 35 ] Yang G Q,Zhang J,Kwon S W,et al.sp. Nov.,a humus-reducing bacterium isolated from a microbial fuel cell[J]. International Journal of Systematic and Evolutionary Microbiology,2013,63(3):873—878.
[ 36 ] Zhou S,Han L,Wang Y,et al.sp. Nov.,a nitrogen-fixing bacterium isolated from a microbial fuel cell[J]. International Journal of Systematic and Evolutionary Microbiology,2013,63(7):2618—2624.
[ 37 ] Zhou S,Yang G,Lu Q,et al.sp. Nov.,a dissimilatory Fe(III)-reducing bacterium isolated from forest soil[J]. International Journal of Systematic and Evolutionary Microbiology,2014,64(11):3786—3791.
[ 38 ] Holmes D E,Ueki T,Tang H Y,et al. A membrane-bound cytochrome enables methanosarcina acetivorans to conserve energy from extracellular electron transfer[J]. MBio,2019,10(4):e00789—00719.
[ 39 ] Walker D J,Martz E,Holmes D E,et al. The archaellum ofis electrically conductive[J]. MBio,2019,10(2):e00579—00519.
[ 40 ] Straub K L,Benz M,Schink B,et al. Anaerobic,nitrate-dependent microbial oxidation of ferrous iron[J]. Applied and Environmental Microbiology,1996,62(4):1458—1460.
[ 41 ] Liu T,Wang Y,Li X,et al. Redox dynamics and equilibria of-type cytochromes in the presence of Fe(II)under anoxic conditions:Insights into enzymatic iron oxidation[J]. Chemical Geology,2017,468:97—104.
[ 42 ] Lovley D R,Coates J D,Blunt-Harris E L,et al. Humic substances as electron acceptors for microbial respiration[J]. Nature,1996,382(6590):445—448.
[ 43 ] Wu Y,Liu W,Liu T,et al. Sustainable electron shuttling processes mediated by in situ‐deposited phenoxazine[J]. ChemElectroChem,2018,5(16):2171—2175.
[ 44 ] Qin B,Wu Y,Wang G,et al. Physicochemical constraints on the in-situ deposited phenoxazine mediated electron shuttling process[J]. Electrochimica Acta,2020:135934.
[ 45 ] Wu Y,Luo X,Qin B,et al. Enhanced current production by exogenous electron mediators via synergy of promoting biofilm formation and electron shuttling process[J]. Environmental Science & Technology,2020,doi:10.1021/acs.est.0c00141.
[ 46 ] Wu Y D,Liu T X,Li F B. Examination of extracellular electron transfer process mediated by-type cytochrome in intact cells using a diffuse-transmittance spectroelectrochemical method[J]. Scientia Sinica Technologica,2019,49(12):1473—1482. [吴云当,刘同旭,李芳柏. 漫透射光谱电化学研究活菌细胞色素蛋白介导的胞外电子传递过程[J]. 中国科学:技术科学,2019,49(12):1473—1482.]
[ 47 ] Liu T,Wang Y,Liu C,et al. Conduction band of hematite can mediate cytochrome reduction by Fe(II)under dark and anoxic conditions[J]. Environmental Science & Technology,2020,doi:10.1021/acs.est.9b06141.
[ 48 ] Liu F,Rotaru A E,Shrestha P M,et al. Promoting direct interspecies electron transfer with activated carbon[J]. Energy & Environmental Science,2012,5(10):8982—8989.
[ 49 ] Rotaru A E,Shrestha P M,Liu F,et al. A new model for electron flow during anaerobic digestion:Direct interspecies electron transfer to methanosaeta for the reduction of carbon dioxide to methane[J]. Energy & Environmental Science,2014,7(1):408—415.
[ 50 ] Xiao L,Liu F,Liu J,et al. Nano-Fe3O4particles accelerating electromethanogenesis on an hour-long timescale in wetland soil[J]. Environmental Science:Nano,2018,5(2):436—445.
[ 51 ] Xiao L,Sun R,Zhang P,et al. Simultaneous intensification of direct acetate cleavage and CO2reduction to generate methane by bioaugmentation and increased electron transfer[J]. Chemical Engineering Journal,2019,378:122229.
[ 52 ] Xiao L,Liu F,Lichtfouse E,et al. Methane production by acetate dismutation stimulated by shewanella oneidensis and carbon materials:As an alternative to classical CO2reduction[J]. Chemical Engineering Journal,2020:124469.
[ 53 ] Xiao L,Wei W,Luo M,et al. A potential contribution of a Fe(III)-rich red clay horizon to methane release:Biogenetic magnetite-mediated methanogenesis[J]. Catena,2019,181:104081.
[ 54 ] Li Q,Yang S,Tang Y,et al. Asymmetric hybridization orbitals at the charged interface initiates new surface reactions:A quantum mechanics exploration[J]. The Journal of Physical Chemistry C,2019,123(41):25278—25285.
[ 55 ] Wang Q,Zhu C,Huang X,et al. Abiotic reduction of uranium(VI)with humic acid at mineral surfaces:Competing mechanisms,ligand and substituent effects,and electronic structure and vibrational properties[J]. Environmental Pollution,2019,254:113110.
[ 56 ] Melton E D,Swanner E D,Behrens S,et al. The interplay of microbially mediated and abiotic reactions in the biogeochemical Fe cycle[J]. Nature Reviews Microbiology,2014,12(12):797—808.
[ 57 ] Borch T,Kretzschmar R,Kappler A,et al. Biogeochemical redox processes and their impact on contaminant dynamics[J]. Environmental Science & Technology,2010,44(1):15—23.
[ 58 ] Chen D,Liu T,Li X,et al. Biological and chemical processes of microbially mediated nitrate-reducing Fe(II)oxidation bysp. Strain 2002[J]. Chemical Geology,2018,476:59—69.
[ 59 ] Liu T,Chen D,Luo X,et al. Microbially mediated nitrate-reducing Fe(II)oxidation:Quantification of chemodenitrification and biological reactions[J]. Geochimica et Cosmochimica Acta,2019,256:97—115.
[ 60 ] Chen G,Chen D,Li F,et al. Dual nitrogen-oxygen isotopic analysis and kinetic model for enzymatic nitrate reduction coupled with Fe(II)oxidation bysp. Strain 2002[J]. Chemical Geology,2020:119456.
[ 61 ] Chen X P,Zhu Y G,Hong M N,et al. Effects of different forms of nitrogen fertilizers on arsenic uptake by rice plants[J]. Environmental Toxicology and Chemistry,2008,27(4):881—887.
[ 62 ] Zhang J,Zhao S,Xu Y,et al. Nitrate stimulates anaerobic microbial arsenite oxidation in paddy soils[J]. Environmental Science & Technology,2017,51(8):4377—4386.
[ 63 ] Wang X,Liu T,Li F,et al. Effects of simultaneous application of ferrous iron and nitrate on arsenic accumulation in rice grown in contaminated paddy soil[J]. ACS Earth and Space Chemistry,2018,2(2):103—111.
[ 64 ] Qiao J,Li X,Li F,et al. Humic substances facilitate arsenic reduction and release in flooded paddy soil[J]. Environmental Science & Technology,2019,53(9):5034—5042.
[ 65 ] Qiao J T,Li X M,Hu M,et al. Transcriptional activity of arsenic-reducing bacteria and genes regulated by lactate and biochar during arsenic transformation in flooded paddy soil[J]. Environmental Science & Technology,2018,52(1):61—70.
[ 66 ] Zhu-Barker X,Cavazos A R,Ostrom N E,et al. The importance of abiotic reactions for nitrous oxide production[J]. Biogeochemistry,2015,126(3):251—267.
[ 67 ] Davidson E A,Chorover J,Dail D B. A mechanism of abiotic immobilization of nitrate in forest ecosystems:The ferrous wheel hypothesis[J]. Global Change Biology,2003,9(2):228—236.
[ 68 ] Clément J C,Shrestha J,Ehrenfeld J G,et al. Ammonium oxidation coupled to dissimilatory reduction of iron under anaerobic conditions in wetland soils[J]. Soil Biology and Biochemistry,2005,37(12):2323—2328.
[ 69 ] Ding L J,An X L,Li S,et al. Nitrogen loss through anaerobic ammonium oxidation coupled to iron reduction from paddy soils in a chronosequence[J]. Environmental Science & Technology,2014,48(18):10641—10647.
[ 70 ] Zhou G,Yang X,Li H,et al. Electron shuttles enhance anaerobic ammonium oxidation coupled to iron(III)reduction[J]. Environmental Science & Technology,2016,50:9298—9307.
[ 71 ] Li H,Su J Q,Yang X,et al. RNA stable isotope probing of potential feammox population in paddy soil[J]. Environmental Science & Technology,2019,53:4841—4849.
[ 72 ] Buchwald C,Grabb K,Hansel C M,et al. Constraining the role of iron in environmental nitrogen transformations:Dual stable isotope systematics of abiotic NO2−reduction by Fe(II)and its production of N2O[J]. Geochimica et Cosmochimica Acta,2016,186:1—12.
[ 73 ] Song C Q. Research Advances in the Frontiers of Pedology[M]. Beijing:The Commercial Press,2016. [宋长青. 土壤学若干前沿领域研究进展[M]. 北京:商务印书馆,2016.]
[ 74 ] Lin D,Ma W,Jin Z,et al. Interactions of EPS with soil minerals:A combination study by ITC and CLSM[J]. Colloids and Surfaces B:Biointerfaces,2016,138:10—16.
[ 75 ] Chen H,Koopal L K,Xiong J,et al. Mechanisms of soil humic acid adsorption onto montmorillonite and kaolinite[J]. Journal of Colloid and Interface Science,2017,504:457—467.
[ 76 ] Chen H,Koopal L K,Xu J,et al. Selective adsorption of soil humic acid on binary systems containing kaolinite and goethite:Assessment of sorbent interactions[J]. European Journal of Soil Science,2019,70(5):1098—1107.
[ 77 ] Tan W F,Koopal L K,Norde W. Interaction between humic acid and lysozyme,studied by dynamic light scattering and isothermal titration calorimetry[J]. Environmental Science & Technology,2009,43(3):591—596.
[ 78 ] Tan W,Norde W,Koopal L K. Interaction between lysozyme and humic acid in layer-by-layer assemblies:Effects of pH and ionic strength[J]. Journal of Colloid and Interface Science,2014,430:40—46.
[ 79 ] Amstaetter K,Borch T,Laresecasanova P,et al. Redox transformation of arsenic by Fe(II)-activated goethite(α-FeOOH)[J]. Environmental Science & Technology,2010,44(1):102—108.
[ 80 ] Boland D D,Collins R N,Glover C J,et al. Reduction of U(VI)by Fe(II)during the Fe(II)-accelerated transformation of ferrihydrite[J]. Environmental Science & Technology,2014,48(16):9086—9093.
[ 81 ] Frierdich A J,Catalano J G. Fe(II)-mediated reduction and repartitioning of structurally incorporated Cu,Co,and Mn in iron oxides[J]. Environmental Science & Technology,2012,46(20):11070—11077.
[ 82 ] Karimian N,Burton E D,Johnston S G,et al. Humic acid impacts antimony partitioning and speciation during iron(II)-induced ferrihydrite transformation[J]. Science of the Total Environment,2019,683:399—410.
[ 83 ] Frierdich A J,Helgeson M,Liu C,et al. Iron atom exchange between hematite and aqueous Fe(II)[J]. Environmental Science & Technology,2015,49(14):8479—8486.
[ 84 ] Handler R M,Beard B L,Johnson C M,et al. Atom exchange between aqueous Fe(II)and goethite:An Fe isotope tracer study[J]. Environmental Science & Technology,2009,43(4):1102—1107.
[ 85 ] Williams A G B,Scherer M M. Spectroscopic evidence for Fe(II)-Fe(III)electron transfer at the iron oxide-water interface[J]. Environmental Science & Technology,2004,38(18):4782—4790.
[ 86 ] Yanina S V,Rosso K M. Linked reactivity at mineral-water interfaces through bulk crystal conduction[J]. Science,2008,320(5873):218—222.
[ 87 ] Liu C S,Wei Z Q,Li F B,et al. The Fe atom exchange mechanism in Fe(II)-induced recrystallization of hematite:Stable Fe isotope tracing study[J]. Scientia Sinica Terrae,2016,46(11):1542—1553. [刘承帅,韦志琦,李芳柏,等. 游离态Fe(II)驱动赤铁矿晶相重组的Fe原子交换机制:稳定Fe同位素示踪研究[J]. 中国科学:地球科学,2016,46(11):1542—1553.]
[ 88 ] Liu C S,Chen M J,Li F B,et al. Stabilization of Cd2+/Cr3+during aqueous Fe(II)-induced recrystallization of Al-substituted goethite[J]. Soil Science Society of America Journal,2019,83(2):483—491.
[ 89 ] Liu C S,Li F B,Chen M J,et al. Adsorption and stabilization of lead during Fe(II)-catalyzed phase transformation of ferrihydrite[J]. Acta Chimica Sinca,2017,75(6):621—628. [刘承帅,李芳柏,陈曼佳,等. Fe(II)催化水铁矿晶相转变过程中Pb的吸附与固定[J]. 化学学报,2017,75(6):621—628.]
[ 90 ] Liu C,Zhu Z,Li F,et al. Fe(II)-induced phase transformation of ferrihydrite:The inhibition effects and stabilization of divalent metal cations[J]. Chemical Geology,2016,444:110—119.
[ 91 ] Hua J,Chen M,Liu C,et al. Cr release from Cr-substituted goethite during aqueous Fe(II)-induced recrystallization[J]. Minerals,2018,8(9):367.
[ 92 ] Hua J,Liu C,Li F,et al. Effects of rare earth elements’ physicochemical properties on their stabilization during the Fe(II)aq-induced phase transformation of ferrihydrite[J]. ACS Earth and Space Chemistry,2019,3(6):895—904.
[ 93 ] Hong Z B,Fang L P,Zhong S X,et al. Fe(II)-mediated activation of oxygen by goethite for the As(III)oxidation and the mechanisms[J]. Chinese Science Bulletin,2020,65(11):997—1008. [洪泽彬,方利平,钟松雄,等. Fe(II)介导针铁矿活化氧气催化As(III)氧化过程与作用机制[J]. 科学通报,2020,65(11):997—1008.]
[ 94 ] Sparks D L. Kinetics of Soil Chemical Processes[M]. San Diego,CA:Academic Press,1989.
[ 95 ] Tipping E,Lofts S,Sonke J E. Humic ion-binding model VII:A revised parameterisation of cation-binding by humic substances[J]. Environmental Chemistry,2011,8(3):225—235.
[ 96 ] Weng L P,Temminghoff E J M,van Riemsdijk W H. Contribution of individual sorhents to the control of heavy metal activity in sandy soil[J]. Environmental Science & Technology,2001,35(22):4436—4443.
[ 97 ] Peng L,Liu P,Feng X,et al. Kinetics of heavy metal adsorption and desorption in soil:Developing a unified model based on chemical speciation[J]. Geochimica et Cosmochimica Acta,2018,224:282—300.
[ 98 ] Shi Z,Wang P,Peng L,et al. Kinetics of heavy metal dissociation from natural organic matter:Roles of the carboxylic and phenolic sites[J]. Environmental Science & Technology,2016,50(19):10476—10484.
[ 99 ] Tian L,Shi Z,Lu Y,et al. Kinetics of cation and oxyanion adsorption and desorption on ferrihydrite:Roles of ferrihydrite binding sites and a unified model[J]. Environmental Science & Technology,2017,51:10605—10614.
[ 100 ]Tian L,Liang Y,Lu Y,et al. Pb(II)and Cu(II)adsorption and desorption kinetics on ferrihydrite with different morphologies[J]. Soil Science Society of America Journal,2018,82(1):96.
[ 101 ]Feng X,Wang P,Shi Z,et al. A quantitative model for the coupled kinetics of arsenic adsorption/desorption and oxidation on manganese oxides[J]. Environmental Science & Technology Letters,2018,5(3):175—180.
[ 102 ]Lin J,Hu S,Liu T,et al. Coupled kinetics model for microbially mediated arsenic reduction and adsorption/ desorption on iron oxides:Role of arsenic desorption induced by microbes[J]. Environmental Science and Technology,2019,53(15):8892—8902.
[ 103 ]Rawson J,Prommer H,Siade A,et al. Numerical modeling of arsenic mobility during reductive iron-mineral transformations[J]. Environmental Science & Technology,2016,50(5):2459—2467.
[ 104 ]Shi Z,Peng S,Wang P,et al. Modeling coupled kinetics of antimony adsorption/desorption and oxidation on manganese oxides[J]. Environmental Science:Processes & Impacts,2018,20(12):1691—1696.
[ 105 ]Sun J,Prommer H,Siade A J,et al. Model-based analysis of arsenic immobilization via iron mineral transformation under advective flows[J]. Environmental Science & Technology,2018,52(16):9243—9253.
[ 106 ]Wu S,Fang G,Wang D,et al. Fate of As(III)and As(V)during microbial reduction of arsenic-bearing ferrihydrite facilitated by activated carbon[J]. ACS Earth and Space Chemistry,2018,2(9):878—887.
[ 107 ]Farrell J,Chaudhary B K. Understanding arsenate reaction kinetics with ferric hydroxides[J]. Environmental Science & Technology,2013,47(15):8342—8347.
[ 108 ]Town R M,Duval J F L,Buffle J,et al. Chemodynamics of metal complexation by natural soft colloids:Cu(II)binding by humic acid[J]. The Journal of Physical Chemistry A,2012,116(25):6489—6496.
[ 109 ]Liu P,Wang P,Lu Y,et al. Modeling kinetics of heavy metal release from field-contaminated soils:Roles of soil adsorbents and binding sites[J]. Chemical Geology,2019,506:187—196.
[ 110 ]Peng L,Shi Z,Wang P,et al. A novel multi-reaction model for kinetics of Zn release from soils:Roles of soil binding sites[J]. Journal of Colloid and Interface Science,2018,514:146—155.
[ 111 ]Shi Z,Di Toro D M,Allen H E,et al. A general model for kinetics of heavy metal adsorption and desorption on soils[J]. Environmental Science & Technology,2013,47(8):3761.
[ 112 ]Zhou S,Wen J,Chen J,et al. Rapid measurement of microbial extracellular respiration ability using a high-throughput colorimetric assay[J]. Environmental Science & Technology Letters,2015,2(2):26—30.
[ 113 ]Yuan T,Yuan Y,Zhou S,et al. A rapid and simple electrochemical method for evaluating the electron transfer capacities of dissolved organic matter[J]. Journal of Soils and Sediments,2011,11(3):467—473.
[ 114 ]Yuan Y,Guo T,Qiu X,et al. Electrochemical surface plasmon resonance fiber-optic sensor:In situ detection of electroactive biofilms[J]. Analytical Chemistry,2016,88(15):7609—7616.
[ 115 ]Yuan Y,Zhao B,Zhou S,et al. Electrocatalytic activity of anodic biofilm responses to pH changes in microbial fuel cells[J]. Bioresource Technology,2011,102(13):6887—6891.
[ 116 ]Wu Y,Liu T,Li X,et al. Exogenous electron shuttle-mediated extracellular electron transfer of200:Electrochemical parameters and thermodynamics[J]. Environmental Science & Technology,2014,48(16):9306—9314.
[ 117 ]Wu Y,Li F,Liu T,et al. pH dependence of quinone-mediated extracellular electron transfer in a bioelectrochemical system[J]. Electrochimica Acta,2016,213:408—415.
[ 118 ]Liu T,Li X,Li F,et al. In situ spectral kinetics of Cr(VI)reduction by-type cytochromes in a suspension of living200[J]. Scientific Reports,2016,6:29592.
[ 119 ]Liu T,Wu Y,Li F,et al. Rapid redox processes of-type cytochromes in a living cell suspension ofMR-1[J]. ChemistrySelect,2017,2(3):1008—1012.
[ 120 ]Nge P N,Rogers C I,Woolley A T. Advances in microfluidic materials,functions,integration,and applications[J]. Chemical Reviews,2013,113(4):2550—2583.
[ 121 ]Scheidweiler D,Peter H,Pramateftaki P,et al. Unraveling the biophysical underpinnings to the success of multispecies biofilms in porous environments[J]. The ISME Journal,2019,13(7):1700—1710.
[ 122 ]Coyte K Z,Tabuteau H,Gaffney E A,et al. Microbial competition in porous environments can select against rapid biofilm growth[J]. Proceedings of the National Academy of Sciences,2017,114(2):E161—E170.
[ 123 ]Borer B,Tecon R,Or D. Spatial organization of bacterial populations in response to oxygen and carbon counter-gradients in pore networks[J]. Nature Communications,2018,9(1):1—11.
[ 124 ]Carski T H,Sparks D L. A modified miscible displacement technique for investigating adsorption-desorption kinetics in soils[J]. Soil Science Society of America Journal,1985,49(5):1114—1116.
[ 125 ]Yin Y,Allen H E,Huang C P,et al. Kinetics of mercury(II)adsorption and desorption on soil[J]. Environmental Science & Technology,1997,31(2):496—503.
[ 126 ]Lafferty B J,Ginder-Vogel M,Sparks D L. Arsenite oxidation by a poorly crystalline manganese-oxide 1. Stirred-flow experiments[J]. Environmental Science & Technology,2010,44(22):8460—8466.
[ 127 ]Shi Z,Di Toro D M,Allen H E,et al. Modeling kinetics of Cu and Zn release from soils[J]. Environmental Science & Technology,2005,39:4562—4568.
[ 128 ]Hu S,Lu Y,Peng L,et al. Coupled kinetics of ferrihydrite transformation and As(V)sequestration under the effect of humic acids:A mechanistic and quantitative study[J]. Environmental Science & Technology,2018,52(20):11632—11641.
[ 129 ]Li X,Qin F,Chen X,et al. Dissolution behavior of isolated and aggregated hematite particles revealed by in situ liquid cell transmission electron microscopy[J]. Environmental Science & Technology,2019,53(5):2416—2425.
[ 130 ]Newcomb C J,Qafoku N P,Grate J W,et al. Developing a molecular picture of soil organic matter–mineral interactions by quantifying organo-mineral binding[J]. Nature Communications,2017,8(1):396.
[ 131 ]Vogel C,Mueller C W,Hoschen C,et al. Submicron structures provide preferential spots for carbon and nitrogen sequestration in soils[J]. Nature Communications,2014,5:2947.
[ 132 ]Gao T,Ke S,Wang S J,et al. Contrasting Mg isotopic compositions between Fe-Mn nodules and surrounding soils:Accumulation of light Mg isotopes by Mg-depleted clay minerals and Fe oxides[J]. Geochimica et Cosmochimica Acta,2018,237:205—222.
[ 133 ]Xia Y,Gao T,Liu Y,et al. Zinc isotope revealing zinc’s sources and transport processes in karst region[J]. Science of the Total Environment,2020:138191.
[ 134 ]Manceau A,Tommaseo C,Rihs S,et al. Natural speciation of Mn,Ni,and Zn at the micrometer scale in a clayey paddy soil using x-ray fluorescence,absorption,and diffraction[J]. Geochimica et Cosmochimica Acta,2005,69(16):4007—4034.
[ 135 ]Xiong J,Koopal L K,Tan W,et al. Lead binding to soil fulvic and humic acids:Nica-donnan modeling and XAFS spectroscopy[J]. Environmental Science & Technology,2013,47(20):11634—11642.
[ 136 ]Yin H,Tan W,Zheng L,et al. Characterization of Ni-rich hexagonal birnessite and its geochemical effects on aqueous Pb2+/Zn2+and As(III)[J]. Geochimica et Cosmochimica Acta,2012,93:47—62.
[ 137 ]Chen H,Tan W,Lv W,et al. Molecular mechanisms of lead binding to ferrihydrite-bacteria composites:ITC,XAFS and μ-XRF investigations[J]. Environmental Science & Technology,2020,doi:10.1021/acs.est. 9b06288.
[ 138 ]Ginder-Vogel M,Landrot G,Fischel J S,et al. Quantification of rapid environmental redox processes with quick-scanning X-ray absorption spectroscopy(Q-XAS)[J]. Proceedings of the National Academy of Sciences,2009,106(38):16124—16128.
[ 139 ]Lan S,Ying H,Wang X,et al. Efficient catalytic As(III)oxidation on the surface of ferrihydrite in the presence of aqueous Mn(II)[J]. Water Research,2018,128:92—101.
[ 140 ]Yang J,Hatcherian J,Hackley P C,et al. Nanoscale geochemical and geomechanical characterization of organic matter in shale[J]. Nature Communications,2017,8(1):1—9.
[ 141 ]Ling L,Zhang W X. Enrichment and encapsulation of uranium with iron nanoparticle[J]. Journal of the American Chemical Society,2015,137(8):2788—2791.
[ 142 ]Wu J,Buseck P R. Carbon storage at defect sites in mantle mineral analogues[J]. Nature Geoscience,2013,6(10):875—878.
[ 143 ]Hu S,Liang Y,Liu T,et al. Kinetics of As(V)and carbon sequestration during Fe(II)-induced transformation of ferrihydrite-As(V)-fulvic acid coprecipitates[J]. Geochimica et Cosmochimica Acta,2020,272:160—176.
[ 144 ]Lu Y,Hu S,Wang Z,et al. Ferrihydrite transformation under the impact of humic acid and Pb:Kinetics,nanoscale mechanisms,and implications for C and Pb dynamics[J]. Environmental Science:Nano,2019,6(3):747—762.
[ 145 ]Lv J,Zhang S,Wang S,et al. Molecular-scale investigation with ESI-FT-ICR-MS on fractionation of dissolved organic matter induced by adsorption on iron oxyhydroxides[J]. Environmental Science & Technology,2016,50(5):2328—2336.
[ 146 ]Riedel T,Zak D,Biester H,et al. Iron traps terrestrially derived dissolved organic matter at redox interfaces[J]. Proceedings of the National Academy of Sciences,2013,110(25):10101—10105.
[ 147 ]Ohno T,Parr T B,Gruselle M C I,et al. Molecular composition and biodegradability of soil organic matter:A case study comparing two new England forest types[J]. Environmental Science & Technology,2014,48(13):7229—7236.
[ 148 ]Ding Y,Shi Z,Ye Q,et al. Chemodiversity of soil dissolved organic matter[J]. Environmental Science & Technology,2020,doi:10.1021/acs.est.0c01136.
[ 149 ]Li X M,Sun G X,Chen S C,et al. Molecular chemodiversity of dissolved organic matter in paddy soils[J]. Environmental Science & Technology,2018,52(3):963—971.
[ 150 ]Chen H,Johnston R C,Mann B F,et al. Identification of mercury and dissolved organic matter complexes using ultrahigh resolution mass spectrometry[J]. Environmental Science & Technology Letters,2017,4(2):59—65.
[ 151 ]Ding Y,Lu Y,Liao P,et al. Molecular fractionation and sub-nanoscale distribution of dissolved organic matter on allophane[J]. Environmental Science:Nano,2019,6(7):2037—2048.
[ 152 ]Xu J M,He Y,Xu B L. Development and perspective of soil chemistry science in China[J]. Bulletin of Chinese Academy of Sciences,2015,30(Z1):91—105. [徐建明,何艳,许佰乐. 中国土壤化学发展现状与展望[J]. 中国科学院院刊,2015,30(Z1):91—105.]
The Frontier and Perspectives of Soil Chemistry in the New Era
LI Fangbai1, 2†, XU Renkou3, TAN Wenfeng4, ZHOU Shungui5, LIU Tongxu1, 2, SHI Zhenqing6, FANG Liping1, 2, LIU Chengshuai1, 2, LIU Fanghua1, 2, LI Xiaomin7, FENG Xionghan4, WU Yundang1, 2
(1. Guangdong Key Laboratory of Integrated Agro-environmental Pollution Control and Management, Guangdong Institute of Eco-environmental Science & Technology, Guangdong Academy of Sciences, Guangzhou 510650, China;2. National-Regional Joint Engineering Research Center for Soil Pollution Control and Remediation in South China, Guangzhou 510650, China; 3.State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China; 4. Key Laboratory of Arable Land Conservation (Middle and Lower Reaches of Yangtse River), Ministry of Agriculture and Rural Affairs of the People’s Republic of China, College of Resources and Environment, Huazhong Agricultural University, Wuhan 430070, China; 5. College of Resources and Environment, Fujian Agriculture and Forestry University, Fuzhou 350002, China; 6. Scholl of Environment and Energy, South China University of Technology, Guangzhou 510006, China; 7. Environmental Research Institute, South China Normal University, Guangzhou 510631, China)
Soil chemistry is an important and fundamental branch of soil science. On the basis of providing a historical overview of the progress of soil chemistry, this review exclusively summarized the most striking achievements in four innovative topics of soil chemistry and followed by analyzing the future research opportunities in soil chemistry with particularly emphasizing multidisciplinary coordination. The study of soil chemistry originated from observing the ability of soils to exchange ions and evolved to the direction of soil electrochemistry, rhizosphere/soil chemistry, interfacial processes of soil minerals, organic matters, and microorganisms that have been gradually led by China. Being the center of the community of this new era, China has particularly made an immense breakthrough in intercrossing soil chemistry with microbiology, geochemistry, mineralogy, and environmental chemistry. Moreover, the innovation of in-situ, real-time, and high-resolved analytical techniques including synchrotron radiation-based spectroscopy, microfluidic modulation spectroscopy, high-resolution microscopy, and spectroelectrochemistry, has remarkably advanced the progress of soil chemistry. There are three key aspects determining the destiny of soil chemistry in the coming decade: 1) explore the soil chemistry mechanism in the matter cycles and energy exchange in the Earth surface system, to achieve an original breakthrough from “0 to 1” in soil chemistry; 2) on the basis of the Earth surface theory, the exploration of the mechanisms of biogeochemical cycles and energy exchange in the complex system is likely by the coupling of multi-interfaces, elements, and processes, and a breakthrough toward originality in soil chemistry can be expected; 3) finally and also importantly, future research in soil chemistry should be built upon the national needs and priorities for constructing ecological civilization, battling for soil pollution and global change.
Soil chemistry; Plant nutrition chemistry; Bioelectrochemistry; Reaction kinetics; Interfacial reaction; Soil mineral
S153
A
10.11766/trxb202003300103
李芳柏,徐仁扣,谭文峰,周顺桂,刘同旭,石振清,方利平,刘承帅,刘芳华,李晓敏,冯雄汉,吴云当. 新时代土壤化学前沿进展与展望[J]. 土壤学报,2020,57(5):1088–1104.
LI Fangbai,XU Renkou,TAN Wenfeng,ZHOU Shungui,LIU Tongxu,SHI Zhenqing,FANG Liping,LIU Chengshuai,LIU Fanghua,LI Xiaomin,FENG Xionghan,WU Yundang. The Frontier and Perspectives of Soil Chemistry in the New Era [J]. Acta Pedologica Sinica,2020,57(5):1088–1104.
* 国际(地区)合作与交流项目(41420104007)Supported by the International(Regional)Joint Research Project(No. 41420104007)
,E-mail:cefbli@soil.gd.cn
李芳柏(1968—),男,湖南人,博士,研究员,主要从事环境土壤学研究。E-mail: cefbli@soil.gd.cn
2020–03–30;
2020–05–09;
网络首发日期(www.cnki.net):2020–06–03
(责任编辑:陈德明)

