碘对比剂静脉注射致皮肤不良反应的危险因素分析
李艳艳 程一帆 杨雅淋 方志娥 黄丹 李云逸 黄明春 钟丽娟 周新杰 王军大

摘 要 目的:探討碘对比剂静脉注射导致皮肤不良反应(ADR)的主要危险因素。方法:选取我院2009年1月至2020年4月使用碘对比剂行CT增强后发生皮肤ADR的患者,通过医院信息系统(HIS)收集其基本信息、应用碘对比剂前实验室检查结果及ADR相关信息。统计分析碘对比剂的使用情况、皮肤ADR的主要表现以及临床联合用药情况。以患者性别、年龄、体质量指数(BMI)、碘对比剂用量、住院时间、实验室检查、肿瘤病史、基础病史、过敏史、饮酒史等为自变量,将其分别与碘对比剂相关皮肤ADR发生情况进行单因素分析,选取有统计学意义变量进行多因素Logistic逐步回归分析。结果:发生皮肤ADR者共157例,男性79例(50.3%)、女性78例(49.7%);年龄19~86岁,平均(52.68±18.73)岁;BMI(14.6~40.7)kg/m2,平均(22.5±3.7)kg/m2;使用碘普罗胺67例(42.68%)、碘克沙醇34例(21.66%)、碘海醇31例(19.74%)、碘帕醇25例(15.92%);碘对比剂用量50~100 mL,平均(73.06±13.29)mL,4种碘对比剂间用量差异无统计学意义(P>0.05)。4种碘对比剂中,碘普罗胺相关皮肤ADR的发生率最高(0.197%)。碘对比剂相关皮肤ADR以急性(89.2%)为主,严重程度以轻度(75.2%)为主,以荨麻疹(38.9%)最常见,予以对症治疗后痊愈135例、好转13例、未好转9例。发生碘对比剂相关皮肤ADR的患者中,以合并使用抗感染药物的发生率最高(33.1%);但导致重度皮肤ADR则以合并使用抗肿瘤药物为主。住院时间{11~20 d[OR=1.21,95%CI(1.07,1.20),P=0.042]、21~30 d[OR=1.39,95%CI(1.12,1.52),P=0.035]、31~40 d[OR=1.15,95%CI(1.03,1.37),P=0.008]、>40 d[OR=1.33,95%CI(1.28,1.53),P=0.003]}、呼吸循环系统肿瘤病史[OR=1.51,95%CI(1.35,1.61),P=0.037]、注射用药过敏史[OR=1.50,95%CI(1.37,1.59),P=0.005]均可显著增加碘对比剂相关皮肤ADR的发生率。结论:碘对比剂相关皮肤ADR主要表现为荨麻疹,患者的住院时间(≥10 d)、呼吸循环系统肿瘤病史、注射用药过敏史可能是碘对比剂致相关皮肤ADR的主要危险因素。
关键词 碘对比剂;皮肤不良反应;合理用药;Logistic回归分析;危险因素
中图分类号 R969.3 文献标志码 A 文章编号 1001-0408(2020)18-2252-07
DOI 10.6039/j.issn.1001-0408.2020.18.14
ABSTRACT OBJECTIVE: To investigate main risk factors for adverse drug reactions (ADR) of skin by intravenous injection of iodine contrast agent. METHODS: From Jan. 2009 to Apr. 2020, the patients suffering from skin ADR after enhanced CT with iodine contrast agent were collected from our hospital. The basic information, laboratory test results before using iodine contrast agent and ADR related information were collected through hospital information system (HIS). The use of iodine contrast agent, main manifestations of skin ADR and drug combination were analyzed statistically. Taking the sex, age, body mass index (BMI), the dosage of iodine contrast agent, length of stay, laboratory examination, tumor history, basic disease, allergy history, drinking history as independent variables, the incidence of skin ADR related to iodine contrast agent was analyzed by single factor analysis, and the variables with statistically significant were selected for multivariate Logistic stepwise regression analysis. RESULTS: There were 157 cases of skin ADR, involving 79 males (50.3%) and 78 females (49.7%). The age ranged from 19 to 86 years old, being (52.68±18.73) years old in average. BMI was 14.6-40.7 kg/m2, being (22.5±3.7) kg/m2. 67 cases (42.68%) were treated with iprodione, 34 cases (21.66%) with iodixanol, 31 cases (19.74%) with iohexol and 25 cases (15.92%) with iopamidol; the dose of iodine contrast agent were 50-100 mL, being(73.06±13.29)mL in average. There was no significant difference among different dosage of 4 kinds of iodine contrast agents (P≤0.05). Among 4 kinds of iodine contrast agents, the incidence of skin ADR induced by iopromide was the highest (0.197%). The skin ADR related to iodine contrast agent was mainly acute (89.2%), the severity was mild (75.2%), and urticaria (38.9%) was the most common. After symptomatic treatment, 135 cases were cured, 13 cases were improved and 9 cases were not improved. Among the patients with iodine contrast agent related skin ADR, the incidence of ADR induced by combined use of anti infective drugs was the highest (33.1%); however, the combined use of anti-tumor drugs was the main cause of severe skin ADR. The length of stay{11~20 d[OR=1.21,95%CI(1.07,1.20),P=0.042]、21~30 d[OR=1.39,95%CI(1.12,1.52),P=0.035]、31~40 d[OR=1.15,95%CI(1.03,1.37),P=0.008]、>40 d[OR=1.33,95%CI(1.28,1.53),P=0.003]},respitatory and circulatory system tumor history[OR=1.51,95%CI(1.35,1.61),P=0.037],injection allergy history[OR=1.50,95%CI(1.37,1.59),P=0.005] can significantly increase the incidence of iodine contrast agent related skin ADR. CONCLUSIONS: The main manifestation of skin ADR related to iodine contrast agent was urticaria. The main risk factors of skin ADR related to iodine contrast agent were length of stay (>10 d), respiratory and circulatory system tumor history and injection allergy history.
KEYWORDS Iodine contrast agent; Skin ADR; Rational drug use; Logistic regression analysis; Risk factors
随着计算机断层扫描(CT)、核磁共振成像(MRI)增强诊疗技术的不断发展,对比剂已广泛应用于临床诊疗活动中,但同时对比剂的相关药物不良反应(Adverse drug reactions,ADR)也日益增加[1-2]。对比剂是为了改变机体局部组织影像对比度而引入人体的物质,也称为造影剂;目前CT增强扫描使用的是碘对比剂,主要包括高渗对比剂、次高渗对比剂及等渗对比剂,广泛应用于临床各种疾病的鉴别与诊断。各种碘对比剂的渗透压、水溶性、蛋白结合力、亲脂性、钙及钠含量等理化性质均有可能引发ADR,因而其安全性受到越来越多学者的关注[3]。已有研究表明,临床上碘对比剂引发的相关ADR主要以皮肤ADR最为常见[4-5]。一般情况下,轻度皮肤ADR往往勿需作任何处理,但重度皮肤ADR(如嗜酸性粒细胞增多性皮炎及Stevens-Johnson综合征等)将会引起患者多系统症状甚至危及生命,临床上必须予以高度重视[6]。目前,国内鲜有文献报道碘对比剂致相关皮肤ADR情况。本研究团队通过分析重庆市中医院2009年1月至2020年4月157例患者使用碘对比剂后出现相关皮肤ADR的情况,探讨碘对比剂致相关皮肤ADR的独立危险因素,以期指导临床合理用药、减少该类ADR的发生。
1 资料来源与方法
1.1 资料来源及信息收集
2009年1月-2020年4月,我院主要使用的碘对比剂有4种,分别为碘普罗胺注射液(德国Bayer Vital GmbH公司)、碘克沙醇注射液(江苏恒瑞医药股份有限公司)、碘海醇注射液(北京北陆药业股份有限公司)、碘帕醇注射液(上海博莱科信谊药业有限责任公司)。基于图片存档及通信系统(PACS)系统查询我院该时段接受上述4类碘对比剂CT增强扫描检查的患者,以我院上报至国家药品不良反应监测系统的关于碘对比剂致相关皮肤ADR结果为依据,选取发生碘对比剂相关皮肤ADR的患者纳入分析。通过医院信息系統(HIS)查询纳入患者的相关资料,包括性别、年龄、体质量指数(BMI)、碘对比剂用量、实验室检查指标、住院时间、肿瘤病史、基础病史、过敏史、饮酒史等。患者使用碘对比剂后,由护士观察记录患者发生急性、晚发性及超晚发性皮肤ADR,其中急性ADR为注射后1 h以内发生的ADR,晚发性ADR为注射后1 h以上至1周以内发生的ADR,超晚发性ADR为注射后1周后发生的ADR[7]。根据《碘对比剂血管造影应用相关不良反应中国专家共识》,由两名高级职称医师对碘对比剂相关皮肤ADR的严重程度进行分级,包括轻度、中度和重度[7]。
1.2 统计学方法
采用SPSS 21.0软件对数据进行统计分析。计量资料以x±s表示;计数资料以例数或率表示,不同碘对比剂相关皮肤ADR发生率及碘对比剂用量比较采用χ 2检验,碘对比剂相关皮肤ADR不同发生时间比较采用Fisher检验;以患者的性别、年龄、BMI、碘对比剂用量、住院时间、实验室检查、肿瘤病史、基础病史、过敏史、饮酒史等为自变量,将其分别与碘对比剂相关皮肤ADR发生情况进行单因素分析,选取有统计学意义的变量带入Logistic逐步回归方程,分析碘对比剂致皮肤ADR发生的危险因素。P<0.05表示差异有统计学意义。
2 结果
2.1 患者一般情况
接受碘对比剂CT增强扫描检查的患者共136 879例,其中发生碘对比剂相关皮肤ADR的157例,总发生率为0.115%。157例患者中,男性79例(50.3%)、女性78例(49.7%);年龄19~86岁,平均年龄(52.68±18.73)岁;BMI为14.6~40.7 kg/m2,平均值为(22.5±3.7)kg/m2;住院天数为3~43 d(≤10 d的25例、11~20 d的65例、21~30 d的40例、31~40 d的0例、>40 d的27例);有肿瘤病史的31例(神经系统肿瘤4例、呼吸循环系统肿瘤14例、消化系统肿瘤6例、泌尿生殖系统肿瘤7例);有基础病史的34例(高血压病史14例、冠心病史9例、糖尿病史11例);有过敏史的21例(中药过敏4例、中成药过敏3例、化学药过敏6例、注射用药过敏8例);有饮酒史的12例。157例患者均有临床合并用药,具体用药情况为:抗感染用药52例,心血管系统疾病用药23例,消化系统疾病用药18例,呼吸系统疾病用药15例,肿瘤用药31例,解热镇痛药6例,中药及其制剂12例。
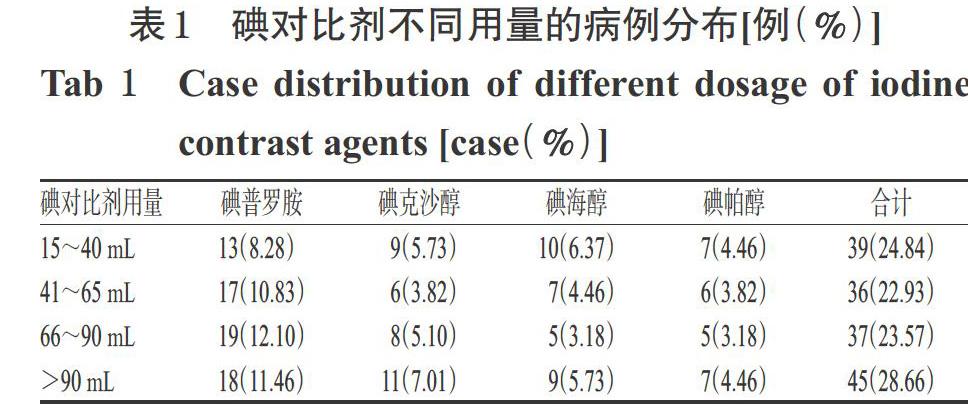
2.2 患者碘对比剂的用量
患者4种碘对比剂的用量为15~100 mL,平均值为(73.06±13.29)mL。碘对比剂不同用量的病例分布比较,差异无统计学意义(χ2=-1.026,P=0.379),详见表1。
2.3 碘对比剂相关皮肤ADR的发生情况
4种碘对比剂相关皮肤ADR的发生率各异,其中碘普罗胺相关皮肤ADR的发生率最高,发生率为0.197%;碘帕醇相关皮肤ADR的发生率最低,发生率为0.074%,详见表2。
2.4 碘对比剂相关皮肤ADR的发生时间及表现
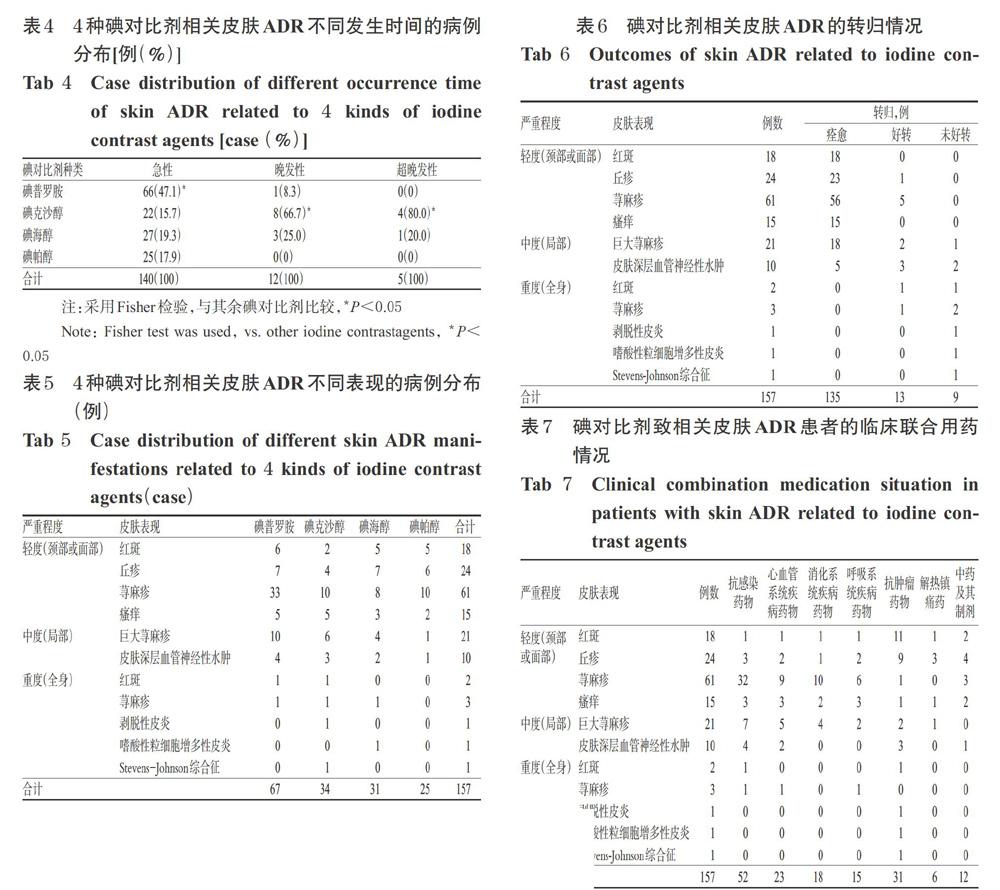
碘对比剂相关皮肤ADR主要以急性为主(89.2%),其中最早发生时间为注射后3 min,最晚发生时间为注射后32 min,中位发生时间为12.5 min。皮肤ADR严重程度以轻度为主,共118例,占总发生人数的75.2%;发生重度皮肤ADR的患者有8例 ,其中1例为急性、2例为晚发性、5例为超晚发性。皮肤ADR的表现以荨麻疹最常见,共61例,占总发生人数的38.9%,详见表3。
157例患者中,发生急性皮肤ADR的患者有140例,其中使用碘普罗胺的患者最多,与使用其他3种碘对比剂患者比较差异有统计学意义(P均<0.05),而使用其余3种碘对比剂致急性皮肤ADR发生的差异无统计学意义(P均>0.05)。发生晚发性皮肤ADR的患者有12例,其中未见使用碘帕醇的患者,而使用碘克沙醇的患者最多,其与使用其余3种碘对比剂致晚发性皮肤ADR发生的差异有统计学意义(P均<0.05),使用碘海醇与使用碘普罗胺、碘帕醇比较差异也有统计学意义(P均<0.05)。使用碘克沙醇、碘海醇的患者中分别有4、1例发生了超晚发性皮肤ADR,使用其余2种碘对比剂的患者均未见超晚发性皮肤ADR发生,使用碘克沙醇与使用其余3种碘对比剂致超晚发性皮肤ADR发生差异有统计学意义(P均<0.05),详见表4。
4种碘对比剂相关皮肤ADR的严重程度以轻度发生率最高(75.2%),其中以碘普罗胺发生荨麻疹为主。除了碘帕醇外,其余3种碘对比剂均引发了重度皮肤ADR,其中1例患者使用碘克沙醇发生了嗜酸性粒细胞增多性皮炎,另1例患者使用碘海醇后发生了Stevens- Johnson综合征,详见表5。
2.5 碘对比剂相关皮肤ADR的转归
118例发生轻度皮肤ADR的患者中,112例痊愈、6例好转;31例发生中度皮肤ADR的患者中,23例痊愈、5例好转、3例未好转;8例发生重度皮肤ADR的患者中,2例好转、6例未好转,详见表6。
2.6 碘对比剂相关皮肤ADR与临床联合用药情况分析
发生碘对比剂相关皮肤ADR的患者以联合使用抗感染药物为主(33.1%);但发生重度皮肤ADR的患者则以联合使用抗肿瘤药物为主,其中发生嗜酸性粒细胞增多性皮炎及Stevens-Johnson综合征者均联合使用了抗肿瘤药物,详见表7。
2.7 碘对比剂相关皮肤ADR的独立危险因素
将临床上可能引起碘对比剂相关皮肤ADR的危险因素(性别、年龄、BMI、碘对比剂用量、住院时间、实验室检查指标、肿瘤病史、基础病史、过敏史、饮酒史)纳入Logistic回归方程进行全模型分析,结果见表8。将全模型Logistic回归分析中P<0.05的变量(住院时间、肿瘤病史、过敏史)再进行Logistic逐步回归分析,结果见表9。由表9显示,住院时间、肿瘤病史、过敏史是碘对比剂相关皮肤ADR的独立危险因素,即住院时间越长,越易引起碘对比剂相关皮肤ADR的发生;呼吸循环系统肿瘤较其他系统肿瘤更易发生碘对比剂相关皮肤ADR;而对于过敏史而言,对注射用药过敏的患者更易发生碘对比剂相关皮肤ADR。
3 讨论
3.1 碘对比剂种类、用量与皮肤ADR的关系
3.1.1 种类 本研究显示,碘普罗胺导致皮肤ADR发生率最高为0.197%;碘帕醇导致皮肤ADR发生率最低,为0.074%;碘克沙醇导致皮肤ADR发生率略高于碘海醇。而重度皮肤ADR以碘普罗胺和碘克沙醇发生率最高。这提示臨床应根据患者不同情况选择不同种类的碘对比剂。
3.1.2 剂量 本研究中碘对比剂使用剂量为15~100 mL,平均值为(73.06±13.29)mL,4种碘对比剂不同用量的病例分布差异无统计学意义,说明碘对比剂用量与皮肤ADR无关;Logistic回归分析也未显示碘对比剂用量为皮肤ADR的危险因素。但临床需注意,尤其是对于肾功能不全患者,碘对比剂使用剂量仍是需要考虑的重要因素,对于慢性肾病患者,可根据患者的内生肌酐清除率来选择对比剂的用量及不同水化方式,以减轻对肾功能的损伤[8-9]。
3.2 碘对比剂相关皮肤ADR发生情况
3.2.1 皮肤ADR发生率 本研究中,碘对比剂相关皮肤ADR发生率为0.115%(157/136 879),低于其他大型碘对比剂ADR研究(0.6%~3.13%)[10-12],其原因可能是本研究主要关注的是碘对比剂所致相关皮肤ADR,而大部分研究是以多系统ADR为主。
3.2.2 皮肤过敏反应 既往研究均表明,碘对比剂相关单系统不良反应以皮肤及附件发生率最高,均为碘对比剂过敏反应[3-4]。本研究进一步分析了皮肤ADR的发生情况,结果表明,发生皮肤ADR以急性、轻度为主,但有5例超晚发性皮肤ADR,8例发生重度皮肤ADR。轻度皮肤ADR表现为颈部或面部的红斑、丘疹、荨麻疹及瘙痒,中度皮肤ADR表现为局部巨大荨麻疹及皮肤深层血管神经性水肿,上述轻、中度皮肤表现经过密切观察或静脉注射地塞米松后大部分患者均可好转或痊愈(仅3例中度皮肤ADR患者出院时未好转),其发生机制目前仍未完全明确,可能与循环系统中嗜碱性粒细胞和嗜酸性粒细胞释放的组胺有关,但其释放的机制及途径尚不清楚[13]。本研究中5例超晚性皮肤ADR均表现为重度皮肤ADR,其中1例患者发生嗜酸性粒细胞增多性皮炎,主要表现为全身弥散性红斑及丘疹伴脱屑,并伴有皮肤重度瘙痒,皮肤多处可见抓痕;另1例患者发生Stevens-Johnson综合征,主要表现为躯干成片的红疹、丘疹,四肢见靶样皮损,少量皮肤可见脱屑,皮肤触痛明显,经静脉注射地塞米松、非那根等积极的抗过敏治疗后,效果不佳,其原因可能是该患者为肿瘤患者,同时在使用相关抗肿瘤药物,碘对比剂与抗肿瘤药物联用诱发了重症药疹。
3.3 碘对比剂相关皮肤ADR患者的临床联合用药情况
本研究发现使用碘对比剂患者合并抗感染药物致皮肤ADR发生率最高,主要以抗菌药物为主,其中2例患者发生了重度皮肤ADR,其原因可能是抗菌药物易聚合成抗原,与体内抗体相结合后导致组胺等物质释放,从而导致皮肤ADR的发生[6]。重度皮肤ADR则以合并抗肿瘤药物为主。郑瑜等[14]研究发现,细胞毒性药物如紫杉醇、多西他赛、依托泊苷等,以及分子靶向药物如利妥昔单抗等均易发生皮肤ADR。不同种类的抗肿瘤药物所致皮肤ADR原因不同,如血管内皮生长因子(VEGF)抑制剂干扰了血小板衍生生长因子受体和酪氨酸激酶,从而导致皮肤ADR;而表皮因子受体抑制剂则是改变了角质形成细胞的分化,从而导致四肢末端皮肤皲裂和疼痛[15]。合并心血管系统、消化系统、呼吸系统疾病药物和解热镇痛药、中药及其制剂也可能发生了皮肤ADR,但均以轻度皮肤ADR为主。
3.4 危险因素分析
3.4.1 住院时间 Logistic回归分析显示,住院时间(≥10 d)与皮肤ADR显著相关(P<0.05),并且住院时间越长越容易诱发皮肤ADR,其原因可能是当患者发生重度皮肤ADR时,也会伴发其他系统ADR,从而导致住院时间延长,但笔者尚不能确定二者间是否存在因果关系。
3.4.2 肿瘤病史 目前,大部分肿瘤患者在诊疗过程中都会多次使用碘对比剂,本研究经Logistic回归分析显示,肿瘤病史与皮肤ADR相关,且呼吸循环系统肿瘤为皮肤ADR的独立危险因素[OR=1.51,95%CI(1.35,1.61),P=0.037],笔者认为其原因可能是呼吸循环系统肿瘤导致患者循环降低,增加了皮肤ADR发生率。樊庆利等[16]研究发现,肿瘤患者发生碘对比剂相关ADR主要累及皮肤系统(75%),原发肿瘤是皮肤ADR的独立危险因素,这可能是由于肿瘤患者治疗过程中使用了抗肿瘤药物,并且肿瘤患者免疫力低下,需长期服用增强免疫力药物,从而导致自身处于高敏状态,使皮肤ADR发生率增高。
3.4.3 过敏史 本研究显示,对注射用药过敏与皮肤ADR存在显著相关[OR=1.50,95%CI(1.37,1.59),P=0.005],这与大部分研究结果相符,Kim TH等[17]研究发现,既往碘对比剂过敏史、药物过敏史及有多种过敏源病史的患者是碘对比剂相关ADR的危险因素;Kobayashi D等[18]研究认为,荨麻疹是碘对比剂相关ADR相关性最高的危险因素。因此在使用碘对比剂之前,应着重询问患者是否存在相关过敏史,对于碘对比剂相关ADR高危人群可适当进行碘对比剂CT增强前的干预,如静脉注射马来酸氯苯那敏注射液,可一定程度上降低ADR的发生率[19-21]。亦有静脉注射药物减少对比剂ADR反应模式的研究指出,静脉注射氢化可的松琥珀酸钠及盐酸异丙嗪治疗能有效减少单相反应,注射肾上腺素能有效减少双相及持续性反应[22]。
4 结语
综上所述,碘对比剂相关皮肤ADR以急性为主,且大多较轻,其主要表现为荨麻疹;患者的住院时间(≥10 d)、呼吸循环系统肿瘤病史、注射用药过敏史可能是碘对比剂致相关皮肤ADR的主要危险因素。发生皮肤ADR后,大部分患者预后良好,但仍有少部分患者预后不佳,尤其是当发生重症药疹时,如本研究中出现了1例Stevens-Johnson综合征患者,这是药疹中的严重类型,常引起全身多系统损伤且病死率高[23]。因此,临床在使用碘对比剂时应重点询问患者既往病史,尤其是相关过敏史,评估其使用碘对比剂的风险,是否需要进行增强前干预,以减少该类ADR的发生。但本研究样本量有限,仅对碘对比剂引起的皮肤ADR进行了单系统的观察,对于皮肤ADR与其它系统的相关ADR还有待进一步研究。
参考文献
[ 1 ] FHLING M,SEELIGER E,PATZAK A,et al. Understanding and preventing contrast-induced acute kidney injury[J].Nat Rev Nephrol,2017,13(3):169-180.
[ 2 ] 王军大,冷静,杨雅淋,等. 4种钆对比剂不良反应相关因素分析及处理方式[J].中国临床药理学与治疗学,2018,23(9):1056-1062.
[ 3 ] 王军大,冷静,李艳艳. 7种静脉注射碘对比剂的合理应用及其不良反应分析[J].中国医院药学杂志,2018,38(6):634-639.
[ 4 ] CHA MJ,KANG DY,LEE W,et al. Hypersensitivity reactions to iodinated contrast media:a multicenter study of 196 081 patients[J]. Radiology,2019,293(1):117-124.
[ 5 ] HAN S,YOON SH,LEE W,et al. Management of adverse reactions to iodinated contrast media for computed tomography in Korean referral hospitals:a survey investigation[J]. Korean J Radiol,2019,20(1):148-157.
[ 6 ] 莫小俊. 2 117例藥源性皮肤附件损害不良反应报告分析[J].中国合理用药探索,2017,14(4):59-61、74.
[ 7 ] 陈韵岱,王海昌,万征,等.碘对比剂血管造影应用相关不良反应中国专家共识[J].中国介入心脏病学杂志,2014,22(6):341-348.
[ 8 ] LEE HC,CHUANG KI,LU CF,et al. Use of contrast medium volume to guide prophylactic hydration to prevent acute kidney injury after contrast administration:a meta-analysis[J]. Am J Roentgenol,2020,215(1):15-24.
[ 9 ] 王军大,李艳艳.中医药在对比剂肾病防治中的研究进展[J].中国医院用药评价与分析,2020,20(1):122-124、128.
[10] PARK HJ,SON JH,KIM TB,et al. Relationship between lower dose and injection speed of iodinated contrast material for CT and acute hypersensitivity reactions:an observational study[J]. Radiology,2019,293(3):565-572.
[11] LI X,LIU H,ZHAO L,et al. Clinical observation of adverse drug reactions to non-ionic iodinated contrast media in population with underlying diseases and risk factors[J].Br J Radiol,2017. DOI:10.1259/bjr.20160729.
[12] H?USSLER MD. Safety and patient comfort with iodixanol:a postmarketing surveillance study in 9 515 patients undergoing diagnostic CT examinations[J]. Acta Radiol,2010,51(8):924-933.
[13] JUNG KE,CHUNG J,PARK BC,et al. A clinical study of cutaneous adverse reactions to nonionic contrast media in Korea[J]. Ann Dermatol,2012,24(1):22-25.
[14] 郑瑜,朱志伟,郑志伟,等.某院抗肿瘤药物不良反应的影响因素分析[J].肿瘤药学,2016,6(5):393-397.
[15] 马印尼,夏汝山.抗肿瘤靶向药相关的皮肤不良反应[J].皮肤病与性病,2018,40(5):660-661.
[16] 樊庆利,杨微.肿瘤科碘造影剂不良反应的因素分析[J].中国合理用药探索,2019,16(11):4-6.
[17] KIM TH,YOON SH,LEE SY,et al. Biphasic and protracted anaphylaxis to iodinated contrast media[J]. Eur Radiol,2018,28(3):1242-1252.
[18] KOBAYASHI D,TAKAHASHI O,UEDA T,et al. Risk factors for adverse reactions from contrast agents for computed tomography[J]. BMC Med Inform Decis Mak,2013,13(8):27-32.
[19] CHA MJ,LEE W. Change of culprit agent prevents recurrent hypersensitivity reactions to iodinated contrast media[J]. J Korean Med Assoc,2020,63(3):145-147.
[20] 郭振,王虎,牛丹丹,等.參附注射液防治冠状动脉介入术后对比剂急性肾损伤的临床疗效观察[J].中西医结合心脑血管病杂志,2019,17(3):160-162.
[21] 王军大.中医经典方剂五皮袋泡中药饮片水化法防治对比剂肾功能损害临床对照研究[C].//中国中西医结合学会医学影像专业委员会第15次全国学术大会暨上海市中西医结合学会医学影像专业委员会2017年学术年会暨《医学影像新技术的临床应用》国家级继续教育学习班资料汇编,北京:中国中西医结合学会内分泌专业委员会,2017:471-472.
[22] 李艳艳,单雪峰,王军大.对比剂不良反应模式分析[J].中国医院用药评价与分析,2019,19(8):1000-1004.
[23] FREY N,JOSSI J,BODMER M,et al. The epidemiology of Stevens-Johnson syndrome and toxic epidermal necrolysis in the UK[J]. J Invest Dermatol,2017,137(6):1240-1247.
(收稿日期:2020-05-22 修回日期:2020-08-05)
(编辑:邹丽娟)

