Box-Behnken响应面法优化女贞子总三萜纯化工艺
高爽 王玉真 薄福民 张丽 孙越 杨山景 封安杰 李凌军

摘 要 目的:提高女貞子总三萜中齐墩果酸和熊果酸的转移率和纯度,优化该类成分的纯化工艺。方法:以齐墩果酸和熊果酸作为女贞子药材中总三萜类代表成分,采用高效液相色谱法测定两者含量。色谱柱为Thermo BDS Hypersil C18,流动相为甲醇-0.02%乙酸铵溶液(80 ∶ 20,V/V),检测波长为210 nm,柱温为30 ℃,流速为1.0 mL/min,进样量为20 μL。采用单因素试验,以齐墩果酸、熊果酸的转移率为指标,考察工艺中的水沉温度、水沉时间和复溶乙醇用量对纯化工艺的影响;以两种成分的转移率和纯度为指标,考察活性炭用量、析晶乙醇体积分数对纯化工艺的影响。在此基础上,以复溶乙醇用量、活性炭用量、析晶乙醇体积分数为因素,采用Box-Behnken响应面法进一步优化该纯化工艺并验证。结果:最佳纯化工艺为女贞子药材提取浓缩液加4倍量(mL/g,下同)水,在0 ℃静置2 h(水沉);然后加入药材1倍量的乙醇溶解(复溶);再加入4%的活性炭(除杂);最后加水调整乙醇体积分数为80%,在4 ℃下静置12 h(析晶),离心,干燥。3次验证试验结果显示,采用该优选纯化工艺所制得的总三萜中齐墩果酸、熊果酸的转移率分别为61.11%、65.78%,纯度分别为53.44%、19.79%,RSD均小于3%。结论:优化所得纯化工艺提取效率高、操作简便,可用于女贞子总三萜类成分纯化的工业化生产以及相关制剂的开发。
关键词 女贞子;总三萜;齐墩果酸;熊果酸;纯化工艺
中图分类号 R282;R284.2 文献标志码 A 文章编号 1001-0408(2020)18-2196-06
DOI 10.6039/j.issn.1001-0408.2020.18.04
ABSTRACT OBJECTIVE: To improve the transfer rate and purity of oleanolic acid and ursolic acid in total triterpenoids from Ligustrum lucidum, so as to optimize the purification technology. METHODS: Oleanolic acid and ursolic acid were used as representative components of total triterpenoids, and their contents were determined by HPLC. The determination was performed on Thermo BDS Hypersil C18 column with mobile phase consisted of methanol-0.02% ammonium acetate solution (80 ∶ 20,V/V) at the flow rate of 1.0 mL/min. The detection wavelength was set at 210 nm, and column temperature was 30 ℃. The sample size was 20 μL. In single factor tests, using transfer rate of oleanolic acid and ursolic acid as index, the effects of water precipitation temperature and time, the amount of redissolved ethanol on the purification technology was investigated; using transfer rate and purity of two components as indexes, the effects of the amount of activated carbon and volume fraction of crystallization ethanol were investigated. Based on it, using the amount of redissolved ethanol and activated carbon, volume fraction of crystallization ethanol as factors, Box-Behnken response surface methodology was used to optimize the purification technology, and validation tests were performed. RESULTS: The optimal purification technology was adding 4-fold (mL/g, the same below) water in L. lucidum concentrated solution, placing for 2 hours at 0 ℃ (water precipitation); adding 1-fold ethanol to dissolve (redissolution); adding 4% activated carbon (edulcoration); finally adding water to adjust the volume fraction of ethanol to 80%, placing at 4 ℃ for 12 hours (crystallization), centrifuging and drying. The results of 3 times of validation tests showed that the transfer rates of oleanolic acid and ursolic acid in total triterpenoids prepared by optimized technology were 61.11% and 65.78%, the purities of them were 53.44% and 19.79%, and RSDs were both lower than 3%. CONCLUSIONS: The optimized purification technology has high extraction efficiency and simple operation, which can be used for industrial production of purification of total triterpenoids from L. lucidum and the development of corresponding preparations.
KEYWORDS Ligustrum lucidum; Total triterpenoids; Oleanolic acid; Ursolic acid; Purification technology
围绝经期是女性必经的生理过程,在此阶段出现的如月经紊乱、心血管系统与代谢异常、泌尿生殖综合征以及骨质疏松等症状称为围绝经综合征(MPS)[1-2]。女贞子是木犀科植物女贞[Ligustrum lucidum Ait.]的干燥成熟果实,其药用历史悠久,具有补气疏肝、滋补肝肾的功效,可解虚汗、烦热骨蒸等症,近年来在治疗MPS及其并发症等方面的作用受到了广泛关注[3-5]。目前从女贞子中分离到的化合物主要有三萜类、环烯醚萜类、苯乙醇类以及黄酮类等成分[6],其中女贞子总三萜的有效成分主要为齐墩果酸,而齐墩果酸和熊果酸互为异构体(化学结构式见图1),通过溶剂法很难将两者分离,故两者常同时作为女贞子总三萜的代表成分[7];而且,两种成分均具有广泛的生物活性,如抗糖尿病[8]、抗肿瘤[9]、保肝[10]及抗骨质疏松[11]等。基于此,本研究在前期女贞子提取工艺研究的基础上,以齐墩果酸和熊果酸作为女贞子总三萜的主要指标成分,以两者的纯度和转移率为考察指标,通过单因素试验和Box-Behnken响应面法,筛选女贞子总三萜的最佳纯化工艺,为MPS治疗新药贞芍醇苷胶囊的研制和开发奠定基础。
1 材料
1.1 仪器
1260型高效液相色谱仪(美国Agilent公司);KDM型电热套(山东鄄城华鲁电热仪器有限公司);DLSB-ZC型低温循环真空泵(郑州长城科工贸有限公司);E-6000型旋转蒸发器(上海亚荣生化仪器厂);TDL-5-A型离心机(上海安亭科学仪器厂);DZF-6051型真空干燥箱(上海精宏试验设备有限公司);Free Zone型冷冻干燥机(美国Labconco公司);BS110S型分析天平(北京赛多利斯天平有限公司);New Classic MC型十万分之一电子天平(瑞士Mettler Toledo公司)。
1.2 药品与试剂
齐墩果酸对照品(批号:110709-201607,纯度:91.7%)、熊果酸对照品(批号:110742-201622,纯度:94.7%)均购自中国食品药品检定研究院;甲醇、乙酸铵、异丙醇为色谱纯,乙醇、活性炭等其余试剂均为分析纯,水为超纯水(山东中医药大学自制)。
女贞子药材(批号:20170601)购自安徽九合堂国药有限公司,经山东中医药大学药学院李峰教授鉴定为木犀科植物女贞[L. lucidum Ait.]的干燥成熟果实,按照2015年版《中国药典》(一部)“女贞子”项下要求检查,结果均符合规定[12]。
2 样品溶液的制备
2.1 对照品贮备液
精密称取齐墩果酸对照品11.26 mg,置于25 mL量瓶中,加甲醇溶解并定容,制成质量浓度为0.413 0 mg/mL的齊墩果酸对照品贮备液;精密称取熊果酸对照品11.40 mg,置于50 mL量瓶中,加甲醇溶解并定容,制成质量浓度为0.215 9 mg/mL的熊果酸对照品贮备液。
2.2 女贞子药材提取浓缩液
根据本课题组前期研究的提取工艺[13],称取女贞子药材适量,分别加入8、6、4倍量(按mL/g计,下同)的60%乙醇,加热回流提取3次,每次提取3 h;合并提取液,减压浓缩至1 g/mL(以原药材量计),即得。
2.3 总三萜纯化工艺供试品溶液
精密称取纯化工艺相应步骤所得干燥沉淀物10.00 mg,置于25 mL量瓶中,加甲醇溶解并定容,摇匀,滤过,取续滤液,即得。
3 齐墩果酸和熊果酸含量测定方法的建立
3.1 色谱条件及系统适用性考察
色谱柱:Thermo BDS Hypersil C18(250 mm×4.6 mm,5 μm);流动相:甲醇-0.02%乙酸铵溶液(80 ∶ 20,V/V);检测波长:210 nm;柱温:30 ℃;流速:1.0 mL/min;进样量:20 μL。取齐墩果酸、熊果酸对照品溶液(“2.1”项下对照品贮备液以甲醇适度稀释)和供试品溶液,以甲醇为空白溶剂,进样分析,记录色谱图。结果,齐墩果酸、熊果酸理论板数均大于10 000,分离度均大于1.5,空白溶剂不干扰测定。色谱图见图2(空白溶剂图略)。
3.2 方法学考察
3.2.1 线性关系考察 精密吸取“2.1”项下齐墩果酸、熊果酸对照品贮备液适量,分别加甲醇稀释,制备齐墩果酸质量浓度分别为0.413 0、0.330 4、0.247 8、0.165 2、0.082 60、0.020 65 mg/mL,熊果酸质量浓度分别为0.215 9、0.172 7、0.129 5、0.086 36、0.043 18、0.010 80 mg/mL的系列对照品溶液。取上述对照品溶液,按“3.1”项下色谱条件进样测定,记录峰面积。分别以对照品溶液质量浓度为横坐标(X,mg/mL)、峰面积为纵坐标(Y)进行回归分析,结果得齐墩果酸回归方程为Y=9 456.7X+28.773(R 2=0.999 0)、熊果酸回归方程为Y=9 744.9X+41.257(R 2=0.999 3),表明齐墩果酸、熊果酸分别在0.020 65~0.413 0、0.010 80~0.215 9 mg/mL质量浓度范围内与峰面积呈良好的线性关系。
3.2.2 精密度试验 精密量取“2.1”项下齐墩果酸、熊果酸对照品贮备液,分别加甲醇稀释至0.247 8、0.129 5 mg/mL,再分别按“3.1”项下色谱条件连续进样测定6次,记录峰面积。结果,齐墩果酸、熊果酸峰面积的RSD分别为0.26%、0.77%(n=6),表明仪器精密度良好。
3.2.3 稳定性试验 取“2.3”项下供试品溶液,在室温下放置0、2、4、6、8、12 h后,分别按“3.1”项下色谱条件进样测定,记录峰面积。结果,齐墩果酸、熊果酸峰面积的RSD分别为1.35%、2.20%(n=6),表明供试品溶液在室温下放置12 h内稳定性良好。
3.2.4 重复性试验 精密移取“2.3”项下供试品溶液6份,按“3.1”项下色谱条件测定,记录峰面积,并按标准曲线法计算齐墩果酸、熊果酸含量。结果,两者含量的RSD分别为1.17%、0.63%(n=6),表明该方法重复性良好。
3.2.5 加样回收试验 精密量取齐墩果酸、熊果酸质量浓度分别为3.102、1.623 mg/mL的供试品溶液适量,共12份,每6份为一组,各组溶液中分别精密加入质量浓度分别为3.100 mg/mL、1.621 mg/mL的齐墩果酸或熊果酸对照品溶液适量,按照“3.1”项下色谱条件进样测定并计算加样回收率。结果,齐墩果酸、熊果酸的平均回收率分别为100.24%、101.51%,RSD均为0.06%(n=6),表明该方法准确度良好。
4 单因素试验考察女贞子中三萜类成分纯化工艺的影响因素
本课题组通过前期工艺探索后发现,水沉可除去环烯醚萜苷等极性较大的成分,将沉淀用乙醇复溶后再加活性炭可除去色素等杂质,最后通过调整乙醇体积分数,可使齐墩果酸、熊果酸等三萜类成分析出。基于此,本研究以齐墩果酸和熊果酸转移率为指标,对工艺中的水沉温度、水沉时间及复溶乙醇用量进行单因素考察;以上述2种成分的转移率和纯度为指标,对工艺中的活性炭用量、析晶乙醇体积分数进行单因素考察。
4.1 水沉温度
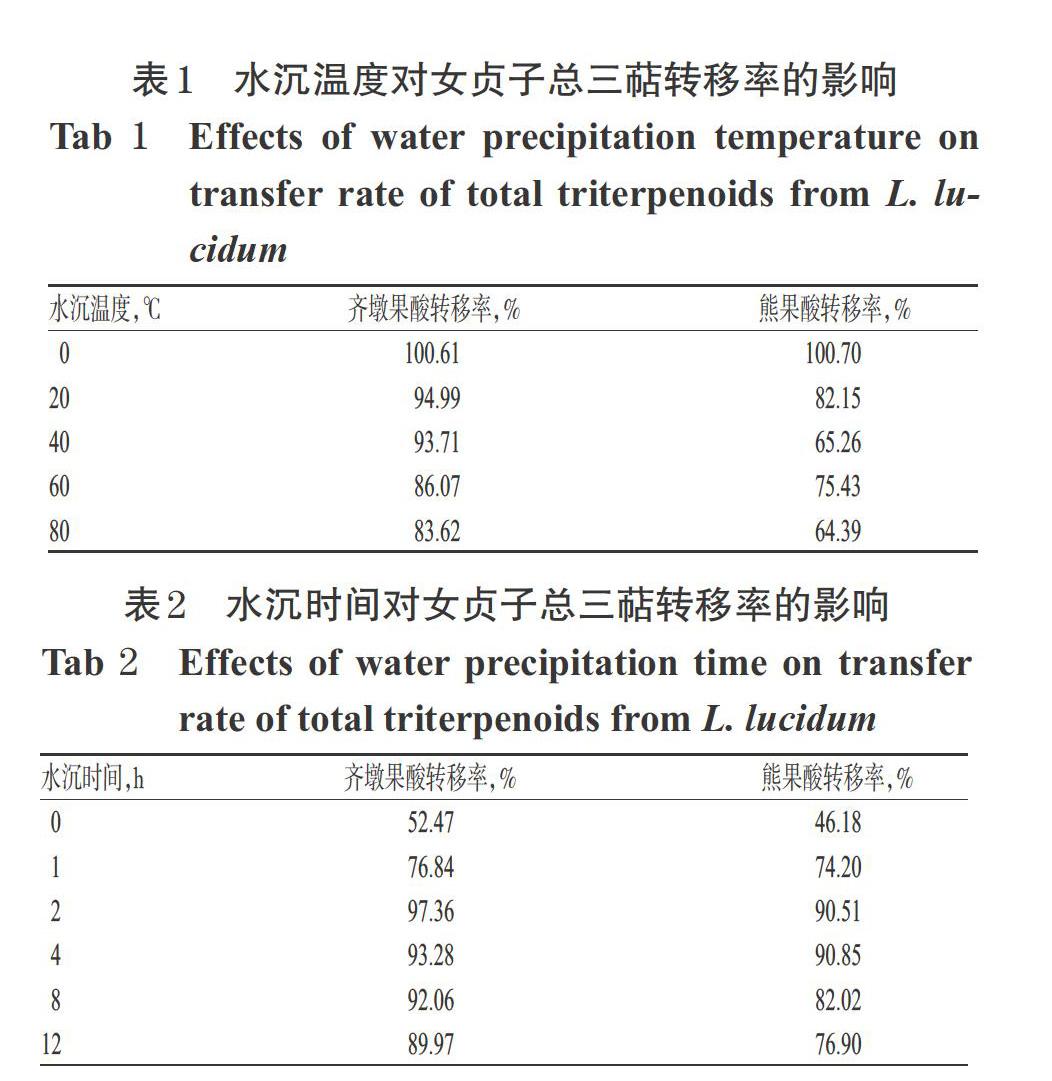
精密量取“2.2”项下女贞子药材提取浓缩液5份,每份50 mL,加4倍量水,加热至沸腾后,分别在80、60、40、20、0 ℃条件下静置2 h,以4 500 r/min离心5 min(以下同),取下层沉淀,冷冻干燥。精密称取所得干燥沉淀物10.00 mg,按“2.3”项下方法制备供试品溶液,再按“3”项下方法测定齐墩果酸和熊果酸的含量,并计算其转移率(转移率=待测成分测得量/待测成分加入量×100%),结果见表1。由表1可知,水沉温度越低,所得干燥沉淀物中齐墩果酸、熊果酸的转移率越高。水沉的目的是除去环烯醚萜苷等极性大的成分,需尽可能保证有效成分的转移率,故选择水沉温度0 ℃进行后续工艺优化。
4.2 水沉时间
精密量取“2.2”项下女贞子药材提取浓缩液6份,每份50 mL,加4倍量水,加热至沸腾后,分别在0 ℃条件下静置0、1、2、4、8、12 h,离心,取下层沉淀,冷冻干燥。精密称取所得干燥沉淀物10.00 mg,按“2.3”项下方法制备供试品溶液,再按“3”项下方法测定齐墩果酸和熊果酸的含量,并计算其转移率,结果见表2。由表2可知,当水沉时间超过2 h后,随着水沉时间的延长,所得干燥沉淀物中齐墩果酸、熊果酸的转移率未见明显增加,甚至有所降低,故考虑到时间成本和转移效率,选择水沉时间2 h进行后续工艺优化。
4.3 复溶乙醇用量
精密量取“2.2”项下女贞子药材提取浓缩液6份,每份50 mL,加4倍量水,加热至沸腾后,分别在0 ℃条件下静置2 h,离心,取下层沉淀,冷冻干燥。取干燥沉淀物,分别加入0.25、0.5、0.75、1.0、1.25、1.5倍量乙醇復溶(沉淀物均折算为原药材量后再计算相应复溶乙醇倍量,下同),加热回流0.5 h后,离心,取上清液,用乙醇定容至50 mL。精密量取该乙醇稀释溶液1.0 mL,加甲醇稀释至10 mL,再按“3”项下方法测定齐墩果酸和熊果酸的含量,并计算其转移率,结果见表3。由表3可知,当复溶乙醇用量为0.5倍量时,齐墩果酸和熊果酸的转移率明显高于乙醇用量为0.25倍量时的转移率;当以1.0倍量乙醇复溶后,齐墩果酸、熊果酸的转移率已达到较高水平,再继续增加乙醇用量,两种成分转移率未见明显提高,反而造成溶剂浪费,故选择复溶乙醇用量1.0倍量进行后续工艺优化。
4.4 活性炭用量
精密量取“2.2”项下女贞子药材提取浓缩液5份,每份50 mL,加4倍量水,加热至沸腾后,在0 ℃条件下静置2 h,离心,取下层沉淀,冷冻干燥。取干燥沉淀物,加1.0倍量乙醇复溶,加热回流0.5 h后,离心,取上清液,用乙醇定容至50 mL。在上述乙醇稀释溶液中分别加入0.5、1.0、1.5、2.0、2.5 g活性炭(相当于含活性炭1%、2%、3%、4%、5%),振摇10 min,抽滤,取滤液,用乙醇定容至50 mL。将该溶液蒸干,取干燥沉淀物,按“2.3”项下方法制备供试品溶液,再按“3”项下方法测定齐墩果酸和熊果酸的含量,并计算其转移率和纯度(纯度=待测成分质量/沉淀质量×100%),结果见表4。由表4可知,所得干燥沉淀物中齐墩果酸、熊果酸的转移率随活性炭用量增加而降低,但纯度随活性炭用量增加而升高。结合转移率和纯度计算综合评分(综合评分=x转移率/∑x转移率+ y纯度/∑y纯度),结果见表4。根据综合评分,选择活性炭用量4%进行后续工艺优化。
4.5 析晶乙醇体积分数
精密量取“2.2”项下女贞子药材提取浓缩液4份,每份50 mL,加4倍量水,加热至沸腾后,在0 ℃条件下静置2 h,离心,取下层沉淀,冷冻干燥。取干燥沉淀物,加入1.0倍量乙醇,加热回流0.5 h后,离心,取上清液,用乙醇定容至50 mL。在上述乙醇稀释溶液中加入4%的活性炭,振摇10 min,抽滤,取滤液,加乙醇定容至50 mL。在上述乙醇稀释溶液中分别加水调整乙醇体积分数至80%、60%、40%、20%,然后于4 ℃冷藏静置12 h析晶。取析晶后溶液,离心,取下层沉淀,冷冻干燥。精密称取该干燥沉淀物10.00 mg,按“2.3”项下方法制备供试品溶液,再按“3”项下方法测定齐墩果酸和熊果酸含量,并计算其转移率和纯度,结果见表5。在实际操作过程中笔者发现,以20%乙醇进行析晶,离心后沉淀与上清液未能较好分离,且提高离心转速或延长离心时间均无改善;以40%乙醇进行析晶效果略好,但离心后分离效果仍然较差,故乙醇体积分数过低不利于女贞子总三萜类成分的析出。由表5可知,以60%乙醇进行析晶时,虽然齐墩果酸和熊果酸的转移率稍高,但两者纯度均未达到50%;而以80%乙醇进行析晶时,虽齐墩果酸纯度达到50%,但两者转移率又过低。考虑到上述试验样本量小,操作过程中的损失比较大,后续可进行大样本试验来验证工艺是否合理,故选择乙醇体积分数80%进行后续工艺优化。
5 Box-Behnken响应面法优化女贞子总三萜类的纯化工艺
根据单因素考察结果可知,水沉温度0 ℃和水沉时间2 h在提高目标分转移率方面优势明显,故设为固定值,以齐墩果酸、熊果酸的纯度和转移率为考察指标,进一步对复溶乙醇用量(A,倍)、活性炭用量(B,%)、析晶乙醇体积分数(C,%)这3个因素进行优化。取“2.2”项下女贞子药材提取浓缩液17份,每份50 mL,按Box-Behnken响应面法设计试验。试验因素和水平见表6,试验设计和结果见表7,方差分析见表8。
根据上述拟合的二项式方程,采用Design-Expert 8.0.6软件分别绘制三维效应图,考察各自变量对女贞子总三萜纯化工艺的影响,结果见图3。由图3可知,因素A、C的交互作用对女贞子总三萜纯化工艺的影响较大,其次是因素B、C的交互作用,而因素A、B的交互作用影响最不显著。
运用Design-Expert 8.0.6软件优化所得女贞子总三萜纯化的最佳工艺参数为:1.22倍的乙醇用量、3.98%的活性炭、78.53%的乙醇体积分数;按此最佳纯化工艺制得的女贞子总三萜产物的综合评分为55.18。为后续方便工业大生产操作,将各参数分别取整,以乙醇用量1.0倍、活性炭4%、乙醇体积分数80%进行工艺验证。
6 女贞子总三萜最佳纯化工艺验证
根据上述优化工艺参数,精密量取“2.2”项下女贞子药材提取浓缩液3份,每份500 mL,加4倍量水,加热至沸腾后,在0 ℃下静置2 h,离心,取下层沉淀,冷冻干燥;干燥沉淀物中加入1.0倍量乙醇复溶,加热回流0.5 h后,离心,取上清液,以乙醇定容至500 mL;加入4%的活性炭除杂,振摇10 min,抽滤,滤液加乙醇定容至500 mL;加水调节乙醇体积分数为80%,4 ℃下冷藏静置12 h析晶;离心,取沉淀,冷凍干燥。取干燥产物,分别按“2.3”“3”项下方法制备供试品溶液、测定齐墩果酸和熊果酸含量并计算其转移率和纯度,结果见表9。结果显示,齐墩果酸的平均转移率和纯度分别为61.11%、53.44%,RSD分别为1.33%、1.34%(n=3);熊果酸的平均转移率和纯度分别为65.78%、19.79%,RSD分别为2.44%、2.43%(n=3);综合评分均大于66,RSD为0.73%(n=3)。
7 讨论
女贞子具有一定的抗氧化、延缓衰老的作用,研究证明其三萜类成分能够增强人体对氧自由基的抵抗力,具有清除1,1-二苯基-2-三硝基苯肼(DPPH)自由基的能力[14]。女性在绝经后易患骨质疏松,而现有研究已明确了女贞子治疗骨质疏松的药理作用,目前学界普遍认为,女贞子中的齐墩果酸、熊果酸、特女贞苷等均可通过促进骨细胞分化、阻滞破骨细胞激活或者增殖等途径发挥抗骨质疏松作用[15-18]。
本课题组前期对女贞子的提取工艺进行研究,优化了女贞子药材的提取工艺[13],并通过大孔吸附树脂优化特女贞苷的纯化工艺。在此基础上,本研究对齐墩果酸、熊果酸进行纯化工艺研究:首先对水沉温度、水沉时间、复溶乙醇用量、活性炭用量、析晶乙醇体积分数等进行单因素试验,再以此为基础进行响应面试验设计。通过分析得到最佳纯化工艺为:水沉——药材提取浓缩液中加4倍量水,0 ℃下静置2 h;复溶——加入药材1.0倍量的乙醇溶解;除杂——加入4%的活性炭;析晶——加水调整乙醇体积分数至80%,4 ℃下静置12 h,离心,干燥。结果显示,通过优选纯化工艺所制得的女贞子总三萜中齐墩果酸、熊果酸的转移率分别为61.11%、65.78%,纯度分别为53.44%、19.79%, 综合评分大于66,RSD均小于3%,表明优选工艺稳定、可行。
综上,本研究优化所得纯化工艺提取效率高、操作简便,可用于女贞子总三萜类成分纯化的工业化生产以及后续贞芍醇苷胶囊等相关制剂的开发。考虑到齐墩果酸几乎不溶于水、在水中的溶出度极低、细胞渗透性差[19-20],且肝肠首关效应强[21-22]、口服生物利用度极差,后续拟采用固体分散体制剂技术有效提高其溶出度和生物利用度[23-24],以提高贞芍醇苷胶囊的药效作用。
参考文献
[ 1 ] 张凡,张广美.女性绝经综合征的研究进展[J].中国临床研究,2017,30(8):1131-1133、1137.
[ 2 ] 黄志英,丁岩.围绝经期女性代谢综合征的相关研究进展[J].国际妇产科学杂志,2020,47(1):84-87.
[ 3 ] 赵岩,徐莹,查琳,等.女贞子提取物降血糖及抗氧化活性的研究[J].药物评价研究,2016,39(3):382-387.
[ 4 ] 贾强强,陈贝贝,朱如愿,等.女贞子对去卵巢大鼠抗骨质疏松作用及其对GH/IGF-1信号通路的影响[J].中草药,2019,50(16):3852-3858.
[ 5 ] 雷丽娟,杨晓琴,周英,等.女贞子提取物对破骨细胞分化及成骨细胞增殖的影响[J].中国药房,2019,30(16):2247-2252.
[ 6 ] 高赛,周欣,陈华国.女贞子化学成分及质量控制研究进展[J].中国中医药信息杂志,2018,25(12):133-136.
[ 7 ] 李芳美,祝晨蔯.女贞子中齐墩果酸和熊果酸的含量测定[J].今日药学,2009,19(4):37-39、42.
[ 8 ] CHEN J,CUI Y,ZHANG N,et al. Oleanolic acid attenuated diabetic mesangial cell injury by activation of autophagy via miRNA-142-5p/PTEN signaling[J]. Cytotechnology,2019,71(5):925-933.
[ 9 ] 程艳刚,荆然,谭金燕,等.齐墩果酸及其衍生物抗肿瘤作用机制研究进展[J].辽宁中医药大学学报,2016,18(11):210-213.
[10] 吴晨悦.齐墩果酸微粒的制备工艺及对CCl4肝损伤的预防作用研究[D].北京:北京中医药大学,2017.
[11] XIE BP,SHI LY,LI JP,et al. Oleanolic acid inhibits RANKL-induced osteoclastogenesis via ER alpha/miR- 503/RANK signaling pathway in RAW264.7 cells[J].Biomed Pharmacother,2019. DOI:10.1016/j.biopha.2019. 109045.
[12] 国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:45-46.
[13] 高爽,王玉真,薄福民,等.正交试验法优化女贞子提取工艺[J].山东科学,2019,32(4):8-15.
[14] 江洪波,张志强,梁雪兰,等.不同等级女贞子抗氧化活性差异比较[J].临床合理用药杂志,2019,12(11):8、119.
[15] 刘亭亭,王萌.女贞子化学成分与药理作用研究进展[J].中国实验方剂学杂志,2014,20(14):228-234.
[16] 劉先芳,梁敬钰,孙建博,等.女贞子化学成分和药理活性研究进展[J].海峡药学,2018,30(1):1-8.
[17] DONG XL,ZHANG Y,FAVUS MJ,et al. Ethanol extract of Fructus ligustrilucidi increase circulating 1,25-dihy droxyvitamin D3 by inducing renal 25-hydroxyvitamin D-1α hydroxylase activity[J]. Menopause,2010,17(6):1174- 1181.
[18] LI G,ZHANG XA,ZHANG JF,et al. Ethanol extract of Fructus ligustriluidi promotes osteogenesis of mesenchy- mal stem cells[J]. Phytother Res,2010,24(4):571-576.
[19] JEONG DW,KIM YH,KIM HH,et al. Dose-linear pharmacokinetics of oleanolic acid after intravenous and oral administration in rats[J]. Biopharm Drug Dispos,2007,28(2):52-57.
[20] 杨茗钫,程晓华,徐文炜.齐墩果酸体外肠吸收特征及P-糖蛋白介导跨膜转运机制[J].医药导报,2017,36(3):247-251.
[21] 李能.肝肠首过效应对齐墩果酸生物利用度的影响研究[D].广州:广州中医药大学,2012.
[22] 王亚平,胡园,董瑞华,等.齐墩果酸和熊果酸的人肝微粒体代谢研究[J].军事医学,2012,36(5):368-371、384.
[23] TONG HH,DU Z,WANG GN,et al. Spray freeze drying with polyvinylpyrrolidone and sodium caprate for improved dissolution and oral bioavailability of oleanolic acid,a BCS Class Ⅳ compound[J]. Int J Pharm,2011,404(1/2):148-158.
[24] LIU Y,LUO X,XU X,et al. Preparation,characterization and in vivo pharmacokinetic study of PVP-modified oleanolic acid liposomes[J]. Int J Pharm,2017,517(1/2):1-7.
(收稿日期:2020-02-19 修回日期:2020-08-09)
(编辑:段思怡)

