外泌体lncRNA干扰素诱导GTP酶假基因1在非小细胞肺癌中的表达及临床意义
章喜林 余欢明 王翔
肿瘤相关巨噬细胞在肿瘤微环境和恶性进展过程中发挥重要调控作用。相关研究发现,肺癌组织周围浸润大量巨噬细胞,进而影响细胞增殖、迁移、侵袭以及肿瘤转移、血管生成、免疫抑制,促进肿瘤的恶性进展[1-2]。在不同因子的刺激下,巨噬细胞被激活成M1型或M2型,并发挥不同的功能。鉴于此,有学者提出了靶向巨噬细胞的治疗方法[3]。但是关于肿瘤相关巨噬细胞促进肿瘤转移的机制以及调控肿瘤微环境的作用,目前尚未清楚。近年来,研究发现肿瘤来源外泌体可携带大量蛋白质或核酸并传递到受体细胞或微环境中,从而影响细胞与细胞和(或)细胞与微环境之间的信号调控,进而促进肿瘤转移和恶性进展[4-6]。研究表明,非小细胞肺癌(nonsmall cell lung cancer,NSCLC)外泌体可通过释放晶体蛋白甲B来调控M2型巨噬细胞表型转化,进而促进肿瘤转移[7]。另有研究表明,长链非编码RNA(lncRNA)干扰素诱导GTP酶假基因1(GVINP1)的表达与肺腺癌患者的预后密切相关[8],但其在NSCLC外泌体中的表达及临床意义未见相关报道,本研究对此进行探讨,现将结果报道如下。
1 对象和方法
1.1 对象 选取2016年10月至2018年2月在湖州师范学院附属第一医院手术并经病理组织学检查确诊为NSCLC的患者51例(收集外周血标本前未予抗肿瘤治疗),其中男24例,女27例;年龄28~80(60.73±14.05)岁;肿瘤组织高分化12例,中分化31例,低分化8例;国际抗癌联盟第8版肺癌TNM分期[9]:Ⅰ期28例,Ⅱ期12例,Ⅲ期7例,Ⅳ期4例;有淋巴结转移5例,无淋巴结转移46例。另选取本院同期健康体检者45例作为对照,其中男21例,女24例;年龄36~88(60.48±11.88)岁。收集两组对象的外周血标本。本研究经医院伦理委员会审查通过,所有对象签署知情同意书。
1.2 主要试剂与仪器 ExoQuickTMExosome Isolation Reagent购自美国 SBI公司(5 ml,EXOQ5A-1);Total Exosome Isolation(from cell culture media)试剂(50 ml,4478359)、Trizol试剂(100 ml,15596018)购自美国 Invitrogen 公司;5×PrimeScript RT Master Mix(Perfect Real Time)(RR036A)、SYBR GreenTMPremix Ex TaqTM(Tli RNaseH Plus)(RR420A)购自大连宝日生物Takara公司;CD9(sc-13118)、CD81(sc-166029)、Alix 抗体(sc-53540)购自美国Santa Cruz Biotechnology公司;脂多糖(1 mg,L2654)购自日本 Sigma公司。NanoDrop 2000分光光度计购自 ThermoFisher Scientific公司;Applied Biosystems 7500 RT-PCR仪购自美国ABI公司;透射电子显微镜G2 spititi FEI购自Tecnai公司;纳米颗粒跟踪分析仪(ZetaView Particle Metrix)购自德国PMX公司。
1.3 细胞培养和处理 人正常肺上皮细胞(BEAS-2B)、巨噬细胞(RAW264.7)和 NSCLC 细胞(A549、H1299)购自中国科学院干细胞库,所有细胞用完全培养基DMEM(Hyclone)+10% FBS(Gibco)+100 U/ml penicillin(Sigma)和 100 mg/L streptomycin(Sigma)培养。待细胞密度为70%~80%,加入无血清的培养基继续培养48 h,收集选择性培养基用于后续实验。细胞选择性培养基对巨噬细胞表型转化影响的实验分为5组,包括空白对照组(DMEM培养基)、脂多糖组、BEAS-2B-CM组、A549-CM组、H1299-CM组,分别用DMEM培养基、500 μg/L脂多糖、BEAS-2B培养基、A549培养基、H1299培养基处理RAW264.7细胞24 h。细胞选择性培养基外泌体对巨噬细胞表型转化影响的实验分为3组,包括BEAS-2B组、A549组、H1299组,分别用BEAS-2B培养基、A549培养基、H1299培养基提取的细胞外泌体处理RAW264.7细胞24 h。
1.4 外泌体提取 (1)血浆外泌体提取:取空腹静脉血5 ml,室温静置 30 min,3 500 g 离心 5 min,取血浆;利用外泌体提取试剂盒(EXOQ5A-1,SBI)提取血浆外泌体。取1 ml血浆加入10 μl Thrombin旋转混匀20 min,10 000g 离心 5 min;取上清液,加入 252 μl ExoQuickTMExosome Isolation Reagent混匀,4 ℃孵育 30 min,1 500g离心30 min,去除上清液。取部分沉淀溶于PBS中,用于电镜下观察和纳米颗粒跟踪分析法鉴定;部分沉淀溶于Trizol试剂中,用于RT-PCR检测;部分沉淀溶于RIPA裂解液中,用于Western blot检测。(2)细胞选择性培养基外泌体提取:30 ml选择性培养基经梯度离心、0.22 μm过滤后,加入15 ml Total Exosome Isolation(from cell culture media)试剂,4℃孵育过夜,10 000 g离心60 min,去除上清液,将沉淀溶于Trizol试剂中,用于RT-PCR检测。
1.5 外泌体电镜下观察与纳米颗粒跟踪分析法鉴定(1)外泌体固定于铜网上,静置1 min,2%醋酸双氧铀水室温染色1 min,在透射电子显微镜下观察并拍照。(2)外泌体经PBS稀释后,采用纳米颗粒跟踪分析法测定颗粒浓度及直径。
1.6 CD9、CD81和Alix蛋白表达检测 采用Western blot法。外泌体溶于RIPA裂解液中提取总蛋白,12 000 g、4℃离心10 min,取等体积样品经10% SDS-聚丙烯酰胺凝胶(SDS-PAGE)电泳;然后将蛋白转印至0.45 μm PVDF膜,用5%脱脂牛奶室温封闭1 h,加入CD9、CD81和Alix特异性抗体4℃孵育过夜。PVDF膜经PBST充分洗涤,加入辣根过氧化物酶标记的兔抗鼠(1∶2 000)室温孵育1 h。利用ECL化学发光法检测外泌体中CD9、CD81和Alix蛋白表达,利用Tanon 5200全自动化学发光成像系统获取电泳图。
1.7 GVINP1及炎症因子mRNA表达水平检测 采用RT-PCR法。按照Trizol试剂说明书提取总RNA,分别将血浆和细胞选择性培养基外泌体RNA溶于焦碳酸二乙酯(DEPC)水,经NanoDrop 2000检测总RNA的质量和纯度,用 5×PrimeScriptRTMasterMix(PerfectRealTime)逆转录成cDNA。合成的cDNA利用SYBR GreenTMPremix Ex TaqTM(Tli RNaseH Plus)进行 PCR 扩增,20 μl反应体系包括 10 μl SYBR GreenTMPremix Ex TaqTM(Tli RNaseH Plus)、0.6 μl上游引物、0.6 μl下游引物和 50 ng cDNA;反应程序为 95 ℃ 10 min;95 ℃ 15 s,60 ℃ 30 s,40个循环;95 ℃ 15 s,60 ℃ 30 s,95 ℃ 15 s。PCR 扩增结束后,采用2-ΔΔCt法计算GVINP1及炎症因子mRNA表达水平,每个样本设3个平行孔。所用引物序列见表1。1.8 统计学处理 采用SPSS 22.0统计软件。计量资料用表示,两组间比较采用两独立样本t检验;多组间比较采用单因素方差分析,两两比较采用Bonferroni法。计数资料用率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 NSCLC患者外周血外泌体的观察与鉴定 在电镜下可见NSCLC患者外周血中含有丰富的外泌体,见图1a;外泌体大小为 26.7~136.1 nm,见图 1b。
2.2NSCLC患者与健康体检者血浆外泌体中CD9、CD81和Alix蛋白及GVINP1 mRNA表达水平比较 NSCLC患者和健康体检者血浆外泌体中都存在CD9、CD81和Alix蛋白表达,见图2a;NSCLC患者血浆外泌体中GVINP1 mRNA表达水平明显高于健康体检者,差异有统计学意义(P<0.05),见图 2b。
2.3 不同临床特征NSCLC患者血浆外泌体中GVINP1的mRNA表达水平比较 有淋巴结转移、TNM分期Ⅲ~Ⅳ期的NSCLC患者血浆外泌体中GVINP1表达水平较低,差异均有统计学意义(均P<0.05),见表2。
2.4 NSCLC细胞选择性培养基中外泌体GVINP1 mRNA表达水平比较 与人正常肺上皮细胞(BEAS-2B)选择性培养基外泌体比较,NSCLC细胞(A549、H1299)选择性培养基外泌体中GVINP1 mRNA表达水平均明显升高(均 P<0.05),见图 3。
2.5 NSCLC细胞选择性培养基对巨噬细胞表型转化的影响 与空白对照组比较,BEAS-2B-CM组、A549-CM组、H1299-CM 组 IL-1β、TNF-α、IL-6 mRNA 表达水平均明显升高(均P<0.05),见图4a-c;而A549-CM组、H1299-CM组IL-10 mRNA水平明显降低(P<0.05),见图4d。

表1 RT-PCR引物序列

图1 非小细胞肺癌(NSCLC)患者外周血外泌体的观察与鉴定(a:电镜下观察;b:纳米颗粒跟踪分析法测得外泌体颗粒浓度及直径)

图2 NSCLC患者与健康体检者血浆外泌体中CD9、CD81和Alix蛋白及GVINP1 mRNA表达水平比较(NSCLC为非小细胞肺癌,GVINP1为干扰素诱导GTP酶假基因1;a:CD81、CD9和Alix蛋白表达的电泳图;b:GVINP1 mRNA表达水平的比较,与健康体检者比较,*P<0.05)

表2 不同临床特征NSCLC患者血浆外泌体中GVINP1 mRNA表达水平比较
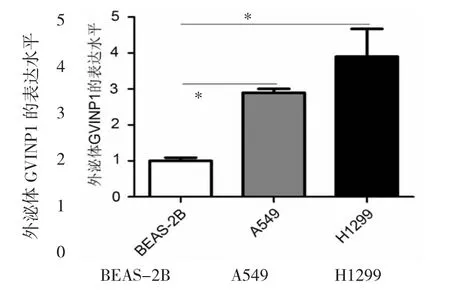
图3 NSCLC细胞选择性培养基外泌体中GVINP1 mRNA表达水平比较(NSCLC为非小细胞肺癌,GVINP1为干扰素诱导GTP酶假基因 1;与 BEAS-2B 比较,*P<0.05)
2.6 NSCLC细胞选择性培养基外泌体对巨噬细胞表型转化的影响 与去除外泌体的选择性培养基比较,BEAS-2B 组、A549组、H1299组外泌体中 IL-1β、TNF-α、IL-6mRNA表达水平均明显升高(均P<0.05),见图5a-c;而A549组、H1299组外泌体中IL-10 mRNA表达水平明显降低(P<0.05),见图 5d。
3 讨论
肺癌是我国发病率和死亡率较高的肿瘤之一,其中以NSCLC最为常见[10]。由于早期缺少有效的诊断指标,多数患者被发现时已处于晚期,失去了最佳手术治疗时机,而且晚期患者对化疗药物不敏感,5年生存率仅15%左右[10]。因此,寻找一种新的诊断指标,实现肺癌转移早期诊断与预后判断具有重要意义。
lncRNA是一类长度>200核苷酸、保守性较低但具有高度组织特异性的非编码RNA[11]。前期研究发现,lncRNA是重要的调控分子,在NSCLC发生、发展和转移中具有重要作用[12-13]。国内外学者研究发现,HOTAIR[14]、MALAT1[15]、H19[16]、CCAT2[17]等多种 lncRNA 在肺腺癌中高表达,且其表达与肺腺癌诊断和治疗密切相关。Sui等[8]提取TCGA数据库的数据分析发现,GVINP1在肺腺癌中低表达,其与 CEBPA-AS1、MIR31HG、RAET1K联合检测可作为肺腺癌预后判断的潜在标志物。本研究结果发现,GVINP1在NSCLC细胞选择性培养基的外泌体中表达水平升高,这表明细胞可选择性释放携带GVINP1外泌体并作用于受体细胞,从而影响细胞功能。笔者在NSCLC患者血浆外泌体中也发现了相同的结果,且其表达与患者TNM分期、淋巴结转移有关,这与先前肺腺癌组织中的研究结果不一致[8],表明GVINP1可能具有双重作用。多项研究表明,lncRNA在癌症进展中可表现为两面性。如MALAT1通过激活或失活相邻前转移转录因子(TEAD)可促进或抑制乳腺癌转移[18];DDX3在肺癌进展中也存在双重作用,一方面可激活Wnt信号通路来促进肺癌进展,另一方面可激活MDM2/Slug/E-cadherin信号通路来抑制肺癌进展[19]。这些结果表明,GVINP1在NSCLC癌组织和外泌体中可能发挥着不同功能,抑制或促进肺癌进展。
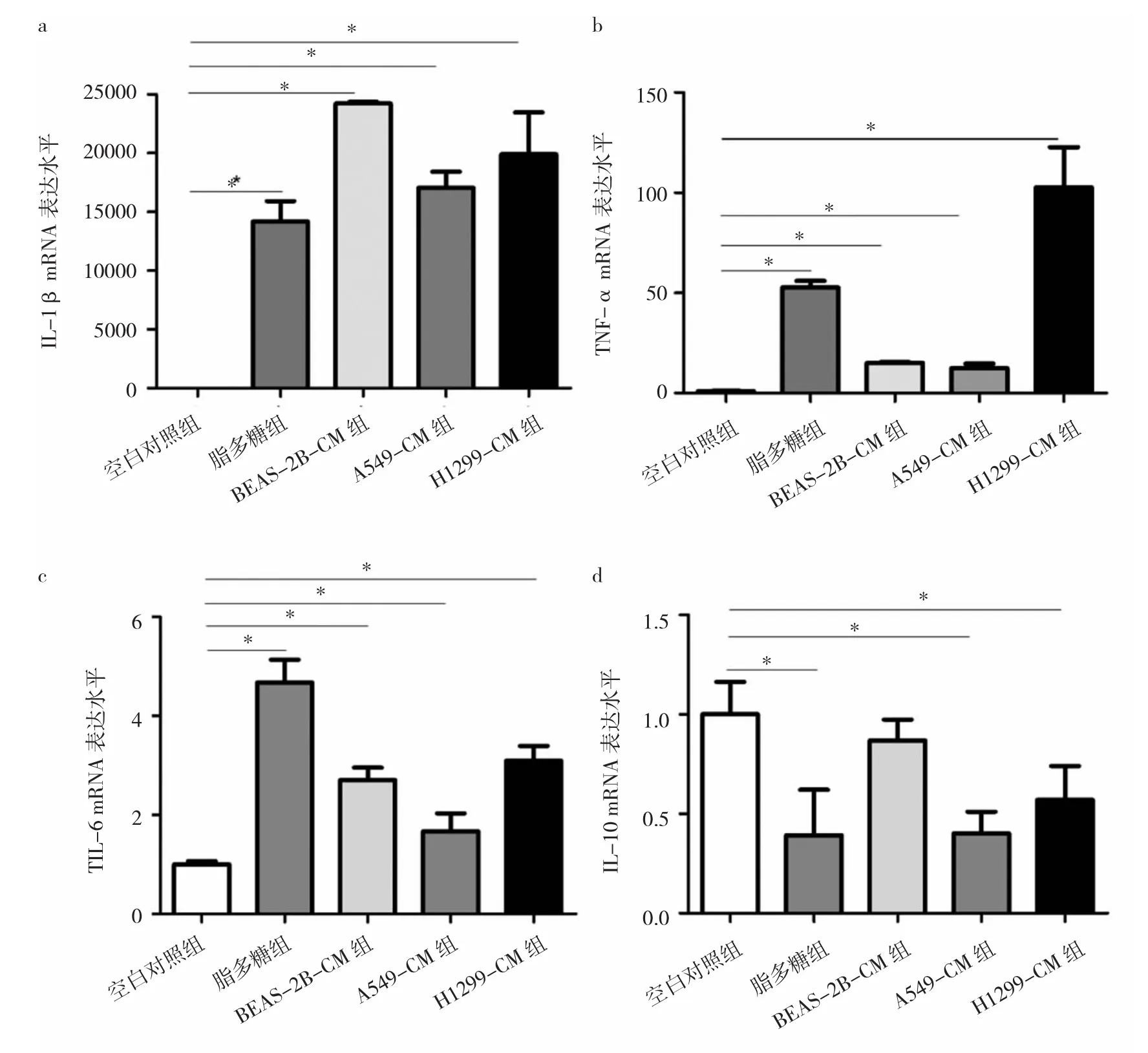
图4 非小细胞肺癌(NSCLC)细胞选择性培养基对巨噬细胞表型转化的影响(a:IL-1β mRNA表达水平;b:TNF-α mRNA表达水平;c:IL-6 mRNA 表达水平;d:IL-10 mRNA 表达水平;*P<0.05)
肿瘤相关巨噬细胞是一类浸润在肿瘤组织中的单核细胞,是肿瘤微环境的重要组成部分。大量研究表明,这类细胞可参与调控肿瘤的发生、发展、侵袭、转移、耐药等多个过程,从而促进肿瘤恶性进展。近年来,鉴于肿瘤相关巨噬细胞在肿瘤微环境中的重要调控作用,有学者提出靶向肿瘤相关巨噬细胞的治疗方式并取得了明显效果,使患者生存质量有了明显提升[3]。前期研究发现,M2型巨噬细胞可介导上调晶体蛋白甲B表达,促进NSCLC细胞迁移和肿瘤转移[7]。本研究结果也发现,NSCLC细胞选择性培养基和外泌体处理巨噬细胞可促进M2型巨噬细胞活化。这些结果表明NSCLC可能介导上调外泌体GVINP1表达,促进M2型巨噬细胞活化,从而促进肿瘤进展。
综上所述,本研究首次阐明了NSCLC细胞外泌体可促进M2型巨噬细胞转化,并发现NSCLC细胞和NSCLC患者外周血中的外泌体GVINP1表达明显升高,且与患者TNM分期、淋巴结转移有关,提示NSCLC可能介导外泌体GVINP1调控巨噬细胞表型转化,从而促进肿瘤恶性进展。但本项目也存在一定的不足,如不能直接证明外泌体GVINP1在巨噬细胞表型转化中的作用,还需要更多证据去证明外泌体GVINP1在NSCLC组织和巨噬细胞以及肿瘤微环境中的作用及机制,为NSCLC患者预后改善提供新的靶点。
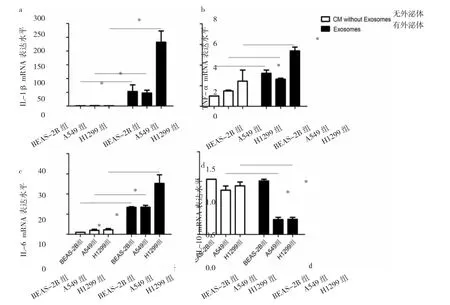
图5 非小细胞肺癌(NSCLC)细胞选择性培养基外泌体对巨噬细胞表型转化的影响(a:IL-1β mRNA表达水平;b:TNF-α mRNA表达水平;c:IL-6 mRNA 表达水平;d:IL-10 mRNA 表达水平;*P<0.05)

