阿帕替尼治疗进展期非小细胞肺癌的疗效及不良反应
马丽敏 倪 军 陈淑琴
肺癌为我国临床常见恶性肿瘤之一,其发病率与死亡率均居高不下,其中非小细胞肺癌(non-small-cell lung cancer,NSCLC)约占肺癌总体病理的80%[1-3]。肺癌相关指南及专家共识推荐的NSCLC一线治疗方案为铂类药物联用,部分患者治疗效果不佳,且5 年生存率较低,不足18%[4]。多西他赛为以顺铂为主的化疗失败的进展期NSCLC的治疗常用药物,但效果有限[5]。近年来,随着肿瘤相关基因、因子及信号通路研究的深入,越来越多的分子靶向药物被应用于癌症的治疗,其中阿帕替尼为新型抗血管生成靶向治疗药物,临床实践显示在晚期胃癌中的应用效果良好[6]。本研究旨在探究阿帕替尼应用于进展期NSCLC的疗效及其毒副作用,报告如下。
1 资料与方法
1.1 一般资料
入组患者共84例,均为2015年6月至2018年10月我院呼吸科收治的进展期NSCLC患者,随机分为观察组(40例)及对照组(44例)。观察组中男性22例,女性18例;年龄:35~72岁,平均年龄为(52.56±8.21)岁;病程:1~5年,平均病程(1.52±0.83)年;病理分期:Ⅲb期11例,Ⅲa期29例[7];肿瘤类型:鳞癌15例,腺癌25例。对照组中男性25例,女性19例;年龄:31~75岁,平均年龄为(53.16±8.43)岁;病程:1~4年,平均病程(1.51±0.48)年;病理分期:Ⅲb期14例,Ⅲa期30例;肿瘤类型:鳞癌18例,腺癌26例。对2组患者的性别、年龄、病理分期及肿瘤分型等一般资料进行均衡性比较,差异无统计学意义(P>0.05),具有可比性。本研究获得我院医学伦理委员会审核批准。
1.2 纳入及排除标准
纳入标准:①入组患者均为进展期NSCLC,并经病理组织学和(或)细胞学确诊[8];②经评估身体状况能够接受全程治疗者(KPS 评分>60分)[9],预计生存期大于3个月;③精神状态正常,对研究知情同意并签署相关文件;④年龄 18~75 岁。排除标准:①合并严重感染或免疫功能障碍(如AIDS)等影响疗效评估的基础疾病;②合并心、肝、肾功能衰竭;③合并其他恶性肿瘤患者;④存在不可测量的病灶,如胸腔积液、腹腔积液[10]。
1.3 治疗方法
对照组患者接受多西他赛治疗,60 mg/m2,1次/天,21 天为1个周期。观察组接受阿帕替尼治疗,500 mg/d,1次/天,21天为1个周期,治疗持续4个疗程。相应给予2组患者止吐、保护胃黏膜、营养支持、促进血小板及粒细胞生成的药物。
1.4 观察指标
1.4.1 细胞角蛋白19片段(Cyfra21-1)及血管内皮生长因子(VEGF) 化疗前及 2 个化疗周期后采集2组患者空腹静脉血3 ml,对血液标本进行离心处理后,取上清液,通过酶联免疫吸附法对血清Cyfra21-1水平及VEGF水平进行检测。
1.4.2 生存质量 治疗后通过KPS功能状态评分标准对肿瘤患者生存质量进行评价,包括患者症状、生活自理能力、住院治疗需求等,满分为100 分,得分越高说明患者生存质量越好[11]。
1.4.3 不良反应 观察并记录2组患者治疗期间血小板下降、白细胞下降和肝功能异常等不良反应发生情况。
1.5 疗效
以实体瘤疗效评价标准对2组患者的近期疗效进行评价,包括完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和病情进展(PD)。客观缓解率(ORR)=(CR+PR)/总例数×100%;疾病控制率(DCR)=(CR+PR+SD)/总例数×100%[12]。
1.6 统计方法

2 结果
2.1 2组患者疗效评估结果比较
观察组ORR的30.00%(12/40),显著高于对照组的11.36%(5/44),差异有统计学意义(χ2=4.508,P=0.034);观察组DCR为77.50%(31/40),显著高于对照组的47.73(21/44),差异有统计学意义(χ2=7.875,P=0.005)。见表1。

表1 2组患者疗效评估结果/例
2.2 2组患者治疗后生存质量比较
患者经治疗后,观察组生存质量有效率为87.50%(35/40),显著高于对照组的63.64%(28/44),差异有统计学意义(χ2=6.364,P=0.012)。见表2。

表2 2组患者治疗后的生存质量/例
2.3 2组患者血清Cyfra21-1和VEGF水平比较
经治疗后,观察组和对照组患者血清Cyfra21-1和VEGF水平均降低。治疗前观察组和对照组患者血清Cyfra21-1和VEGF水平均无显著差异(P>0.05),治疗后观察组患者血清Cyfra21-1和VEGF水平显著低于对照组(P<0.05)。见表3。

表3 2组患者血清Cyfra21-1和VEGF水平比较
2.4 2组患者不良反应发生率比较
观察组血小板下降、白细胞下降和肝功能异常的发生率均显著低于对照组,差异有统计学意义(P<0.05)。见表4。
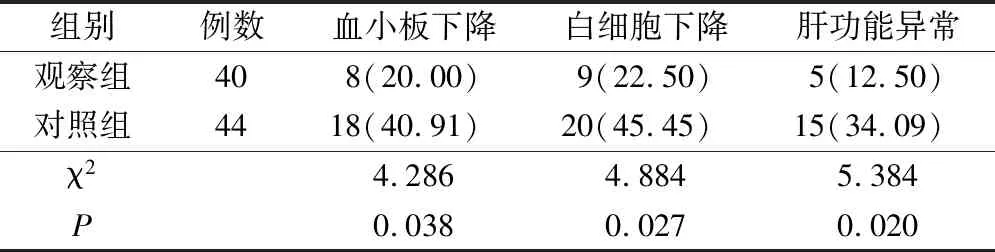
表4 2组患者不良反应发生情况比较(例,%)
3 讨论
进展期NSCLC患者由于癌组织转移及浸润,一般难以接受根治性手术切除治疗,其主要内科保守治疗手段为化疗,可有效延长患者生存时间[13]。多西他赛是晚期肺癌患者化疗二线用药,能通过促进微管蛋白二聚体的结合并阻止其解离而达到稳定微管的作用,可抑制肿瘤细胞增殖,还可使肿瘤细胞因有丝分裂异常而死亡[14],从而发挥广谱抗癌作用[15]。分子靶向药物因靶向性强、疗效好和不良反应发生率更低等优点受到临床广泛关注。大量研究显示肿瘤患者血清及癌组织中均存在VEGF的异常表达升高,肿瘤血管生成理论提出VEGF可促进血管新生,与癌组织扩张息息相关。针对这一机制,中国自主研发了第一代口服血管抑制靶向药物阿帕替尼,为癌症的治疗提供新的思路。本研究采用阿帕替尼对进展期NSCLC进行治疗,取得良好的临床效果。
本研究中观察组NSCLC患者采用阿帕替尼单药化疗,对照组采用多西他赛单药化疗,结果显示,治疗后观察组ORR为30.00%,显著高于对照组的11.36%,差异有统计学意义;观察组DCR为77.50%,显著高于对照组的47.73%,差异有统计学意义。说明观察组患者治疗效果更佳,肿瘤病灶的缩小程度更高,对进展期NSCLC病情进展具有较好的控制作用。多西他赛可特异性作用于细胞M周期,可加强微管蛋白聚合性,并破坏其网状结构,形成非功能型微管束,发挥直接杀伤癌细胞及抑制其增殖的作用[14]。阿帕替尼可选择性抑制VEGFR2,阻断VEGFR2与VEGFA结合,进而抑制其自身及酪氨酸残基的磷酸化(Tyr),使得Tyr951及Tyr1157介导的细胞的通透性改变、繁殖、转移等过程无法正常进行,从而抑制血管新生,最终对肿瘤的扩张产生抑制作用[15-16]。本研究结果显示相较于多西他赛,阿帕替尼抑制进展期NSCLC患者肿瘤病灶的作用更强。
肺泡上皮细胞凋亡后其角蛋白碎片降解可形成Cyfra21-1释放入血,Cyfra21-1也被认为是NSCLC检测的首选标志物,灵敏度及特异度均较高[17]。VEGF则因具有刺激肿瘤组织中血管内皮细胞增殖,辅助血管新生的作用,临床研究显示在肿瘤的产生及发展过程中具有重要作用[18]。本研究结果显示经治疗,观察组和对照组患者血清Cyfra21-1和VEGF水平均降低,且观察组患者血清Cyfra21-1和VEGF水平显著低于对照组。化疗药物多西他赛对患者的肺部癌组织进行抑制和杀伤,癌细胞的活性与增殖受到抑制,其分泌VEGF含量降低,对周围组织的刺激减轻,肺泡上皮细胞凋亡随之减少,Cyfra21-1水平降低。阿帕替尼则通过直接抑制VEGF/VEGFR信号通路发挥抗癌作用。此外,有研究显示阿帕替尼还可能通过RET/Src通路发挥抗癌活性[19],抑制肿瘤的生长,进一步降低肿瘤相关标志物含量。
接受化疗治疗的患者由于化疗药物的细胞毒性,普遍存在血小板下降、白细胞下降和肝功能异常等并发症,可影响患者健康状况及生存质量,甚至会中断治疗[20]。而KPS评分可对患者的生活质量进行有效评价,了解患者对癌症疾病及相关治疗的耐受程度。本研究结果显示,观察组血小板下降、白细胞下降和肝功能异常的发生率均显著低于对照组,差异有统计学意义;观察组生存质量有效率显著高于对照组,差异有统计学意义。多西他赛发挥抗癌作用建立在相对广泛的细胞毒性基础上,而阿帕替尼作为分子靶向药物,并不直接发挥细胞杀伤作用,而通过高选择性地作用于VEGFR2靶点,阻断肿瘤组织扩张的重要途径,发挥抗癌作用,不仅效果更佳,且产生的化疗副作用也更低。观察组患者生活自理能力更强,恢复更好,考虑原因为观察组患者肿瘤扩张进一步受到抑制,且化疗对患者的不良影响更轻。
综上,阿帕替尼能有效控制进展期NSCLC疾病进展,降低肿瘤标志物水平,不良反应较少,同时能改善患者生存质量,值得临床推广应用。

