CD10蛋白在结直肠癌组织中的表达及其临床意义
杨修远,潘月龙
(1.泰州市人民医院肿瘤科,江苏 泰州225300;2.杭州市肿瘤医院肿瘤内科,浙江杭州 310002)
肿瘤细胞的生长、浸润和转移是由肿瘤细胞、间质细胞以及细胞外基质共同作用的结果。肿瘤的生物学特性不仅是由癌基因和抑癌基因来调控,还依赖于由间质形成的微环境的作用。CD10蛋白是一种细胞表面糖蛋白金属结合酶,具有中性肽链内切酶的功能,其作为一种肿瘤-间质相互作用的参与因子,在肿瘤发生发展中起着重要作用。CD10表达失调节可干扰细胞生长和分化调节,改变细胞间的信号通路[1]。其结构与间质基质金属蛋白酶相似,因此CD10 可改变细胞的微环境影响肿瘤细胞的侵袭和转移潜能[2]。近年来CD10 在实体肿瘤中的应用价值逐渐被挖掘,其与肿瘤预后及生物学行为密切相关,同时具有成为肿瘤药物治疗新靶点的潜力。
结直肠癌是常见的消化道恶性肿瘤,近年来发病率及死亡率呈上升趋势。现有研究普遍认为癌组织CD10表达与多种肿瘤的不良预后及恶性生物学行为相关[3],但亦有一些研究得出了相反结论[4]。因此,我们设计了本实验,采用免疫组织化学的方法检测CD10蛋白在结直肠癌组织中的表达强度及比例,并通过分析其与结直肠癌各临床和病理特点之间的关系,来进一步了解CD10表达与结直肠癌发生及发展之间的关联。
1 材料与方法
1.1 标本
收集杭州市肿瘤医院2010年1月—2017年11月手术切除的结直肠癌组织石蜡包埋标本78例,其中男49例,女29 例。患者年龄30~96 岁,中位年龄66.5岁。所有标本均经病理证实,术前均未行放、化疗。其中,右半结肠(包括升结肠、结肠肝曲和近端2/3 横结肠)癌22例,左半结肠(包括远端1/3横结肠、结肠脾曲、降结肠和乙状结肠)癌16 例,直肠癌40 例;低分化癌(包括低分化腺癌、黏液腺癌、印戒细胞癌和未分化癌)18 例,中分化癌51 例,高分化9 癌;按TNM 分期:Ⅰ期12 例,Ⅱ期30 例,Ⅲ期32 例,Ⅳ期4 例;有淋巴结转移33 例,无淋巴结转移45 例;有脉管侵犯者28 例,无脉管侵犯者50 例;所有标本均经10%福尔马林固定,常规石蜡包埋,按4 μm 厚度连续切片,分别进行HE 和免疫组化染色。同时取距离肿瘤组织>3 cm 且经病理学检查证实无癌浸润的正常结直肠黏膜22例作为对照组。
1.2 主要试剂
鼠抗人CD10 单克隆抗体、即用型非生物素免疫组化EliVisionTMplus 试剂盒及DAB 显色剂,均为福州迈新生物技术公司产品。
1.3 检测方法
采用快捷免疫组化EliVision 法,严格按照产品说明操作。具体染色步骤如下:二甲苯切片脱蜡;酒精梯度脱水到水化,用PBS 液(0.01 mmol/L,pH=7.4)冲洗3次,每次3 min;高压锅加热抗原修复方法,修复液采用柠檬酸缓冲液;每张切片加1 滴3% H2O2,室温下孵育10 min,以阻断内源性过氧化物酶的活性。PBS冲洗3次,每次3 min;除去PBS液,每张切片分别滴加鼠抗人CD10 单克隆抗体一抗工作液,室温下孵育60 min;PBS 冲洗3 次,每次5 min,除去PBS液,每张切片加1 滴即用型EliVisionTMplus 试剂,室温下孵育20 min。PBS 冲洗3 次,每次3 min;除去PBS 液,每张切片加1 滴新鲜配制的DAB 溶液,显色5 min,自来水冲洗;苏木精复染5 min,自来水冲洗;浸入盐酸酒精分化1 min,自来水冲洗;PBS 返蓝后,脱水,透明,中性树胶封固,用PBS 代替一抗作为阴性对照,阳性对照由试剂公司提供。
1.4 结果判定
每张切片随机选择10 个视野读片(光镜200 倍),并选择有代表性的切片拍照。癌组织切片可见癌细胞胞浆呈淡黄到深棕色阳性染色,间质组织也有中量阳性表达。染色结果由2 位资深病理科医师共同判定。按染色程度分级:+~+++分别为淡黄色、棕黄色、深棕色。按阳性染色癌细胞分布比例进行评分:0 为0分;0~33%为1分、>33%~67%为2分;>67%~100%为3分。
1.5 统计学方法
用SPSS 20.0 统计软件包进行分析,不同分组间指标差异的分析采用卡方检验,以α=0.05 为检验水准。
2 结 果
2.1 结直肠癌组织中CD10蛋白的表达情况
免疫组织化学染色法检测结果见图1,正常癌旁组织中未见CD10 蛋白表达,癌组织切片染色阳性物质呈淡黄色、棕黄色或深棕色颗粒,在癌性腺体的腔缘和癌细胞胞质内着色。CD10在结直肠癌组织和正常癌旁组织中的表达情况见表1,可见78 例结直肠癌组织中,36 例表达阳性,42 例阴性,阳性率为46.2%,其中按CD10蛋白表达强度分类有3例+,11例++,22例+++;按CD10 蛋白分布比例评分分类有15 例1 分,7例2分,14例3分。22例癌旁组织CD10表达均为阴性。癌组织CD10 表达显著高于正常组织,差异有统计学意义(P=0.001)。

图1 免疫组织化学染色法检测癌组织中CD10的表达情况(×200)
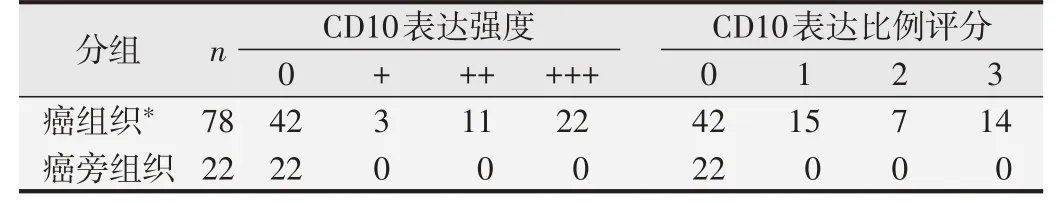
表1 CD10在结直肠癌组织和正常癌旁组织中的表达情况
2.2 CD10蛋白的表达与患者基本情况及临床病理指标的关系
CD10 蛋白表达情况的分类统计分析结果见表2。按患者性别分为男性组和女性组,不同性别癌组织中CD10 表达强度及比例无明显差异(P>0.05);按患者年龄分为高龄组(≥65 岁)和非高龄组(<65 岁),各年龄组间癌组织中CD10 表达强度及比例无明显差异(P>0.05);按肿瘤位置分为右半结肠组、左半结肠组和直肠组,不同位置癌组织中CD10 表达强度及比例无明显差异(P>0.05);按肿瘤分化程度分为高分化组、中分化组和低分化组(包括低分化腺癌、黏液腺癌、印戒细胞癌和未分化癌),不同分化癌组织中CD10 表达强度及比例无明显差异(P>0.05);按TNM 分期分为早期组(Ⅰ期+Ⅱ期)和中晚期组(Ⅲ期+Ⅳ期),中晚期结直肠癌CD10 蛋白表达强度高于早期肿瘤,差异有统计学意义(P=0.033),而CD10 蛋白表达比例则与结直肠癌分期无明显相关(P>0.05);按肿瘤浸润深度分为T1+T2组(肿瘤局限于固有肌层)和T3+T4 组(肿瘤穿透固有肌层到达或穿透浆膜层,或侵犯无腹膜覆盖的结直肠旁组织),浸润深度不同的结直肠癌癌组织中CD10 表达强度及比例无明显差异(P>0.05);按周围淋巴结转移情况分为有淋巴结转移组和无淋巴结转移组,周围淋巴结转移阳性的结直肠癌CD10 蛋白表达强度高于淋巴结阴性组,差异有统计学意义(P=0.023),而CD10蛋白表达比例则与淋巴结转移情况无明显相关(P>0.05);按脉管受侵犯情况分为有脉管侵犯组和无脉管侵犯组,存在脉管侵犯的结直肠癌CD10 蛋白表达强度高于无脉管侵犯组,差异有统计学意义(P=0.004),而CD10 蛋白表达比例则与脉管浸润情况无明显相关(P>0.05)。
3 讨 论
结直肠癌是一种常见的消化道恶性肿瘤,在全球范围内为男性第3 位、女性第2 位高发恶性肿瘤,每年新发病例约120 万例,死亡约60 万例[5]。随着社会经济发展、环境污染加重、居民生活方式的转变,以及人口老龄化加剧等原因,我国结直肠癌的发病和死亡有明显上升趋势,且发病年龄呈现年轻化趋势。中国结直肠癌新发病例占全球的18.6%,致死原因居于恶性肿瘤的第5 位[6],严重威胁着人民群众的生命健康。
CD10 蛋白是一种细胞表面锌依赖性金属蛋白酶,属于肽酶类家族成员之一,它可以水解结合于疏水氨基酸氨基残基的多肽,从而达到降低与受体结合和信号传导肽类浓度的作用,α-氨基的碳是其酶切位点。CD10可以切断很多生理活性多肽,包括心房钠尿肽、血管紧张素Ⅰ和Ⅱ、血管舒缓激肽、P 物质、神经降压素、后叶催产素和脑啡肽等[7]。其表达机制是通过调节局部肽的浓度来介导细胞对激素产生应答,因此许多激素敏感或肽敏感细胞以及相应的肿瘤均表达CD10 抗原,在不同组织CD10 表现的功能也不尽相同。CD10在人类中期胚胎的上皮和间充质细胞上有表达,在肾脏、呼吸道及外生殖器的细胞分化和增殖过程中发挥作用[8]。CD10表达在中枢神经系统起到脑啡肽酶作用。在肺气管上皮细胞,CD10蛋白可以抑制正常胚胎支气管上皮细胞增殖和成熟[7]。还有研究发现,CD10蛋白对乳腺干细胞的表达有重要作用,可作为正常乳腺干细胞/祖细胞中具有功能性的调节因子,促进乳腺干细胞/祖细胞向腔上皮细胞和肌上皮细胞分化[9]。

表2 CD10蛋白的表达与患者基本情况及临床病理指标的关系
CD10蛋白最初作为普通急性淋巴细胞白血病抗原(common acute lymphoblastic leukemia antigen,CALLA)被发现,主要作为急性淋巴细胞白血病的标志,用于白血病及淋巴瘤的免疫分型诊断及预后判断。近年来随着研究深入,CD10蛋白在实体瘤中的应用也愈加广泛。Jana等[10]研究结果表明,乳腺癌基质细胞CD10表达与肿瘤高分级、肿瘤细胞有丝分裂速度增加、较差的预后、雌激素受体(estrogen receptor,ER)阴性、人类表皮生长因子受体2(human epidermal growth factor receptor-2,HER2)阳性和分子亚型(CD10阳性与HER2过表达型,CD10阴性与Luminal型)显著相关。国内黄雯等[11]亦证实CD10在乳腺癌中高表达与乳腺癌进展相关。此外,在膀胱癌、胃癌、胰腺癌及其他恶性实体瘤中,各项研究也提示CD10 的表达与肿瘤的不良预后密切相关[12]。
CD10蛋白在结直肠癌中的研究也频见报端。早在2002 年,Ogawa 等[13]就发现在结直肠重度不典型增生腺瘤、黏膜内癌和浸润性癌的基质细胞表达CD10 的比例均远高于轻度或中度不典型增生腺瘤,CD10的表达与p53蛋白积累、肿瘤体积显著相关,提示CD10的表达可能是结直肠癌发生发展过程中的一个组成部分,并且有助于肿瘤浸润性生长,从而导致肿瘤转移。同年,Yao 等[14]的研究发现,伴肝转移的结直肠癌患者的CD10 表达率(58.1%)显著高于无肝转移的结直肠癌患者(21.7%),提示表达CD10 的结直肠癌患者的肝转移风险增大。Sasaki等[3]研究提示,在结直肠癌患者中,血清CD10 水平是提示同时性和异时性肝转移的可靠指标。Fujita 等[15]的研究结果也提示,CD10与结直肠癌患者无病生存率显著相关,CD10阴性患者肝转移的发生率为3%,CD10 阳性患者肝转移发生率为28%。Ohji 等[16]的一项病例对照研究显示结直肠癌伴肝转移病例中CD10、VEGF 和CD44 表达的比例均显著高于无肝转移结直肠癌患者。Logistic回归分析显示,淋巴结转移、CD10表达和VEGF表达均是结直肠癌肝转移的独立危险因素,若上述3 个标记均为阳性,肝转移的概率将达到92.7%。Raposo 等[17]的实验则提示上皮细胞CD10 在原发性肿瘤中的表达与淋巴结浸润和较晚分期有关,并发现CD10 在早期肿瘤中抑制细胞运动,而在晚期肿瘤中反而促进细胞活力。
由于条件限制,本研究缺乏入组患者术后的相关随访信息,无法探究CD10 蛋白的表达与肿瘤复发转移及生存时间之间的关系,但以上诸多大样本临床研究和基础研究足以证明CD10 表达是结直肠癌肝转移的独立危险因素,可作为结直肠癌的一项预后指标。关于CD10 表达增加结直肠癌肝转移风险的机制,Kuniyasu 等[18]提出,CD10蛋白在结直肠癌细胞表达可降解肝内具有抗肿瘤作用的甲硫氨酸脑啡肽(methionine enkephalin,MENK)从而降低肝脏抗肿瘤能力,并导致CD10 阳性的结直肠癌细胞肝转移发生率增加。
本研究发现,结直肠癌组织中CD10 蛋白表达强度与患者性别、年龄、肿瘤部位、分化程度、浸润深度无明显相关关系(P>0.05),而与肿瘤细胞的临床分期、有无脉管侵犯及淋巴结转移有关(P<0.05),中晚期结直肠癌CD10 蛋白表达强度高于早期肿瘤(P=0.033),周围淋巴结转移阳性的结直肠癌CD10蛋白表达强度高于淋巴结阴性病例(P=0.023),存在脉管受侵犯的结直肠癌CD10 蛋白表达强度高于无脉管受侵病例(P=0.004)。其机制可能是癌细胞通过分泌CD10 蛋白降解了肿瘤周围的细胞外基质和脉管基膜,导致癌细胞更易于浸润和转移。本研究未能得出CD10 蛋白表达在不同肿瘤分化程度和浸润深度之间存在明显差异,可能受到总样本量小、高分化或肿瘤局限于肌层的病例数少等因素影响。总结实验结果提示,CD10蛋白表达与结直肠癌的不良生物学行为以及不良预后相关,与国内外大多数研究的结论相近。Hirano 等[19]的研究表明高度异型性结直肠肿瘤的总体CD10 表达率(60.6%)远高于低度异型性肿瘤(28.9%),数据充分提示CD10的表达水平对于预测早期大肠癌的生物学特性有应用价值。Nishida等[20]的研究表明,CD10阳性的肿瘤相较于CD10 阴性显示出更容易出现浸润,并与T1 期结直肠癌淋巴结转移风险密切相关。得到阴性结果的相关报道不多,Bernescu等[4]的一项回顾性研究收集了191例T1N0期~T3N2期无远处转移结直肠癌患者,提示,CD10表达并未显示与结直肠癌淋巴结转移密切相关(P=0.33),并不优于单纯根据肿瘤原发灶淋巴管浸润情况预测淋巴结转移的风险,但该研究同时指出,CD10 表达情况对于评判淋巴结转移有较高的特异性(75.7%)。与主流观点不完全一致的原因可能是组织差异或者此研究中淋巴结转移阳性者例数不足。
本研究提示结直肠癌组织中CD10 蛋白高表达可能是结直肠癌发生的重要因素,并且可能与结直肠癌的局部侵袭和远处转移相关。其可能机制包括:①CD10蛋白降解肿瘤周围的细胞外基质和脉管基膜,改变细胞微环境从而影响肿瘤细胞的侵袭和转移潜能;②CD10蛋白降解癌细胞分泌的具有抑制恶性肿瘤细胞生长功能的脑啡肽,从而避免抑制信号;③表达CD10的肿瘤间质细胞通过活化肌纤维母细胞协助癌细胞逃避人体免疫系统的清除。本实验初步探讨了CD10 蛋白在结直肠癌中的表达及其意义,因样本量偏小、随访资料不全等原因,得出的结论非常有限,但与国内外的大多数相关研究结果相近。后续仍需更大样本量的病例研究佐证和明确目前所得结论,并可通过更为系统的术后随访来探索CD10 蛋白表达对结直肠癌患者复发转移及生存时间的影响。同时,我们仍需要更多的基础实验来进一步明确CD10 蛋白在结直肠癌发生、发展及浸润转移中的作用机制。

