瓦雷兹芽孢杆菌JK-XZ8 对樱花根癌病的防效与抑菌物质初探
张锡唐,吴小芹*,陈飞
(1.南京林业大学南方现代林业协同创新中心,南京林业大学林学院,江苏 南京,210037;2.江苏省有害生物入侵预防与控制重点实验室,江苏 南京,210007;3.江苏天悦生态农业有限公司,江苏 徐州,221600)
樱花作为一种优良的园林观赏树种,在全国各地均有种植[1],然而樱花根癌病严重影响了樱花的生长和苗木的培育。该病害在北京、河北、辽宁、吉林、山东、内蒙古、浙江、江苏、上海等地均有不同程度地发生[2]。根癌病作为一种严重的细菌性病害,其病原根癌土壤杆菌(Agrobacterium tu⁃mefaciens)可 侵 染93 科331 属643 种 植 物,在 我 国根癌病菌可侵染樱桃、桃、杏、李、苹果、梨、葡萄、榆叶梅[3]、杨树[4]、毛白杨[5]、无患子[6]等。由于该病菌特殊的致病机制(即病菌致病基因Ti 质粒转移并整合于植物的细胞中,导致植物细胞的异常增生,从而形成根瘤),导致防治较为困难[7]。前期调查发现,江苏徐州沛县苗木种植基地的樱花根癌病发生严重,平均发病率76%,重发病区达92%[8],寻找良好的防治方法迫在眉睫。
上世纪70 年代前世界各国对该病进行了多年研究,未能获得理想的防治方法。1972 年澳大利亚Kerr 等研制出放射土壤杆菌(Agrobactorium ra⁃diobacter)K84 生防菌剂,该生防菌剂在防治桃树根癌病获得成功并在世界多地广泛应用,是根癌病防治中的重大突破[9]。之后研究者们发现了更多可用于防治根癌病的生防菌株,如金色假单胞菌(Pseudomonas aureofaciens)B-4117 和荧光假单胞菌(P. fluorescens)CR330D 对葡萄农杆菌(A.tumefaciens)Tm4 和Sz1 均具有拮抗作用[10];水生拉 恩 氏 菌(Rahnella aquatilis)HX2 对 由A. vitis K308 引起的葡萄根癌病有较好的抑制作用[11];Rhizobium vitis VAR03-1 对苹果根癌病具生物防治的作用[12]。瓦雷兹芽孢杆菌(Bacillus velezen⁃sis)是一种良好的根际促生细菌,对许多病原菌都具有拮抗作用[13]。其抑菌机理包括:(1)产生细胞分裂素等促生物质促进植物生长;(2)产生鞭毛蛋白、脂多糖类和水杨酸类等诱导抗性的物质来诱导植物的系统抗性;(3)产生抑菌物质如羊毛硫抗生素或细菌素(lantibiotics or bacteriocins)或脂肽类 和 聚 酮 类 化 合 物(lipopeptides and polyketides)[14]。关于瓦雷兹芽孢杆菌防治樱花根癌病的报道较少。
本研究前期从樱花根际土壤筛选到一株对根癌土壤杆菌有拮抗作用的菌株JK-XZ8,经鉴定其为瓦雷兹芽孢杆菌(B. velezensis)。本研究将该菌株进行田间应用,测定其野外生防效果;并对该菌株JK-XZ8 的抑菌粗提物的稳定性和抑菌合成相关基因检测,以期为探讨该生防菌的抑菌机理及今后的田间应用提供参考依据。
1 材料与方法
1.1 供试材料
瓦雷兹芽孢杆菌(B. velezensis)JK-XZ8 和根癌土壤杆菌(A. tumefaciens)PX-1 均由本重点实验室从樱花根际筛选分离获得,现保存于南京林业大学森林病理实验室。
供试樱花:一年生日本早樱(Prunus subhirtel⁃la),由江苏天悦生态农业股份有限公司提供。
放射土壤杆菌(Agrobactorium radiobact)K84生物菌肥购自中国农业大学,用于防治根癌病。
培养基:除特殊说明外,配制时均用蒸馏水定容至1 000 mL,121℃灭菌20 min。LB 培养基(生防细菌计数):10 g 蛋白胨、5 g 酵母提取物、10 g NaCl;Medium D1 培养基[15](筛选根癌土壤杆菌):15 g 甘露醇、5 g NaNO3、6 g LiCl、20 mg Ca(NO3)2·4H2O、2 g K2HPO4、0.2 g MgSO4·7H2O、0.1 g溴百里酚蓝、15 g琼脂,根据根癌土壤杆菌的抗生素抗性特性加入一定浓度的相应抗生素。
1.2 平板拮抗测定
活化瓦雷兹芽孢杆菌JK-XZ8 与根癌土壤杆菌PX-1,先将2 种菌株接种于25 mL LB 液体培养基,置于200 r·min-1,28℃的恒温摇床中培养24 h。将100 μL 根癌土壤杆菌PX-1 涂布于固体LB 培养基中,之后将6 mm 的无菌滤纸置于平板上,最后吸取5 μL 瓦雷兹芽孢杆菌JK-XZ8 滴加于无菌滤纸上。将固体平板置于28 ℃的恒温培养箱中24 h,观察滤纸片周围是否有抑菌圈出现。如有抑菌圈,通过游标卡尺测量抑菌圈2 个垂直方向的直径,平均值即为该抑菌圈的直径。
1.3 抑菌物质的粗提及其拮抗作用测定
参 考Abdallah 等 方 法[16],通 过 酸 沉 淀 进 行 脂肽分离。用6 mol·L-1HCl 将发酵滤液调节至pH 2,并在4 ℃下储存过夜。离心后,用5 倍体积的甲醇将沉淀物萃取2 次。将溶液用旋转真空蒸发器干燥,将剩余的干燥残余物溶于50 mmol·mL-1Tris-HCl,pH 7.5 缓冲液中,然后通过0.22 μm 过滤器过滤,即获得抑菌物质溶液。
将100 μL 根癌土壤杆菌PX-1 涂布于LB 固体平板上,之后在平板上放3 个6 mm 的圆形滤纸片,将生防菌瓦雷兹芽孢杆菌JK-XZ8 滴加10 μL 于滤纸片上,每处理3 个重复。最后将其放置于28 ℃恒温培养箱中培养24 h,观察是否有抑菌圈。
1.4 抑菌物质相关基因的检测
选择8 个与抑菌物质假定合成相关的基因进行克隆[16~18],其基因和克隆引物如表1 所示。

表1 抑菌物质假定合成相关基因的引物Tab.1 Primers of genes related to bacteriostatic substances
1.5 抑菌物质稳定性测定
参考梁静[4]的方法进行抑菌物质热稳定、酸碱稳定性、蛋白酶稳定性和紫外稳定性检测。热稳定试验中将抑菌物质溶液分别置于20、50、80、100℃的水浴锅中处理15~20 min;酸碱稳定性中用乳酸和氢氧化钠将抑菌物质溶液的pH 值调为2、4、6、9、12;蛋白酶稳定性是用蛋白酶K 处理抑菌物质溶液30 min;紫外照射(70 μW·cm-2的30 W紫外线灯管,0.5 m)抑菌物质溶液1、2、3 h,最后均利用滤纸片法测定抑菌活性。
1.6 野外生防试验
一年生樱花苗木种植于江苏徐州沛县张庄镇天悦生态农业有限公司苗圃,当地土壤为盐碱土(pH 8.2)。试验于2019 年4 月进行,每个试验处理30 株樱花苗木,栽培管理条件一致。3 个试验处理分别为CK(不做任何处理)、JK-XZ8 处理(通过根部蘸浆法单独施用瓦雷兹芽孢杆菌JK-XZ8)、K84 处理(按照使用说明使用)。
瓦雷兹芽孢杆菌JK-XZ8 采用200 L 自动发酵罐(TPC-1551T-E3AE,上海百伦公司)发酵24 h,以25 L 无菌桶封装放4 ℃恒温冷藏室备用,并将市售Agrobacterium radiobacter K84 菌肥作为防效对照。新栽樱花幼苗用根部蘸浆法:取母菌液2 L,加水定容10 L 桶中,稀释5 倍,搅拌混匀,加适当土稀释至呈粘稠状,做成浆液。将裸根樱花苗逐一放入桶中浸没根部,待表面包裹一层泥浆后取出,放入事先挖好的土穴栽植。
在施菌处理一个月后,通过稀释涂布法用Me⁃dium D1 选择培养基测定不同处理的樱花根际土壤中病原菌的数量。并于2019 年11 月樱花完全落叶之后,进行防治效果的测定,统计樱花根癌病发病情况,即计算发病率,并统计根瘤数量和大小,分级(表2)。

表2 樱花根癌病分级标准[19]Tab.2 Disease classification standards cherry blossoms crown gall
发病率=发病植株/总株数×100%
病情指数= 100×∑(各级病根数×各级代表值)/(调查总根数×最高级代表值)
防治效率%=(未处理发病率-处理后发病率)/未处理发病率×100
1.7 樱花生长情况测定
樱花的株高与地径使用卷尺和游标卡尺进行测量。
株高净增长量=完全落叶后株高-施菌前株高
胸径净增长量=完全落叶后胸径-施菌前胸径
1.8 数据处理
所有数据均采用SPSS 20 和EXCEL 2016 软件进行处理。数据的初步统计分析使用Excel 进行,之后使用SPSS 20 进行方差分析与邓肯多重比较(One-way ANOVA),显著差异水平P<0.05 用小写字母表示。
2 结果与分析
2.1 瓦雷兹芽孢杆菌JK−XZ8 对根癌土壤杆菌PX−1 的拮抗作用
平板拮抗测定表明,CK 对照组在未接入JKXZ8 菌株的情况下培养皿正反都没有任何变化(图1A 和图1B),而在接有菌株JK-XZ8 的培养皿滤纸片周围有明显的透明圈(图1C 和图1D),说明菌株JK-XZ8 抑制了樱花根癌土壤杆菌PX-1 的生长,对樱花根癌土壤杆菌PX-1 有拮抗作用。

图1 瓦雷兹芽孢杆菌JK-XZ8 拮抗根癌土壤杆菌PX-1Fig.1 B.velezensis JK-XZ8 antagonizes A.tumefaciens PX-1
2.2 瓦雷兹芽孢杆菌JK−XZ8 粗提物对根癌病菌的拮抗作用
在将菌株JK-XZ8 发酵3 d 后,通过酸沉淀的方法提取抑菌粗提物,并用旋转蒸发仪进行浓缩,最后用Tris-HCl 缓冲液溶解。溶解后的物质即为抑菌粗提物。平板拮抗试验表明,相较于CK(图2A)处理,在滤纸片上接种菌液JK-XZ8,滤纸片周围形成抑菌圈,抑菌圈大小直径为10~11 mm(图2B)。在滤纸片上滴加抑菌粗提物,滤纸片周围形成明显的抑菌圈,抑菌圈直径大小为12~13 mm。证明瓦雷兹芽孢杆菌JK-XZ8 发酵滤液的粗提物对根癌土壤杆菌有较好的拮抗作用,也说明生防菌株JK-XZ8 可以产生抑制根癌土壤杆菌PX-1 的物质。
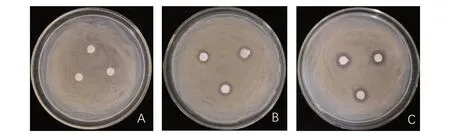
图2 生防菌株JK-XZ8 发酵滤液拮抗根癌土壤杆菌PX-1Fig.2 B.velezensis JK-XZ8 antagonizes A.tumefaciens PX-1
2.3 瓦雷兹芽孢杆菌JK−XZ8 抑菌物质假定合成相关基因PCR 检测
利用8 对引物,分别对脂肽类物质合成相关基因和聚酮类化合物合成相关基因进行PCR 检测。结果表明瓦雷兹有芽孢杆菌JK-XZ8 中含有脂肽类化合物合成相关基因bmyB,ituD,fenD 和聚酮类化合物合成相关基因PK1,PK2,PK3。此6 个基因片段与目标片段长度一致(图3)。对扩增得到的5 个基因片段进行测序,经NCBI 的Blast 比对分析,其中瓦雷兹芽孢杆菌JK-XZ8 菌株的bmyB基 因 序 列 与 B. amyloliquefaciens GYL4(KT963041.1)的bmyB 基因的同源性达到97.41%,JK-XZ8 菌株中的ituD 基因序列与B.amyloliquefaciens V167(CP044360.1)的ItuD 同源性达到98.97%,JK-XZ8 菌株中的fenD 基因序列 与 B. amyloliquefaciens SYBC H47(KY051734.1)的FenD 同源性达到95.93%。瓦雷兹芽孢杆菌JK-XZ8 的PK1、PK2、PK3 基因序列 与B. amyloliquefaciens FZB42(CP000560.2)的PK1(bae)、PK2、PK3(dif)基因的同源性分别达到97.67%、99.76%和99.62%。
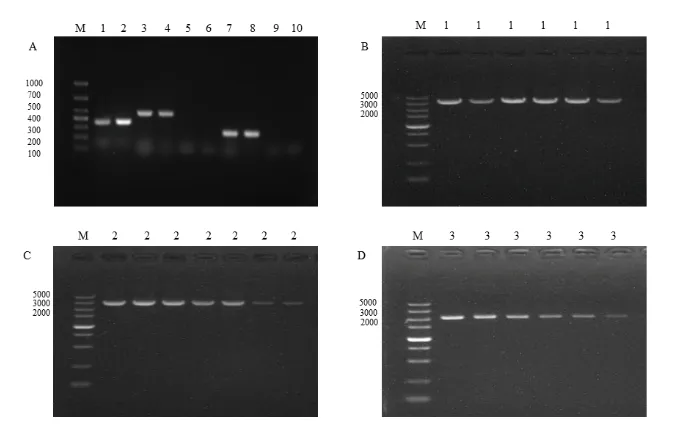
图3 瓦雷兹芽孢杆菌JK-XZ8 抑菌物质相关基因PCR 检测Fig.3 PCR detection of genes related to bacteriostatic substances of B.velezensis JK-XZ8.
2.4 瓦雷兹芽孢杆菌JK−XZ8 粗提物在不同条件下的抑菌活性稳定性
测定表明(表3),瓦雷兹芽孢杆菌JK-XZ8 的粗提物在温度20~100 ℃都有抑菌能力,且温度在20~80 ℃其抑菌能力差异不显著。当pH 为7 时,粗提物的抑菌能力是最好的,过酸过碱都会降低粗提物抑菌能力。用蛋白酶K 处理该抑菌粗提物后,平板拮抗测定证明其抑菌能力依然存在。通过紫外照射该菌株的抑菌粗提物3 h 后,并未破坏该物质的抑菌能力,但是在照射24 h 之后,抑菌能力消失。这些结果一定程度上说明菌株JK-XZ8产生的抑菌物质性质比较稳定,且非蛋白类物质。
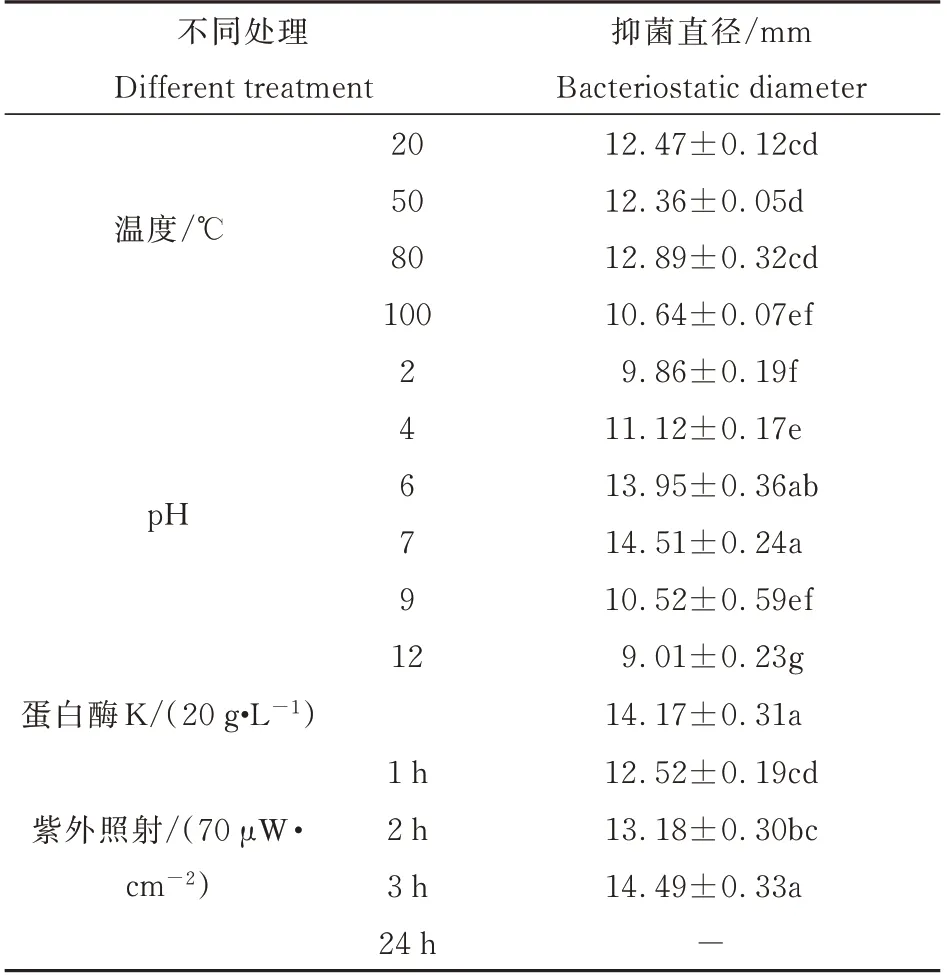
表3 瓦雷兹芽孢杆菌JK−XZ8 抑菌粗提物的稳定性测定Tab.3 Stability determination of crude extracts of B.velezensis JK−XZ8
2.5 瓦雷兹芽孢杆菌JK−XZ8 对樱花根癌病的
2.6 田间生防效果及樱花生长状况
田间樱花苗木施菌处理一个月后,通过稀释涂布(即利用Medium D1 筛选培养基)和平板计数对不同处理的樱花根际土壤中根癌土壤杆菌数量进行统计。结果表明与CK 处理相比,施用生防菌JK-XZ8 的樱花根际病原菌数量明显下降,然而施用生物菌肥K84 的病原菌数量与CK 处理无差异(图4)。

图4 不同处理下樱花根际土壤中病原菌数量Fig.4 The number of pathogens in the rhizosphere soil of cherry blossoms under different treatments
施用生防菌7 个月后对野外樱花的生长和发病情况进行调查(表4),结果表明施用瓦雷兹芽孢杆菌JK-XZ8 可帮助樱花苗木更好的在盐碱地上存活(存活率100%),同时对樱花根癌病的防治效果达到50%。作为对照的K84 菌肥樱花苗木的存活率为58.75%,对樱花根癌病的防治效果为25%。此外施用K84 菌肥的樱花根瘤平均直径为37.06 mm,明显高于施用瓦雷兹芽孢杆菌JK-XZ8的平均根瘤直径(24.34 mm)。病情指数作为综合考量病害的发生程度,施用K84 的樱花苗木病情指数为60,也明显高于施用瓦雷兹芽孢杆菌的樱花处理(40)。说明瓦雷兹芽孢杆菌是一株可用于防治樱花根癌病的潜力菌株。
通过对樱花苗木株高胸径的测量,结果表明不同处理的樱花幼苗之间无论是其株高净增长率还是胸径净增长率之间均与CK 处理无明显差异。各处理株高净增长量均在6~8 cm 之间,胸径净增长量均在3.5~4.5 mm 之间。
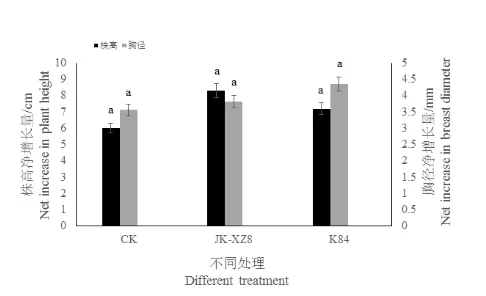
图5 不同处理下樱花苗木生长情况Fig.5 Growth of cherry saplings under different treat⁃ments
3 结论与讨论

表4 瓦雷兹芽孢杆菌JK−XZ8 对樱花根癌病的野外防治效果和樱花存活率Tab.4 Control effect and survival rate of cherry blossom crown gall disease by B.velezensis JK−XZ8 in field trials
瓦雷兹芽孢杆菌作为一种环境友好且有较好抑菌能力的菌株,受到广泛研究。根据相关文献报道芽孢杆菌发挥的生物防治作用是由于不同的机制所致:除了对宿主植物有良好的促生作用和刺激植物诱导抗性之外,产生抑菌物质也是很重要的[13]。目前已知芽孢杆菌可以产多种抗菌物质,按合成途径不同,可分为核糖体肽和非核糖体肽。核糖体肽主要包括细菌素与类细菌素、酶类和活性蛋白等物质,非核糖体肽主要包括脂肽类、多肽类和其他类物质[20]。本研究提取了瓦雷兹芽孢杆菌的抑菌粗提物,经不同温度测定表明,该抑菌粗提物在20~100 ℃间,对根癌土壤杆菌的抑制能力一直存在,在20~80 ℃之间,抑菌能力无明显差异,当温度达100℃,抑菌能力才有明显下降。在pH 为2~12 之间该抑菌粗提物均有抑菌能力,当pH 在6~9 之间时,抑菌能力无明显差异;当pH为2 或12 时,该粗提物抑菌能力出现明显下降。除此之外该抑菌粗提物不会被蛋白酶K 分解,说明该抑菌物质性质稳定,且为非蛋白类物质。说明该菌株的环境适应性强,在较宽泛的自然环境条件下抑菌物质能发挥一定作用。同时有研究表明,脂肽类物质是解淀粉芽孢杆菌中结构稳定且具有抑菌能力的物质。本研究对瓦雷兹芽孢杆菌JK-XZ8 的脂肽类抑菌物质基因进行了PCR 验证,发现菌株JK-XZ8 中含有bmyB 基因。2017 年Frikha-Gargouri 等研究认为基因bmyB 可以作为筛选拮抗根癌病有效芽孢杆菌的因子[21],因此可以认为瓦雷兹芽孢杆菌JK-XZ8 是一株有效的拮抗樱花根癌病的菌株。本研究PCR 检测到菌株JK-XZ8 还含有ituD 和fenD 基因,他们分别是合成伊枯草素(Iturin)和泛革素(fengycin)的基因,说明抑菌粗提物中可能含有伊枯草素(Iturin)和泛革素(Fengycin),这与2015 年Ben 的研究结果一致[16]。2017 年Frikha-Gargouri 等还研究发现解淀粉芽孢杆菌39b 在体外实验中阻止植物致病性根癌土壤杆菌的生长,并通过质谱法鉴定物质为表面活性素[22]。然而在本研究中并未检测到表面活性素合成的必须基因sfp[17]。说明瓦雷兹芽孢杆菌JKXZ8 并非产生表面活性素来抑制根癌土壤杆菌。本研究中还检测到聚酮类化合物的合成基因,即合成多烯抗生素difficidin 和oxydifficidin 的PK1 和PK3 基因,以及控制合成一种弱的未知聚酮化合物 的PK2 基 因[18]。Chen 等 研 究 发 现 解 淀 粉 芽 孢杆菌FZB42 产生的聚酮化合物对由欧文氏菌(Er⁃winia amylovora)引起的梨火疫病具有防治效果[23]。因此我们推测瓦雷兹芽孢杆菌JK-XZ8 抑菌粗提物中不仅含有脂肽类物质,还含有聚酮类物质,是一株可能通过产生上述物质来有效防治根癌病的生防菌株。
芽孢杆菌常作为林业和农业应用上的生物防控剂和植物生长促生剂。如李青等[24]研究的B.velezensis SQR9,该菌株可以形成强健的生物膜,具有较强的根系定殖能力,常作为农作物生产中的生物肥料和生物防治剂,可以有效促进植物生长和抑制土传病害。张俊祥等研究的解淀粉芽孢杆菌GB1,将其应用于防治苹果腐烂病(Valsa ma⁃li),经田间试验证明其控制苹果腐烂病的效果髙达90%[25]。谭石勇将解淀粉芽孢杆菌T5 应用于防治番茄青枯病(Ralstonia solanacearum),盆栽实验证明其防控效率达到了74.35%[26]。樱花根癌病作为一种细菌性的土传病害,在我国危害日益严重,本研究将瓦雷兹芽孢杆菌JK-XZ8 应用于徐州沛县樱花圃地的盐碱土壤中,结果表明其对于大田樱花根癌病的防治效果可达50%,防效优于市场上应用的用于防治根癌病的K84 菌肥的防效(25%)。施用瓦雷兹芽孢杆菌JK-XZ8 还提高了樱花幼苗的存活率(100%),明显高于施用K84 菌肥和CK。说明瓦雷兹芽孢杆菌JK-XZ8 较K84 菌肥更适用于盐碱地上樱花根癌病的防治,且对樱花亦有一定的促生长作用,是一株良好的具有防治樱花根癌病的生防菌株。

