野木瓜果汁非酶褐变抑制及营养保全工艺优化
崔霖芸 罗洪波
(遵义医药高等专科学校,贵州 遵义 563006)
野木瓜是蔷薇科木瓜属植物,味酸性温,具有舒筋活络、和胃化湿的功效[1]。现代科学研究[2]表明其果实富含多酚、多糖、黄酮、齐墩果酸及多种维生素等生物活性物质。贵州省遵义市正安县野木瓜因其优良的品质,于1996年被授予“中国野木瓜之乡”的称号[3]。野木瓜作为第一批被列入药食同源的中药材,除了制成胶囊或片剂药用外,还被加工成果汁、果脯、软糖、果酒、果醋等食品,其中果汁是主要产品。
野木瓜果汁在贮藏过程中容易发生非酶褐变,造成产品品质与营养价值降低。因为非酶褐变的反应类型多样,加工过程中常用复合抑制剂,发挥其不同类型的抑制协同作用抑制褐变。如李鹏等[4]发现0.02%的L-半胱氨酸、0.2%的D-异抗坏血酸钠和0.01%的亚硫酸氢钠复合抑制剂能有效抑制柿子汁的非酶褐变;常大伟等[5]发现0.10%抗坏血酸、0.4%β-环糊精和0.08% EDTA对浑浊型梨汁的褐变有较好抑制作用等。而加工中常使用的EDTA及含硫化合物虽然对褐变的抑制效果较好,但不利于身体健康。目前野木瓜果汁非酶褐变抑制的研究尚未见报道。
研究拟以野木瓜果汁非酶褐变抑制率为主要响应目标,将多酚保全率(即抑制褐变后的多酚含量与鲜果汁多酚含量的百分比)和·OH清除率作为次响应目标,应用响应面法对褐变抑制剂的种类及浓度进行工艺优化,以期为提高野木瓜果汁的加工技术水平提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
野木瓜:贵州省遵义市正安县;
L-半胱氨酸、植酸、D-异抗坏血酸钠:食品级,纯度99%,上海阿达玛斯有限公司;
柠檬酸、NaCl、CaCl2:分析纯,国药集团化学试剂有限公司;
福林酚:生化级,北京索莱宝科技有限公司;
碳酸钠、FeSO4、水杨酸、H2O2:化学纯,国药集团化学试剂有限公司。
1.1.2 主要仪器设备
分光光度计:UV-1801型,北京北分瑞利分析仪器有限公司;
榨汁机:JYZ-V902型,山东九阳股份有限公司;
微波炉:WD900TL23型,广东顺德格兰仕微波炉有限公司。
1.2 试验方法
1.2.1 工艺流程
野木瓜鲜果→挑选→清洗→去皮核切块(1 cm3)→1% NaCl浸泡(5 min)→1.5% NaCl漂烫(100 ℃,30 s)→微波灭酶(800 W,50 s)→榨汁→过滤(100目沙布)→离心(4 000 r/min,3 min取上清液)→添加抑制剂→杀菌(100 ℃,60 s)→趁热装瓶→成品
1.2.2 褐变抑制率的测定 在420 nm波长下,测定样品的吸光度值,以A420 nm值表示该样品的褐变指数[6]。按式(1)计算褐变抑制率。
I=[(Ai-A0)/A0]×100%,
(1)
式中:
I——褐变抑制率,%;
Ai——添加抑制剂的褐变指数;
A0——未添加抑制剂的褐变指数。
1.2.3 多酚保全率的测定 采用福林法测定多酚含量[7],按式(2)计算多酚保全率。
P=[(Ci-C0)/C0]×100%,
(2)
式中:
P——多酚保全率,%;
Ci——抑制褐变后果汁中多酚浓度,μg/mL;
C0——鲜果汁中多酚浓度,μg/mL。
1.2.4 ·OH清除率的测定 采用Fenton法[8],按式(3)计算·OH清除率。
R=[(A0-Ax)/A0]×100%,
(3)
式中:
R——清除率,%;
A0——空白对照的吸光度值;
Ax——加入待测液后的吸光度值。
1.2.5 单因素试验 据相关文献[5,9-10]及预试验结果,选定柠檬酸、氯化钙、D-异抗坏血酸钠、氯化钠、植酸、L-半胱氨酸6种抑制剂,以褐变抑制率为评价指标,考察单一褐变抑制剂的抑制作用。每种抑制剂设置5个浓度梯度[柠檬酸、氯化钙、D-异抗坏血酸钠、氯化钠、植酸分别设定(添加剂在果汁中的质量浓度)0.01%,0.05%,0.10%,0.30%,0.50% 5个梯度,L-半胱氨酸设定0.05%,0.10%,0.40%,0.70%,1.00% 5个梯度],每次试验只添加一种抑制剂的一个浓度,不添加其他抑制剂,以考察每种抑制剂的添加量对野木瓜果汁非酶褐变的抑制作用。
1.2.6 Plackett-Burman试验 以野木瓜果汁褐变度为考察指标,采用单因素试验确定的柠檬酸、氯化钙、D-异抗坏血酸钠、氯化钠、L-半胱氨酸、植酸的浓度为考察对象,选择n=12的2水平PB试验设计。
1.2.7 最陡爬坡试验 根据PB试验结果筛选出的因素和效应方向,确定爬坡试验因素、步长和爬坡方向,设计最陡爬坡试验方案。
1.2.8 Box-Behnken试验 根据PB试验和爬坡试验选出的显著因素与水平,应用Design Expert 8.0软件,设计三因素三水平的Box-Behnken试验。
1.2.9 数据处理 所有试验均重复进行3次,取平均值。采用t检验判断数据显著性。在P<0.05水平设置数据统计学显著性差异,采用Excel和Design-Expert 8.0软件进行数据处理。
2 结果与讨论
2.1 单一抑制剂对野木瓜果汁褐变的影响
由图1可知,D-异抗坏血酸钠和柠檬酸的抑制效果均随浓度的增加而明显增加,但在浓度达到0.10%以后,其抑制作用趋于稳定,在0.3%后随浓度增加抑制下降,D-异抗坏血酸钠的抑制作用主要是由其在酸性环境中易分解出D-异抗坏血酸[11],高浓度下抑制效果增加较小甚至下降,可能是因其在高浓度下自身氧化褐变反应加快所致,因此在PB试验中将其浓度水平定为0.05%~0.10%。柠檬酸的抑制效果随浓度的增加有明显增加,但在浓度达到0.10%以后,其抑制效果增加趋于平缓,柠檬酸对非酶褐变的抑制可能是通过降低体系的pH值[7],此外,柠檬酸有3个羧基,能有效络合体系中的铜、铁等金属离子,研究[8]显示金属离子会降低果汁氧化还原电位进而促进褐变,高浓度下抑制效果增加平缓则可能是因其络合作用使果汁中金属离子迅速减少,因此在PB试验中将其浓度水平定为0.05%~0.10%。植酸在低浓度下具有较高褐变抑制率,但随着浓度增加,抑制率反而降低,植酸的抑制作用可能源于其还原性(能提供6对氢原子与自由基电子形成稳定结构)[12]和6个螯合金属离子的磷酸根基团,其抑制率随着浓度的增加而下降可能是由于野木瓜果汁中金属离子较少,植酸在低浓度下就基本螯合完全,此外植酸浓度的增加使果汁pH值下降,促进抗坏血酸的氧化褐变,有研究[13]显示在pH值<3.0时,抗坏血酸的氧化褐变随pH值的下降而上升,因此在PB试验中将其浓度水平定为0.03%~0.06%。氯化钙的抑制作用随浓度增加缓慢增加,在浓度达到0.05%后随着浓度的增加而缓慢下降,氯化钙的抑制作用主要是通过钙离子与氨基酸结合形成不溶性化合物,从而抑制美拉德褐变反应[14],氯化钙的抑制作用随浓度缓慢增加可能是因为野木瓜果汁内氨基酸含量较低,钙离子作用有限,另外氯化钙在较高浓度下促进抗坏血酸螯合金属阳离子而消耗抗坏血酸,使褐变抑制率降低[15],因此在PB试验中将其浓度水平定为0.05%~0.10%。氯化钠的抑制作用随浓度的增加先增加后下降,可能是氯化钠在去除野木瓜果汁涩味的同时,消耗了褐变反应物而抑制褐变,此外还能降低果汁内的氧含量,从而降低氧化反应速度而抑制褐变;在较高浓度下氯化钠也能促进抗坏血酸螯合金属阳离子而消耗抗坏血酸,使褐变抑制率降低[15],因此在PB试验中将其浓度水平定为0.05%~0.10%。

图1 柠檬酸等5种抑制剂对野木瓜果汁褐变的影响Figure 1 Effects of citric acid and other factors on the browning of Stanuntonia chinensis juice
由图2可知,L-半胱氨酸对野木瓜果汁褐变具有很强的抑制作用,是试验所选6个抑制剂中抑制效果最好的。浓度仅为0.05%即可达到30.7%的抑制率,且随浓度增加而迅速增加,浓度为0.40%时抑制率达到59.5%,随后增加放缓,在浓度达0.70%后趋于平缓。L-半胱氨酸的抑制效果源于其具有—SH,—SH可以与酚类化合物的氧化产物醌类物质形成无色的羟醌类化合物,从而抑制酚类的非酶褐变反应[16],因为半胱氨酸中的巯基硫原子极化形成的空d轨道重叠后亲核作用增强,在亲核加成反应中—SH反应速率比—NH2高200~300倍,使得羰基化合物先与—SH加成从而抑制褐变[17]。鉴于单因素试验中L-半胱氨酸浓度为0.70%以后,褐变抑制率增加幅度变缓,PB试验浓度取值为0.40%~0.80%。

图2 L-半胱氨酸对野木瓜果汁褐变的影响Figure 2 Effects of L-cysteine on the browning of Stanuntonia chinensis juice
2.2 PB试验
根据单因素试验结果所确定的PB试验方案见表1,表中G、H、J、K、L列为虚拟列,用于估计试验误差。表2为PB试验数据的模型方差分析。
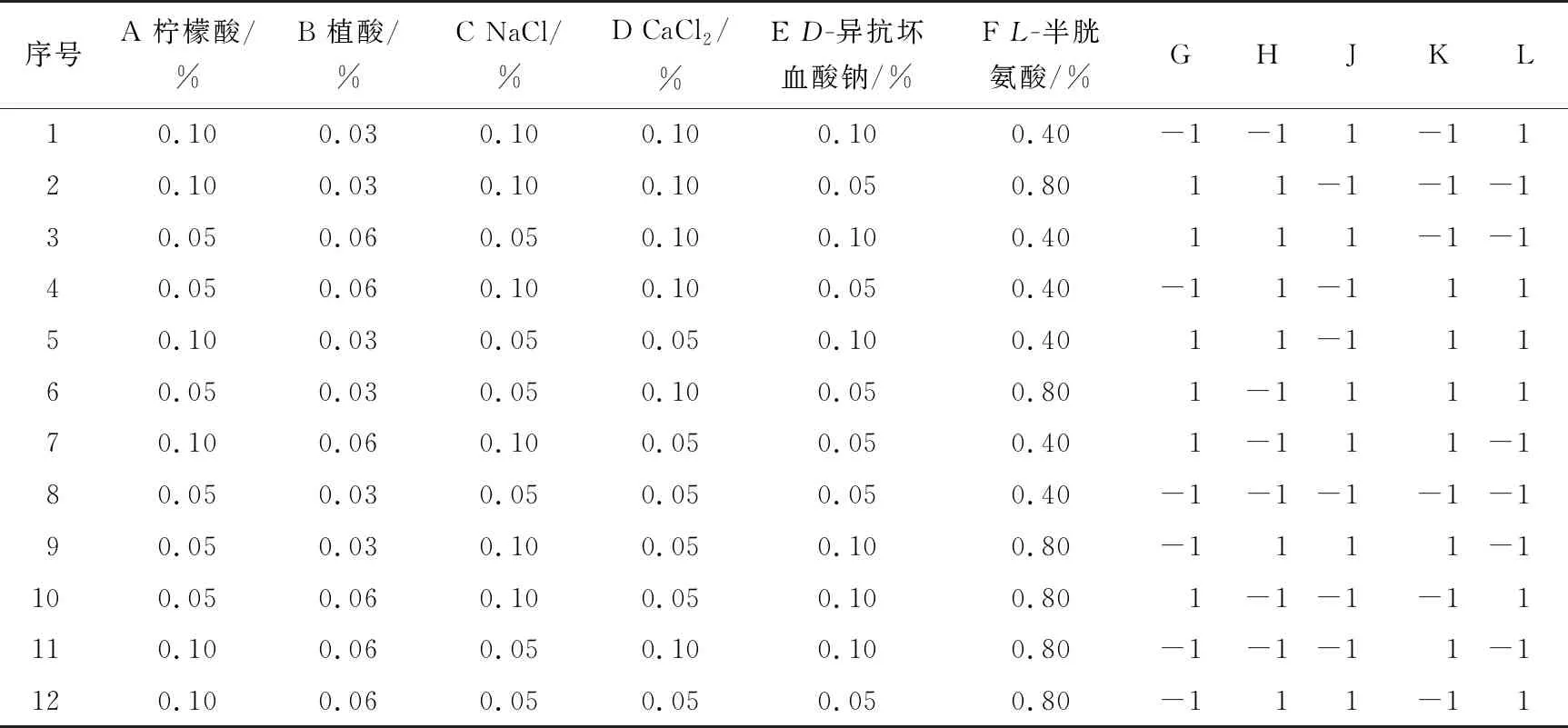
表1 Plackett-Burman试验方案
用Design-Expert 8.0软件对表1试验因子进行显著性分析,得回归方程(编码方程)为:
R=63.581+0.618A-2.613B+0.134C-0.893D-1.406E+3.741F。
(4)
由表2可知,回归模型P=0.004 4,极显著,说明该回归方程在回归区域拟合极好。选取P<0.05的因素,即植酸、D-异抗坏血酸钠和L-半胱氨酸对结果影响显著的3个因素。由回归方程可知,B、E系数为负,即植酸和D-异抗坏血酸钠为负效应(即低水平影响大,爬坡试验向下取值),L-半胱氨酸为正效应(即高水平影响大,爬坡试验向上取值)。
2.3 最陡爬坡试验
由表2可知,植酸为负效应,为便于操作,以步长0.005% 向下取值;D-异抗坏血酸钠为负效应,向下取值,为便于操作,步长取0.01%;L-半胱氨酸为正效应,向上取值,为便于操作,以步长0.10%向上取值,最陡爬坡试验方案及结果见表3。

表2 Plackett-Burman试验ANOVA分析
由表3可知,随着3个显著因素的变化,野木瓜果汁褐变抑制率呈先增加后减少,最优抑制配比出现在试验条件5的最佳响应值区域。
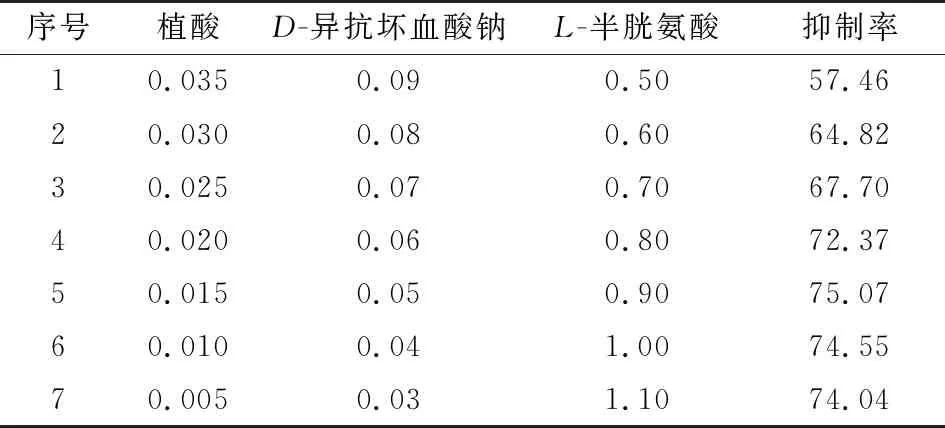
表3 最陡爬坡试验方案及结果
2.4 响应面试验
根据爬坡试验结果,应用Box-Behnken设计法,以植酸0.015%、D-异抗坏血酸钠0.05%、L-半胱氨酸0.90%为中心点,以野木瓜果汁褐变抑制率(权重为0.75)为主响应值、多酚保全率(权重为0.125)、对羟自由基的清除率(权重为0.125)为次响应值加权计算的综合指标为响应值,设计了三因素三水平的响应面拟合试验方案见表4,结果见表5。

表4 Box-Behnken试验方案
通过Design Expert 8.0软件对试验结果进行回归分析,得以下二次多项式方程(代码方程):
AI=79.53+0.403A+2.29B-0.50C-0.60AB+0.14AC+0.93BC-1.45A2-1.64B2-0.96C2(R2=0.979 4)。
(5)
拟合方程R2>0.95,说明该方程拟合良好。由表6可知,回归模型P<0.000 1,极显著,说明方程模拟很好。从各因素看,L-半胱氨酸对综合指标达极显著(P<0.01),植酸和D-异抗坏血酸钠对综合指标均达显著水平(P<0.05),说明这3个因素对综合评价指标作用显著。
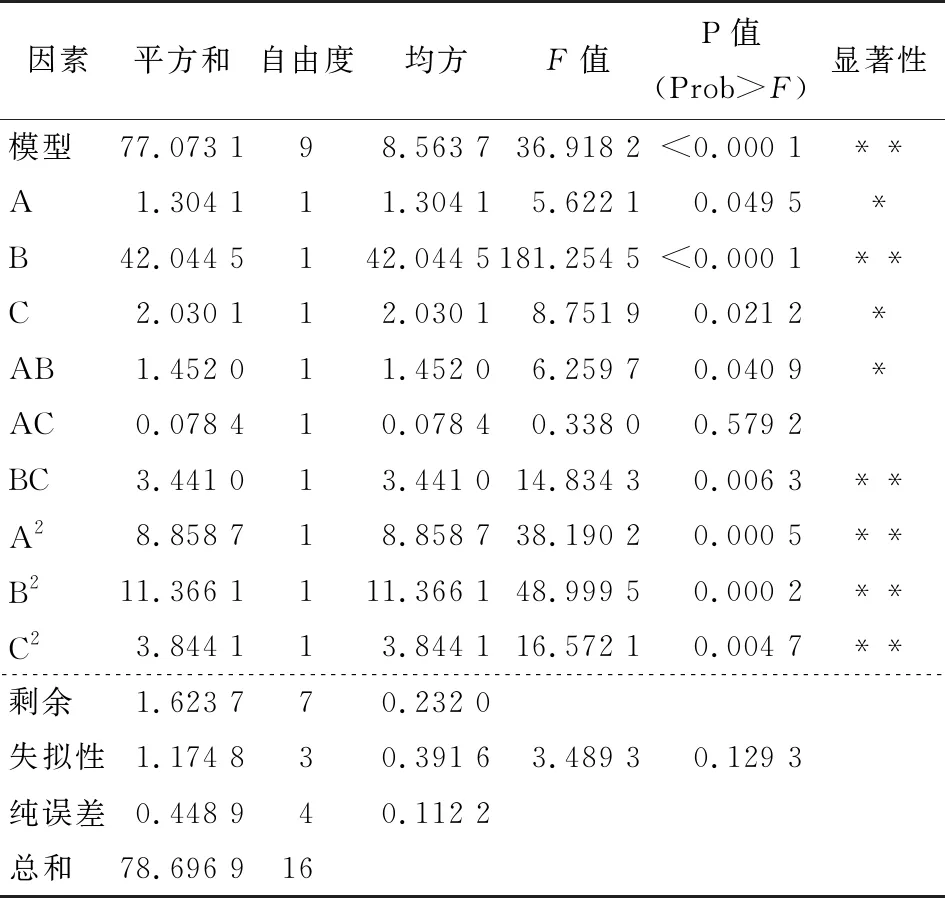
表6 综合指标方差分析表†
图3为综合指标的等高线图和三维响应面图。由图3(a) 可知,植酸和L-半胱氨酸的等高线图近似椭圆,说明交互作用显著[18]。植酸的等高线图为U形,说明植酸在浓度较低时,对综合评价指标有正效应,但在高浓度时,随植酸浓度的增加,要达到相同的综合指标值,需要增加L-半胱氨酸浓度,说明植酸在高浓度时对综合指标有负效应,与PB试验结果相符。由图3(c)可知,植酸和D-异抗坏血酸钠的等高线图近似圆形,说明交互作用不显著,而且植酸和D-异抗坏血酸钠在浓度较低时对综合指标有较好的作用,高浓度时二者均需要增加浓度才能维持相同的综合指标水平,可能是因为随浓度的增加,D-异抗坏血酸钠自身氧化褐变反应增强[19],而植酸浓度的增加降低了果汁pH值而促进抗坏血酸的氧化褐变。由图3(e)可知,D-异抗坏血酸钠与L-半胱氨酸等高线图近似椭圆,说明交互作用显著。D-异抗坏血酸钠的等高线图是向右上方倾斜的,即随D-异抗坏血酸钠浓度的增加,要维持同一综合指标水平,需要增加L-半胱氨酸浓度,说明D-异抗坏血酸钠在较低浓度下有较好的抑制效果,与前面结果吻合。
通过Design Expert 8.0软件,得到最优褐变抑制配方为L-半胱氨酸 0.972%、D-异抗坏血酸钠0.051%、植酸0.015%(均为质量分数),此条件下,综合评价指标为80.33。
为了验证回归模型的准确度与有效性,按以上抑制剂的最优复合配制条件(为实际操作方便,取L-半胱氨酸 0.97%、D-异抗坏血酸钠0.05%、植酸0.015%),进行3次平行实验,实际检测抑制率为81.39%,多酚保全率为85.76%,·OH清除率为63.61%,综合评价指标为80.27,实验值与验证值的误差为0.07%,说明回归模型较好拟合了最优配方的抑制实验。

图3 综合指标的等高线及响应面图Figure 3 Contour line and response surface diagram of aggregative indictor
3 结论
通过应用 PB试验选出单因素试验中的显著效应抑制剂和爬坡试验设计等方法,确定野木瓜汁的最佳复配抑制剂配方为:L-半胱氨酸 0.97%、D-异抗坏血酸钠0.05%、植酸0.015%。该优化条件下实测的褐变抑制率可达81.39%,多酚保全率为85.76%,·OH清除率为63.61%。
研究虽然证实不使用亚硫酸盐和EDTA,只用较低浓度且对人体无害的抑制剂就可达到较好的褐变抑制效果,并能够较好地保全野木瓜果汁的多酚成分和·OH清除功效,但仍需要进一步通过果汁的贮藏试验确定在贮藏过程中的非酶褐变抑制效果,同时对野木瓜果汁主要成分在褐变中的作用及其反应底物进行研究。在果汁营养保全方面还需对果汁中的其他主要营养成分如氨基酸、多糖等的变化进行研究,并全面测试其抗氧化功效。

