基于生物信息学分析RSK1在乳腺癌中的表达及其预后预测价值
刘司南 龙云祥 高洁 王铮, 刘昌, 黄启超 林婷
乳腺癌是女性最常见的恶性肿瘤之一,居全球癌症相关性死亡原因的第二位[1]。因此,对乳腺癌患者总体预后的研究有重要意义,其中循环肿瘤标志物在乳腺癌复发和预后中的价值也成为研究的方向之一[2]。核糖体 S6蛋白激酶(ribosomal S6 protein kinase,RSK)家族是细胞外信号调节激酶/丝裂原活化蛋白激酶(ERK/MAPK)的重要效应因子,可调节细胞迁移、增殖和存活等关键过程[3]。有研究发现RSK1具有抗癌和促癌双重作用。然而,RSK1在乳腺癌中的作用尚存争议[4]。ZHAO 等[5]检测 RSK1、RSK2 和RSK3蛋白在乳腺癌中的表达情况,发现RSK1在乳腺癌组织中低表达。然而,SMITH等[6]研究却发现,与非肿瘤组织相比,乳腺肿瘤组织中RSK1表达水平升高约50%。而且目前RSK1对乳腺癌患者总体预后影响的相关研究较少。本研究通过基于大样本乳腺癌基因组及蛋白组学数据,分析RSK1 mRNA和蛋白表达水平对乳腺癌患者总体预后的影响,探讨其作为乳腺癌总体预后标志物的可行性。
1 资料与方法
1.1 一般资料
乳腺癌患者基因表达相关数据来源于TCGA-BRCA数据集及GEO数据集。其中,TCGA数据通过TCGAAssembler 2.0.6软件从癌症和肿瘤基因图谱(The Cancer Genome Atlas,TCGA)数据库(https://tcga-data.nci.nih.gov/tcga/)下载,共纳入1 089例乳腺癌患者RNA-seq测序结果,其中女性1 077例,男性12例;中位年龄58岁(范围:49~68岁);Ⅰ~Ⅱ期 800例(73.5%),Ⅲ~Ⅳ期266例(24.4%)。GEO数据集共纳入9个独立研究(GSE20685、GSE3494、GSE7390、GSE1456、GSE45255、GSE16446、GSE42568、GSE20711 和 GSE37946),共计1 393例乳腺癌样本。上述9个GEO数据集均基于Affymetrix基因芯片平台。同时,从TCGA-RPPA蛋白表达数据库中获得RSK1蛋白表达数据。从Protein Atlas数据库获取肿瘤以及正常组织中RSK1蛋白免疫组化染色数据。
从TCGA和GEO数据库中提取患者基本信息、总生存期(overall survival,OS)以及生存状态。去除生存时间不正确或缺失数据,以及非乳腺癌患者数据,最终将上述临床信息与乳腺癌标本生物学数据匹配。以RSK1表达中位数作为截点值将患者分为RSK1高表达组和低表达组,比较两组患者总体预后。
1.2 统计学分析
采用Stata 15.0软件进行数据分析。分类数据采用n(%)表示。分类资料的组间比较采用χ2检验或Fisher精确概率法。生存曲线分析采用Kaplan-Meier,组间比较采用Log-rank检验。采用Cox回归模型分析RSK1与乳腺癌患者OS的关系,并计算风险比(HR)及其对应的95%可信区间(CI)。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 基于Protein Atlas数据库分析RSK1蛋白在乳腺癌组织中的表达
Protein Atlas数据库的RSK1免疫组化染色结果显示,RSK1蛋白主要表达于乳腺上皮细胞,并且在乳腺癌组织中表达水平较低,见图1。
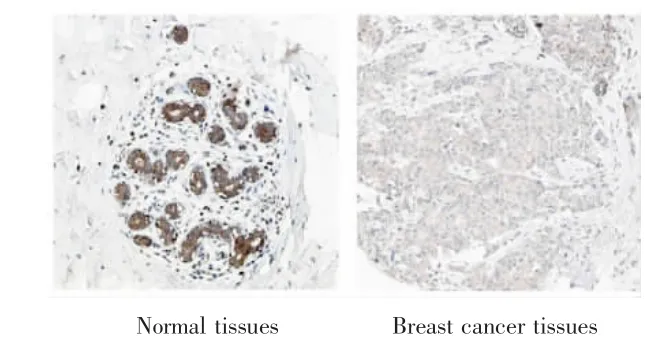
图1 RSK1蛋白在乳腺癌组织和正常组织中的表达Fig.1 Expression of RSK1 protein in breast cancer tissues and normal tissues
2.2 基于TCGA数据库分析RSK1 mRNA以及蛋白表达水平与乳腺癌总体预后的关系
2.2.1 RSK1 mRNA表达与患者临床病理特征的关系 以OS为终点事件,以RSK1 mRNA表达中位数9.89为截断值将患者分为RSK1 mRNA低表达组(545例)和RSK1 mRNA高表达组(544例)。其中RSK1 mRNA表达与患者的HER2基因表达水平及N分期(区域淋巴结转移)有关(P<0.05),而与性别、年龄、临床分期、病理类型等均无关(P>0.05),见表 1。
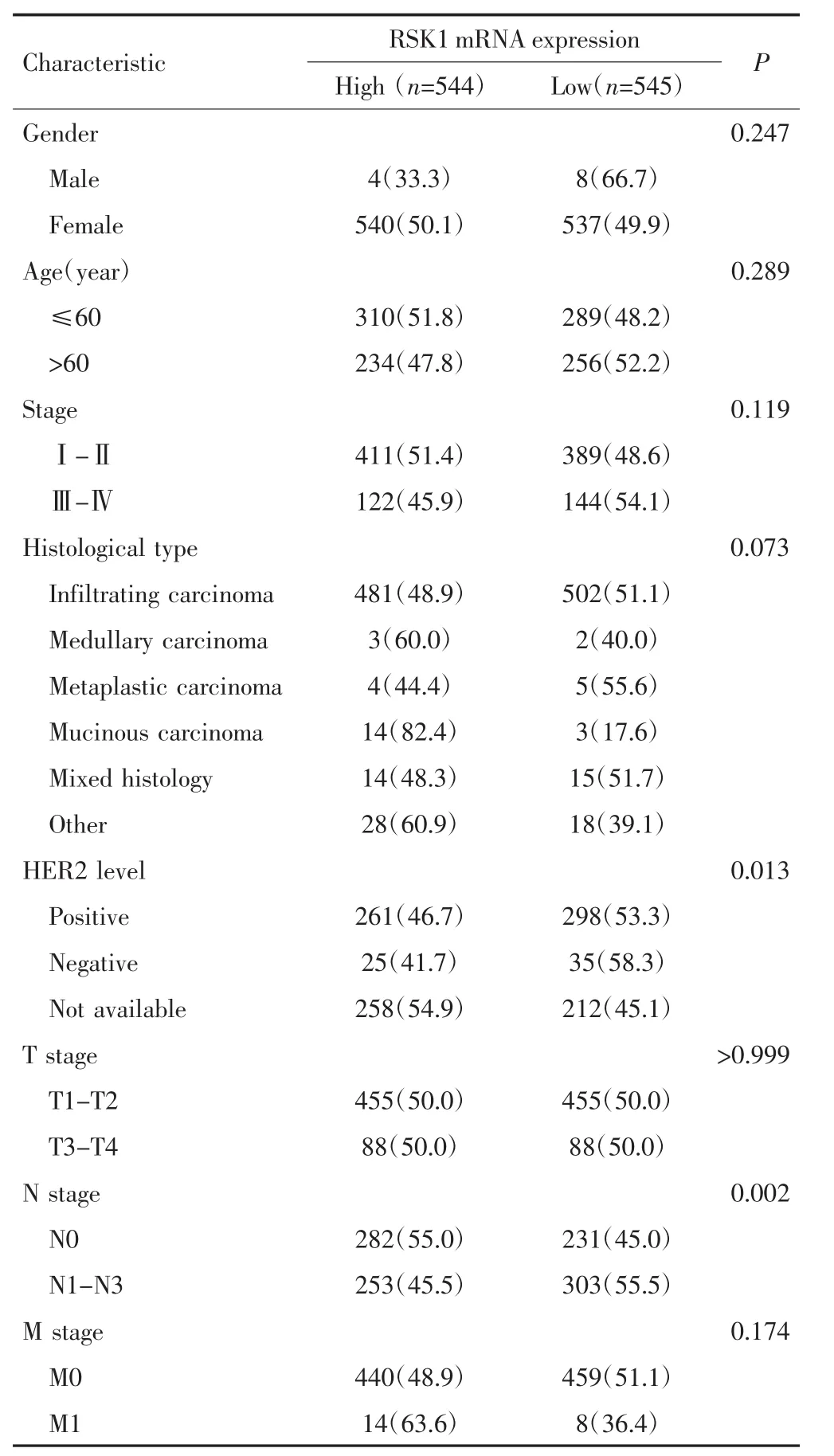
表1 RSK1 mRNA表达与乳腺癌患者临床病理特征的关系[n(%)]Tab.1 Relationship between RSK1 mRNA expression and clinicopathological characteristics of breast cancer patients[n(%)]
2.2.2 生存分析 基于TCGA-BRCA数据库的生存分析结果显示,RSK1 mRNA高表达和低表达乳腺癌患者的中位生存时间分别为148.5个月和113.6个月,高表达患者总体预后较好(HR=0.650,95% CI:0.47~0.89,P=0.007),见图2A。进一步分层分析发现,女性、年龄≤60岁、Ⅰ~Ⅱ期、浸润性乳腺癌、无区域淋巴结转移(N0)以及无远处转移(M0)的患者RSK1 mRNA高表达时预后较好,见表2。基于TCGA-RPPA数据库分析407例有RSK1蛋白表达数据的乳腺癌患者总体预后信息,结果显示,RSK1蛋白高表达患者的总体预后优于RSK1低表达患者(HR=0.49,95% CI:0.27~0.89,P=0.011),见图 2B。
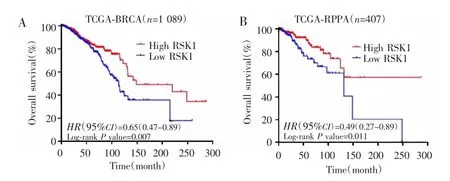
图2 RSK1表达与乳腺癌总体预后的关系Fig.2 Relationship between RSK1 expression and overall survival in patients with breast cancer
基于TCGA-BRCA以及TCGA-RPPA数据库分别对早期(Ⅰ~Ⅱ期)和晚期(Ⅲ~Ⅳ期)患者RSK1 mRNA和蛋白表达与总体预后的关系进行分层分析。结果显示,早期患者中RSK1 mRNA高表达组总体预后较好(HR=0.61,95% CI:0.39~0.95,P=0.025);RSK1 蛋白高表达组总体预后亦优于低表达组(HR=0.43,95% CI:0.22~0.84,P=0.008)。而晚期乳腺癌患者中,RSK1 mRNA和蛋白高表达和低表达患者的总体预后比较差异无统计学意义(HR=1.03,95% CI:0.74~1.43,P=0.87;HR=0.89,95% CI:0.45~1.74,P=0.72)。
2.2.3 RSK1 mRNA与乳腺癌患者OS的关系 单因素Cox回归分析结果显示,年龄、临床分期、T分期、N分期、RSK1 mRNA表达水平与乳腺癌患者OS有关(P<0.05)。多因素Cox回归分析结果显示,年龄>60岁(HR=2.149,95% CI:1.487~3.108,P<0.001)、临床分期Ⅲ~Ⅳ期(HR=2.663,95% CI:1.547~4.586,P<0.001)是影响乳腺癌患者OS的危险因素,而RSK1 mRNA高表达(HR=0.621,95% CI:0.425~0.907,P=0.014)是影响乳腺癌患者OS的保护因素。见表3。
2.3 基于GEO数据库分析RSK1 mRNA与乳腺癌总体预后的关系
9个GEO芯片数据荟萃分析显示,RSK1 mRNA高表达组患者总体预后较好(HR=0.69,95% CI:0.56~0.86,P=0.002),与TCGA-BRCA数据分析结果一致。对GEO数据库中的9个数据集分别进行生存分析,结果显示7项研究中高表达RSK1的患者预后较好,但只有样本量大于300的GSE20685研究差异有统计学意义。而GSE1456数据和GSE16446数据研究中高表达患者的预后较低表达者差(HR=1.38,95% CI:0.73~2.63,P=0.304;HR=8.40,95% CI:2.96~23.9,P=0.012)。见图3~4。
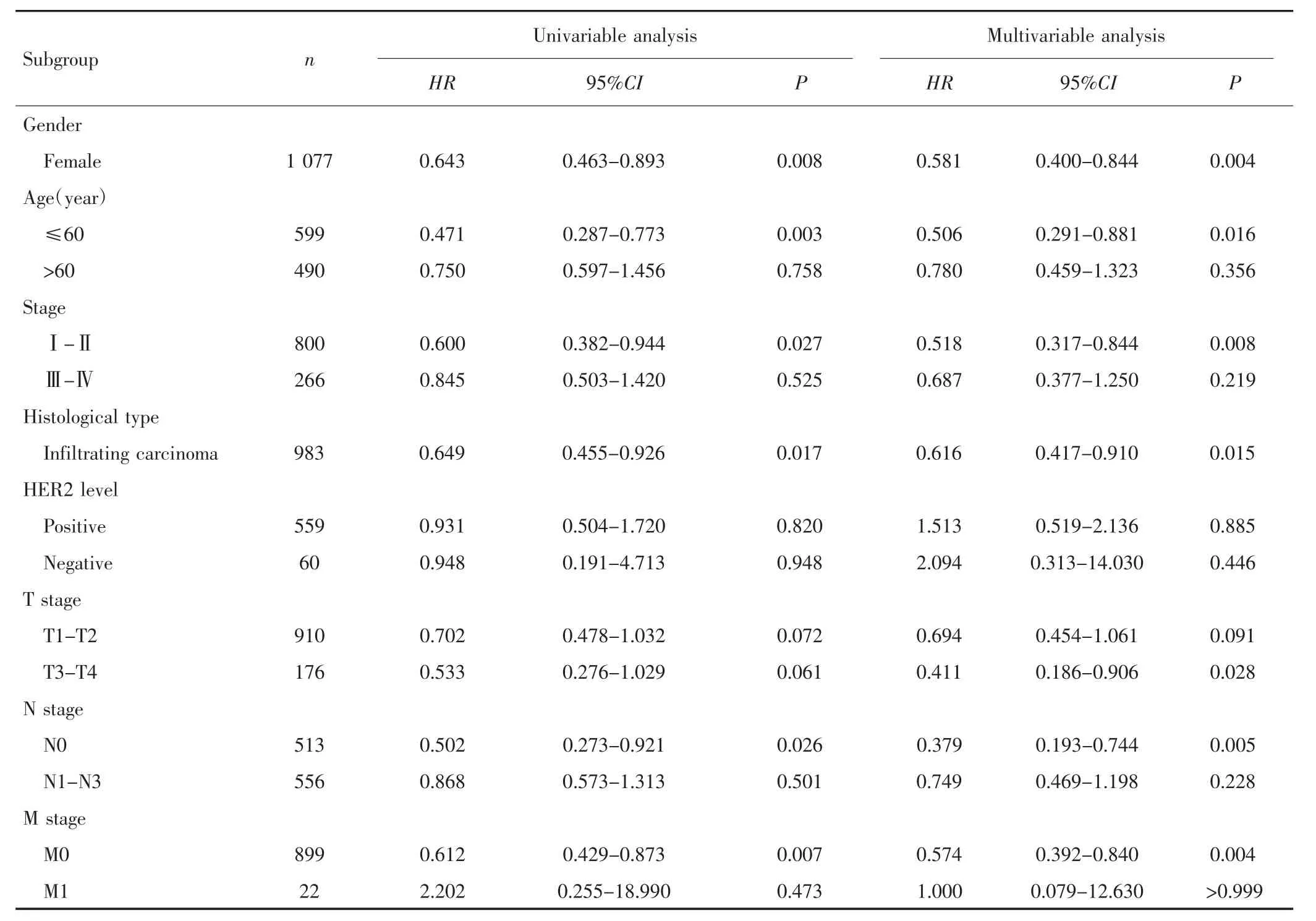
表2 乳腺癌患者RSK1 mRNA表达与OS的分层分析Tab.2 Stratified analysis of RSK1 mRNA expression and OS in breast cancer patients
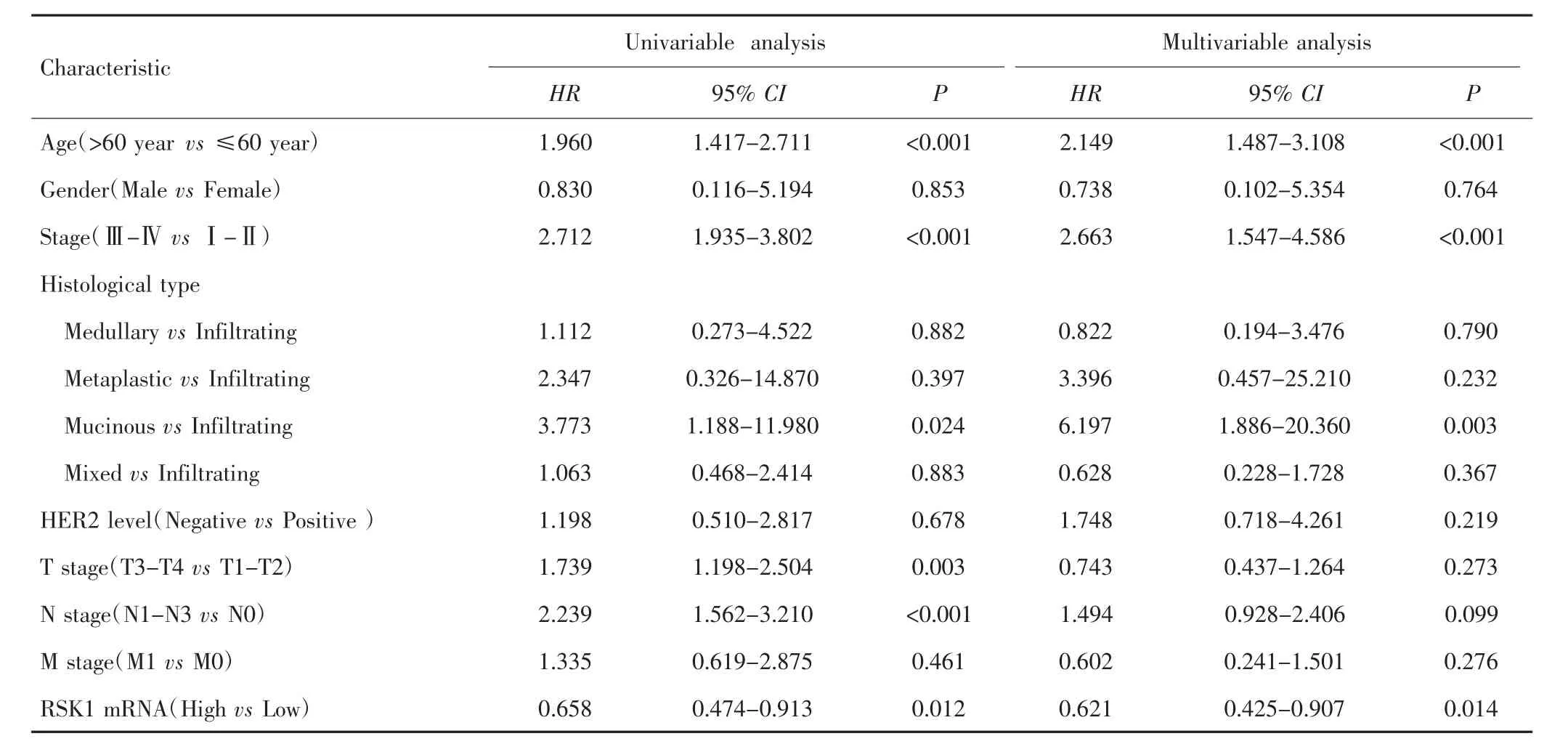
表3 影响乳腺癌患者OS的单因素及多因素分析Tab.3 Univariable and multivariable analysis of prognostic factors for OS in breast cancer patients
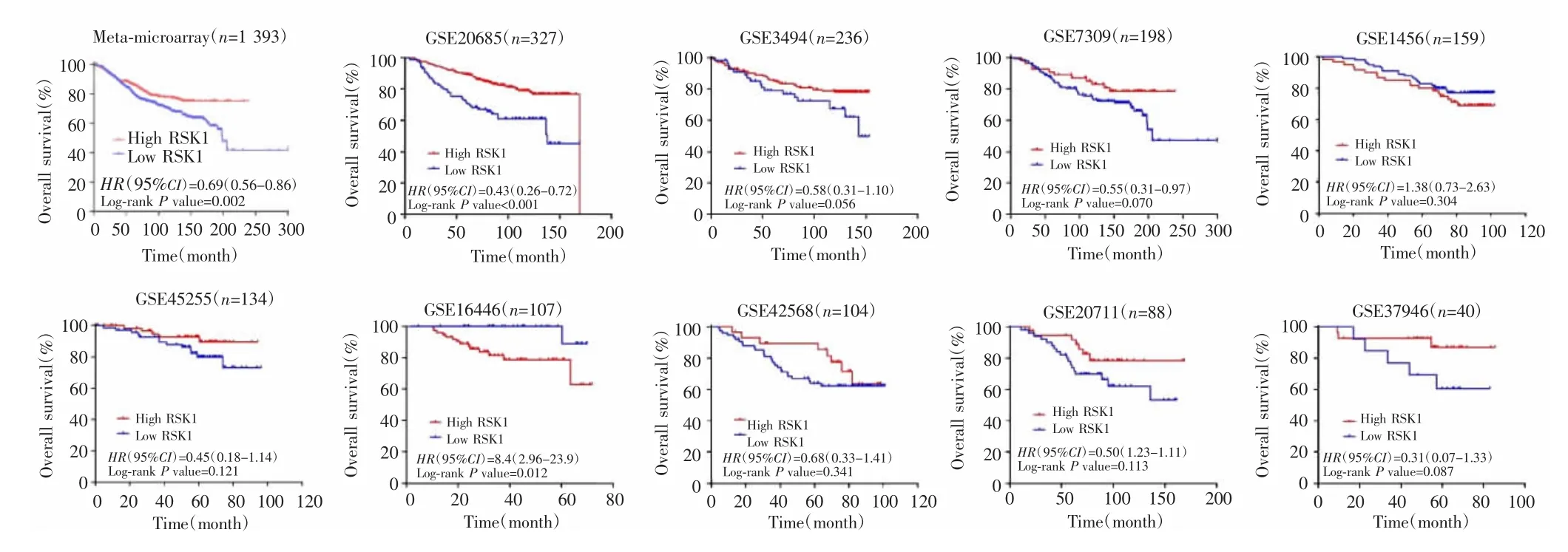
图3 GEO数据库中RSK1 mRNA表达与乳腺癌预后的关系Fig.3 Relationship between the expression of RSK1 mRNA and the prognosis of breast cancer in the GEO database
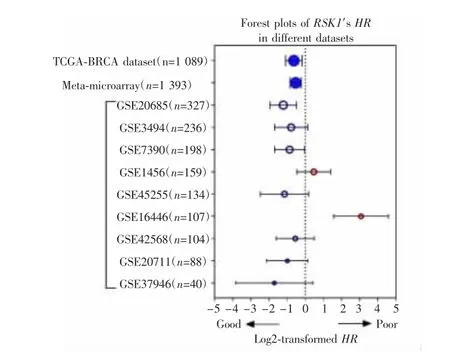
图4 RSK1 mRNA表达与乳腺癌预后的关系Fig.4 Relationship between the expression of RSK1 mRNA and the prognosis of breast cancer
3 讨论
RSK 家族包括 RSK1、RSK2、RSK3 和 RSK4,其中,RSK1-3 mRNA在所有细胞系和组织中表达,而RSK4 mRNA主要在胚胎发育过程中表达[3]。该家族具有高度保守的功能基序和序列同源性,含有N端激酶结构域(NTKD)和C端激酶结构域(CTKD),前者可调节RSK的激活,而后者负责底物磷酸化。RSK可调节多种与细胞存活、生长和增殖有关的底物,但是既往研究中关于RSK1在乳腺癌中的作用并不一致。部分研究显示RSK1发挥促癌作用,CZAPLINSKA等[7]构建三阴性乳腺癌小鼠模型,观察肿瘤的生长和肺转移的形成情况,结果35 d后发现所有接种对照细胞的小鼠均成瘤,而在注射RSK1阴性细胞组中仅有75%的荷瘤小鼠,且RSK1阴性小鼠的平均肿瘤质量明显较阳性小鼠降低(0.37 g vs 1.16 g,P<0.0001),RSK1阴性小鼠在肺表面的转移灶亦减少了约85%(P<0.001),说明RSK1促进了不依赖锚定的细胞生长和迁移。LUDWIK等[8]在三阴性乳腺癌研究发现中,癌细胞增殖、存活和运动均需要RSK的参与,沉默或抑制RSK1可抑制癌细胞在体内的转移和定植。后续研究中报告了一种新型RSK1/2抑制剂SL0101类似物,认为沉默RSK1和RSK2可进一步抑制三阴性乳腺癌细胞系存活或增殖能力。还有研究发现在基底样乳腺癌中,RSK1可激活Y-Box结合蛋白-1(Y-box binding protein-1,YB-1)[9],而 YB-1 已被证明在基底样乳腺癌中的表达比例较高[10],且与乳腺癌高复发率有关[11],在乳腺癌细胞中过表达可导致单层细胞增殖和锚定非依赖性生长增强[12]。此外,还有研究发现,靶向抑制RSK可通过灭活三阴性乳腺癌中的YB-1消除肿瘤起始细胞,从而抑制肿瘤生长[13]。然而,也有相关研究认为RSK1具有抗肿瘤作用。LARA等[14]报道RSK1是非小细胞肺癌进展的负调节剂,在继发性病变与原发性病变中,RSK1表达降低,且敲低RSK1可增强细胞迁移能力(RSK2和RSK4的敲低具有相反作用),并导致A549肺癌细胞在体内形成转移。ZHAO等[5]发现乳腺癌组织中RSK1表达下调,且RSK1转录水平与肿瘤等级、TNM分级和分期呈负相关。本研究基于TCGA、GEO以及Protein Atlas数据分析RSK1在乳腺癌中的表达及其预后预测价值。免疫组织化学染色结果显示乳腺癌组织中RSK1蛋白表达水平低于正常乳腺组织,且TCGA数据库分析RSK1 mRNA表达与患者临床病理特征的关系,发现RSK1 mRNA表达与HER2基因表达水平及N分期(区域淋巴结转移)有关,且高表达患者的预后较好,进一步的Cox回归分析同样显示RSK1 mRNA高表达是预后的保护因素。进一步分层分析亦发现在女性、年龄≤60岁、Ⅰ~Ⅱ期、浸润性乳腺癌、无区域淋巴结转移(N0)以及无远处转移(M0)患者中RSK1 mRNA高表达是保护因素。基于TCGA-RPPA数据库分析RSK1蛋白高低表达患者的生存情况,也支持RSK1高表达是乳腺癌预后的保护因素这一结论。因此认为,RSK1有望成为乳腺癌患者预后预测的标志物。
但是,本研究结论与上述部分研究[7-14]结果有所差异,分析可能原因是上述研究更多为基础实验探索,同时缺乏大样本临床研究验证,因此可能导致以往研究未发现RSK1对乳腺癌总体预后评估的价值。本研究中纳入的 7 项(GSE20685、GSE3494、GSE7390、GSE45255、GSE42568、GSE20711 和 GSE37946) 研究均支持高表达RSK1是乳腺癌总体预后保护因素,但是也只有样本量大于300例的GSE20685研究得到统计学阳性结果,一定程度上也说明样本量可能是造成阴性结果的原因。本研究还发现RSK1高表达可作为早期乳腺癌患者的预后保护因素,而在晚期患者中,RSK1低表达组预后较好,但也未能得到阳性的统计学结果。因此,尽管本研究基于大样本进行数据分析,但是纳入的乳腺癌样本大部分基于欧美人群,且单一指标对乳腺癌总体预后评估有限,同时也还缺乏大样本的临床数据验证,因此本研究结果是否适用于我国乳腺癌患者,以及后期联合其他指标是否能进一步提高总体预后评估价值仍需进一步研究。

