当归芍药散改善APPswe/PS1ΔE9 转基因小鼠学习记忆能力及机制研究
李富周,贺春香,余婧萍,宋祯彦,李 平,成绍武*
(1.湖南中医药大学,湖南 长沙410208;2.中西医结合心脑疾病防治湖南省重点实验室,湖南 长沙410208)
阿尔茨海默病(Alzheimer's disease, AD)是一种致死率、致残率很高的神经退行性疾病,主要临床特征表现为空间学习、记忆力障碍。 据统计,我国已经有超过500 万AD 患者[1]。 AD 的发病机制尚未明确,目前尚无明确有效的干预治疗药物。随着我国人口老龄化加剧,阐明AD 具体的发病机制及寻求新的治疗靶点已成为亟待解决的焦点、难点问题。
细胞外β-淀粉样蛋白(β-amyloid protein, Aβ)沉积是AD 的主要病理特征[2]。 研究认为Aβ 的过量分泌和异常聚集都会影响神经细胞的正常生理功能,进而造成AD 的发生与发展[3]。特别是Aβ 寡聚体的大量聚集易引起突触功能障碍,促使神经元丢失,从而导致AD 的发生[4]。近年来发现Aβ 和APP 裂解产物(如AICD)能通过调节甲羟戊酸途径相关酶的活性影响蛋白异戊二烯化修饰促进AD 的发生与发展[5]。 蛋白质的异戊二烯化修饰包括法尼基化(farnesylation, FPP)和香叶基化两种,胆固醇从头合成的甲羟戊酸途径中非固醇类异戊二烯中间产物,包括法尼基焦磷酸(farnesyl pyrophosphate, FPP)和香叶基香叶基焦磷酸,分别经过法尼基蛋白转移酶(farnesyl transferase, FT)和香叶基蛋白转移酶I 和II 的催化修饰相应蛋白的C 末端。 最新研究表明,类异戊二烯化合物产生和蛋白异戊二烯化修饰改变与多种疾病有关,包括心血管和脑血管疾病、癌症、骨骼疾病、早衰和AD 等疾病[6]。 其中蛋白FPP修饰与AD 发病密切相关,有报道称,AD 患者大脑中FPP 的水平显著升高[7]。且FPP 可通过刺激γ-分泌酶促进Aβ 的产生[8]。 同时,通过基因沉默技术或药物抑制FT 活性可降低AD 模型小鼠Aβ 水平,从而改善其认知功能[9]。 因此,FT 可能是AD 防治药物的靶点之一。
当归芍药散(Danggui Shaoyao San, DSS)由当归、芍药、茯苓、白术、泽泻、川芎6 味药组成[10],出自张仲景的《金匮要略》。大量研究发现DSS 具有神经保护作用,且在预防和治疗老年痴呆上具有很好的临床疗效,但具体机制有待进一步研究。 本研究以APPswe/PS1ΔE9双转基因(APP/PS1)小鼠 为模型,探讨DSS 对学习记忆能力、Aβ 表达及FT 水平的影响,为其开发和临床应用提供科学依据。
1 材料与方法
1.1 实验动物
SPF 级APP/PS1 双转基因小鼠30 只,6 月 龄,体质量(20±5) g,由北京华阜康生物科技有限公司提供,许可证号为SCXK(京)2014-0004;同月龄的C57BL/6 野生型小鼠10 只,购自湖南斯莱克景达实验动物有限公司,许可证号为SCXK(湘)2015-0010,小鼠饲养于湖南中医药大学第一附属医院SPF级动物实验室;室内温度20~24 ℃,相对湿度35%~45%,室内光线12 h 明暗交替,所有实验过程对动物处置符合动物伦理学要求。
1.2 药品与试剂
1.2.1 实验药品 DSS 根据《金匮要略》按当归(Angelica sinensis)、白芍(Cynanchum otophyllum)、茯苓(Wolfiporia cocos)、白术(Atractylodes macrocephala Koidz)、泽泻(Alisma plantago-aquatica Linn)、川芎(Ligusticum chuanxiong Hort)6 味药(3∶16∶4∶4∶8∶8)组方,所有药材均购置于湖南中医药大学第一附属医院药剂科,并由药剂科鉴定为正品;依据成人用量称取当归芍药散200 g,经水煎法提取并浓缩冷冻备用[11],调整至含生药浓度2.0 g/mL。 通过高效液相色谱法检查提取液中阿魏酸、芍药苷和茯苓酸含量分别为127.6、6081.8、14.7 μg/g。
1.2.2 主要试剂 DNA 提取试剂盒(DP304,TIAN GEN 公司);RNA 提取试剂盒(DP431,TIAN GEN公司);引物由华大基因根据引物序列合成(见表1);反转录cDNA 试剂盒(RR820L,日本TaKaRa 公司);SYBR Premix Ex Taq II 染料(RR047A, 日本TaKaRa公司);Aβ-6E10 鼠单克隆抗体(B247600)购自BioLegend 公 司;Alexa 488 标 记 山 羊 抗 鼠IgG(H+L)(1562298,Molecular Probes);通用二步法检测试剂盒(PV9000,北京中杉金桥生物技术有限公司);蛋白质法尼基转移酶抑制剂FTI-277(F9803,Sigma-Aldrich 公司)。
1.3 主要仪器
多功能酶标仪(美国BioTek 公司);Real-time PCR系统(BIO-RAD 公司);生物显微镜(Motic);激光共聚焦显微镜(Nikon);低温高速离心机(Henle Labortechnik);电脑生物包埋机(浙江金华科迪仪器设备有限公司);石蜡切片机(HistoSTAT)。
1.4 方法
1.4.1 分组及给药 将30 只APP/PS1 小鼠随机分为药物组、模型组和阳性药物对照组,每组10 只;10只C57BL/6 野生型小鼠作为正常对照组。药物组给予DSS 灌胃,给药剂量依据成人临床等效剂量,按以下公式计算:小鼠剂量(g/kg)=9.1×[成人剂量(g)/成人体质量(70 kg)],小鼠给药量约为26 g/(kg·d),阳性药物对照组给予腹腔注射法尼基转移酶抑制剂FTI-277,小鼠剂量为25 mg/(kg·d)[12],每天中午11:00定时进行灌胃给药及阳性药物腹腔注射,连续30 d;模型组和正常对照组小鼠均给予等量的生理盐水灌胃。
1.4.2 水迷宫实验检测APP/PS1 小鼠学习记忆能力 给药30 d 后,进行水迷宫实验,采用SMART 3.0 小鼠水迷宫视频分析系统,水迷宫实验为6 d,前5 d 进行定位航行实验,将小鼠头朝池壁依次放入第一、二、三、四象限固定起始位置,其中第二象限为小鼠站台所在的目标象限,记录小鼠60 s 内找到隐蔽于水面下的站台时间,此段时间称为逃避潜伏期;第6 天除去站台,选择原站台位置对角线象限将小鼠头朝池壁放入水中,进行空间探索实验。 空间探索实验结束2 h 后,将平台露出水面以使小鼠能够看见平台,测试动物的游泳能力和视力,校正前面两部分的实验结果,此为可视平台实验。测试时室内安静,物品陈设、照明度一致。
1.4.3 动物取材 最后一次给药后2 h,给予10%水合氯醛腹腔注射麻醉,给予常规消毒,开胸,用预冷的PBS 经心脏灌注,待血液完全排除后进行断头,在冰板上进行开颅取材。 取小鼠大脑组织,用刀片将其分为左右脑,右脑固定在4%的多聚甲醛中备用,取左脑在冰上分离大脑皮质、海马及其余脑3部分,液氮速冻后,放-80 ℃冰箱冻存备用。
1.4.4 石蜡切片 小鼠右脑组织固定于4%的多聚甲醛静置48 h,依次经75%、85%、95%、100%乙醇脱水,二甲苯透明剂透明,浸蜡,石蜡包埋。 切片,摊片至载玻片上后烤箱烘干备用。
1.4.5 免疫组化检测脑内海马区Aβ 的水平 选备用的石蜡切片,各组10 只小鼠,每只选3 张切片,60 ℃恒温箱中烤片5 h,放入二甲苯Ⅰ15 min、二甲苯Ⅱ15 min、100%乙醇3 min、95%乙醇3 min、85%乙醇3 min、75%乙醇3 min、流水1 次。 内源性过氧化物酶阻断后,将切片放入90%蚁酸处理5 min,PBS 洗3 次,每次5 min。 5%马血清封闭10 min 后滴加Aβ 源单抗6E10(1∶500),4 ℃冰箱孵育过夜。 次日PBS 洗3 次,每次5 min;滴加生物素标记的山羊抗鼠二抗(1∶1 000)常温孵育1 h,PBS 洗3 次,每次2 min;滴加ABC 液常温孵育20 min。 PBS 洗3 次,每次5 min,加DAB 显色,显微镜下观察显色结果,自来水终止反应;苏木素复染:3 min,水洗;盐酸乙醇分色,自来水中促蓝;放入75%、85%、95%、100%乙醇各2 min 梯度脱水;二甲苯透明5 min,中性树胶封片,常温晾干。每张切片随机选取4 个视野,在10 倍物镜下采集图像,使用ImageJ 8.0 分析图像,测量累计光密度值IOD 和图像面积(Area),用IOD/Area 所得平均光密度MOD 进行下一步统计分析。
1.4.6 免疫荧光检测脑内海马区Aβ 斑块沉积数量 免疫荧光方法操作步骤基本同免疫组化,一抗使用β-淀粉样蛋白鼠源单抗6E10(1∶500)于4 ℃孵育过夜, 二抗使用Alexa 488 荧光标记山羊抗小鼠IgG(H+L)(1∶600)常温孵育1 h,用含抗荧光淬灭剂的封片液封片。每只动物取3 张切片,每张切片在荧光显微镜下随机选取4 个视野,在40 倍物镜下采集图像,使用ImageJ 8.0 分析图像,计数脑内海马区Aβ 斑块沉积数目(个/视野)。 取4 个视野的算术平均数,并计算各组均数及标准差进行统计分析。
1.4.7 qPCR 检测海马组织FT 基因表达水平 使用Trizol 法提取海马区组织总RNA,按照逆转录cDNA试剂盒说明书将总RNA 逆转录成cDNA。 使用伯乐公司CFX96 Real-time PCR 系统采用SYBR 染料法进行Real-time PCR 检测,qPCR 条件:变性(95 ℃,5 min),变性(95 ℃,15 s)——退火(58 ℃,15 s)进行40 次循环,每次退火完成读取荧光值,溶解曲线:65~95 ℃,所用引物序列见表1。 扩增完成后,以2-△△Ct计算实验组目的基因相对于对照组目的基因的变化倍数。
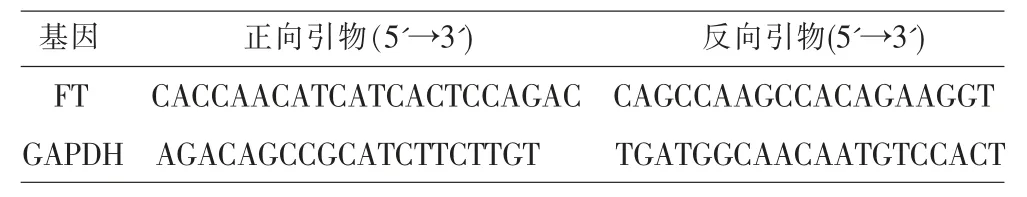
表1 引物序列
1.5 统计学处理
采用Prism Graphpad 6.0 进行数据统计与分析,计量资料“±s”表示,若各组数据满足正态分布和方差齐性,采用单因素方差分析法,若数据不满足正态性和方差齐性,采用Kruskal-Wall 检验,P<0.05为差异有统计学意义。
2 结果
2.1 DSS 对APP/PS1 小鼠学习记忆能力的影响
采用Morris 水迷宫实验检测各组小鼠学习记忆能力,如图1 所示。在5 d 的定位航行实验中,第1 天各组小鼠的潜伏期无差异,但随着训练次数的增加,平均潜伏期时间总体呈下降趋势;从第2 天到第5 天实验的潜伏时间,模型组小鼠较正常对照组寻找平台时间明显延长(P<0.05);与模型组比较,DSS 治疗后能显著缩短APP/PS1 小鼠逃避潜伏期(P<0.05),且阳性药物也能显著缩短小鼠逃避潜伏期,差异具有统计学意义(P<0.05)(图1A)。第6 天空间探索实验中,模型组较正常对照组穿越平台次数明显减少(P<0.05),DSS 药物组和阳性对照组均比模型组小鼠穿越平台次数多,差异具有统计学意义(P<0.05)(图1B)。 而可视平台实验中,实验各组动物表现出相似的行为,差异无统计学意义(图1C)。
2.2 DSS 对APP/PS1 小鼠海马区Aβ 水平的影响
APP/PS1 小鼠大脑海马区Aβ 聚集明显,染色后呈现褐色团块状淀粉样斑块沉积,在海马区相同视野下,采用IOD/Area 所得平均光密度进行统计分析。 阳性对照组和药物组小鼠大脑海马区Aβ 聚集较模型组明显降低,差异具有统计学意义(P<0.05)。正常对照组小鼠未出现Aβ 聚集。 见表2 和图2。
2.3 DSS 对APP/PS1 小鼠海马区Aβ 斑块沉积数量的影响
老年斑主要由Aβ 构成,且具有神经毒性,其形状和大小不同。免疫荧光标记Aβ 斑块结果显示,模型组小鼠海马区出现大量的Aβ 斑块聚集,且散在分布。 阳性对照组与药物组老年斑形成数量显著低于模型组,差异具有统计学意义(P<0.05)。见表3 和图3。
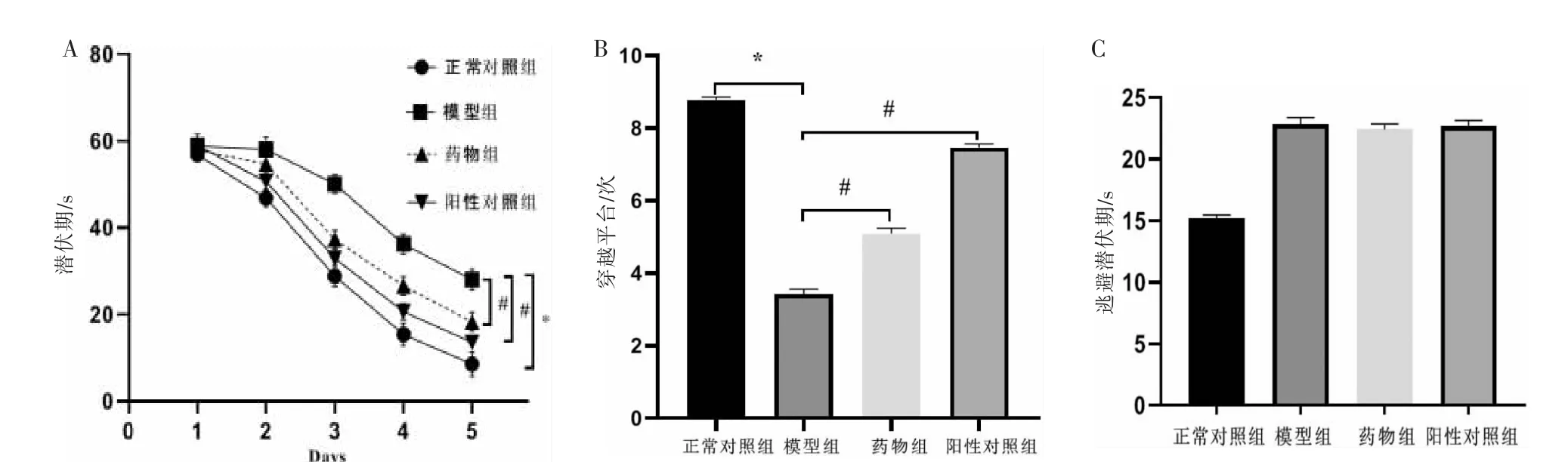
图1 Morris 水迷宫实验结果
表2 当归芍药散对APP/PS1 小鼠脑内海马区Aβ 水平的影响(±s,n=10)

表2 当归芍药散对APP/PS1 小鼠脑内海马区Aβ 水平的影响(±s,n=10)
注:与模型组比较,*P<0.05
组别正常对照组模型组药物组阳性对照组Aβ 水平(MOD)0 0.45±0.06 0.25±0.11*0.14±0.03*
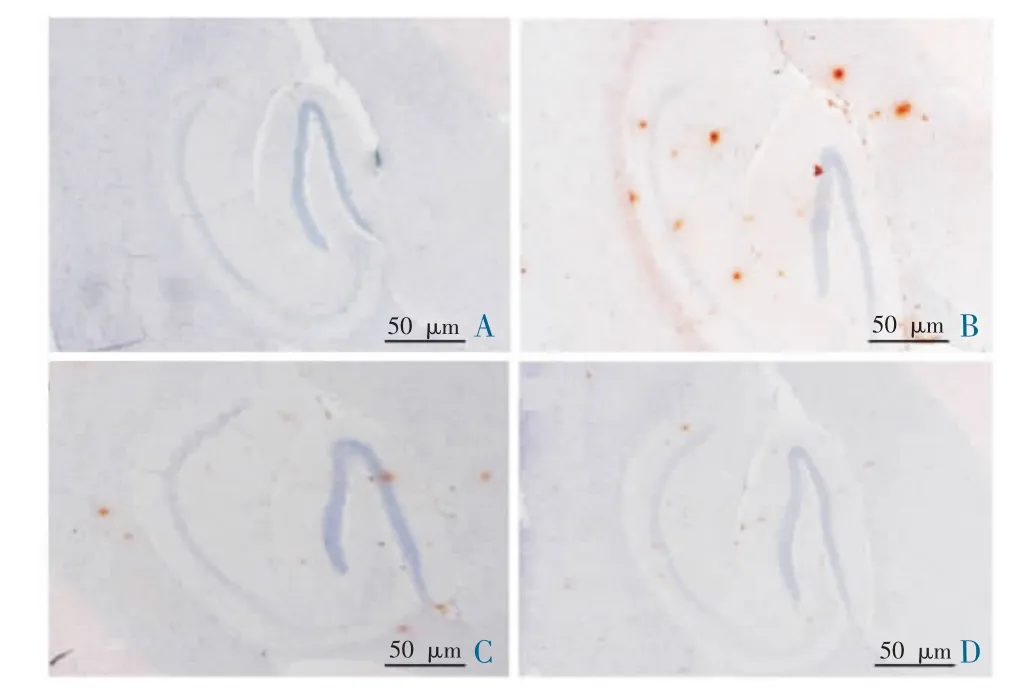
图2 各组小鼠脑内海马区Aβ 水平免疫组化检测代表性图(IHC,×40)
表3 当归芍药散对APP/PS1 转基因鼠脑内海马区老年斑形成的影响(±s,n=10)

表3 当归芍药散对APP/PS1 转基因鼠脑内海马区老年斑形成的影响(±s,n=10)
注:与模型组比较,*P<0.05
组别正常对照组模型组药物组阳性对照组老年斑数量/个0 25.16±1.87 14.42±1.35*6.13±0.76*
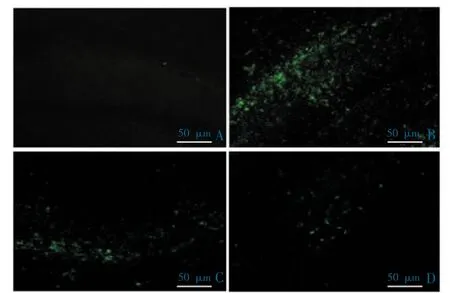
图3 各组小鼠脑内海马区Aβ 斑块沉积免疫荧光检测代表性图
2.4 DSS 对APP/PS1 小鼠海马区FT mRNA 水平的影响
qPCR 检测海马组织FT mRNA 表达结果显示,与正常对照组比较,模型组海马组织的FT mRNA水平明显升高,差异具有统计学意义(P<0.05);与模型组比较,药物组与阳性对照组海马组织的FT mRNA水平明显降低,差异具有统计学意义(P<0.05)。 见图4。
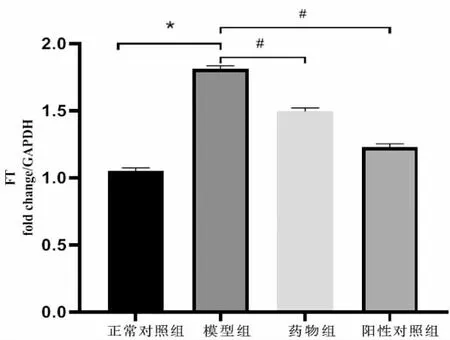
图4 qPCR 检测各组小鼠海马组织FT mRNA表达水平
3 讨论
AD 是痴呆性疾病中最常见的一大类,是一种隐性起病、进行性发展的中枢神经系统退行性疾病,表现为智力、记忆和人格的全面损害。 AD 的病理特征包括细胞外Aβ 沉积形成老年斑、细胞内tau 蛋白过度磷酸化引发神经原纤维缠结(neurofibrillary tangles, NTF)及突触丢失、神经炎症、神经细胞死亡[13]。AD 的发病机制尚未明确,而Aβ 的级联反应假说是对AD 发病机理的重要诠释[14]。 但目前尚未研发出明确有效的干预治疗药物,因此,有效药物的开发对AD的防治具有重大临床意义。
AD 属中医学“老年呆证”“文痴”“善忘”“癫证”“郁证”等范畴[15]。中医学认为,老年痴呆的病位在脑,且与心肝脾肾诸脏虚损有密切联系,但与肝联系尤为密切[16]。古人认为肝为五脏之贼,若肝血不足,母病及子则易致心血亏虚;若肝阴不足,子病及母则易致肾阴亏损,肝主疏泄能调畅脾胃气机,与血和津液的运行密切相关。水液代谢与血液运行失调所产生的痰饮瘀血是老年痴呆常见的致病因素[17]。因此,我们认为治肝为防治老年痴呆的第一要务。DSS 载于汉代张仲景《金匮要略》,由当归、白芍、茯苓、白术、泽泻、川芎6 味药组成,全方补泻兼施,泻中寓补,肝脾同调,血水并治。历代医家认为该方具有养血柔肝、健脾利湿等功效。 中医主治肝脾失调、气血郁阻证[18]。该方的特点为“调和肝脾,血水同治”,除了用于妇人腹痛外,临床上广泛应用于其它疾病治疗,如神经系统疾病、消化系统疾病、心血管疾病、皮肤病等,且疗效显著[19]。近年来,随着学者们对DSS的研究不断深入,发现DSS 具有很好的神经保护作用,能有效减少Aβ 的沉积[20]、突触损伤[21],且在预防和治疗老年痴呆上取得了较好的临床疗效,被认为是最适合用于防治AD 的经方之一[22]。 前期研究表明,DSS 能通过抗神经元细胞凋亡、抗炎来改善AD 的作用[23]。 同时DSS 能改善AD 模型鼠的学习记忆能力[24]。
本研究采用APP/PS1 小鼠为模型,该模型是AD病理改变比较成熟的模型之一[25]。 目前,AD 病因学的主要假设,诊断AD 的神经病理学指南以及大多数引人注目的治疗方法均是围绕Aβ 建立的[26]。 Aβ导致老年斑形成、NFT、神经细胞凋亡,且对神经系统具有毒性,损伤患者记忆力,从而导致AD 的发生。本研究采用Morris 水迷宫实验检测APP/PS1 模型小鼠的空间学习记忆能力,结果显示该模型鼠学习记忆能力受损。DSS 药物干预能缩短APP/PS1 小鼠逃避潜伏期和增加站台穿越次数,提示DSS 能改善AD 小鼠的认知功能。 同时,通过可视平台实验校正实验各组小鼠的游泳能力与视力差异,证实了DSS 改善AD 模型鼠认知功能结果的可靠性。而Aβ 是AD 发病的中心环节[27],减少Aβ 的产生和增强Aβ 的清除是防治AD 的重要靶点。 免疫组化检测结果显示DSS 干预能降低APP/PS1 小鼠脑内海马区Aβ 水平;免疫荧光也进一步表明它能减少脑内海马区老年斑的形成,提示DSS 能通过降低Aβ 水平有效改善AD 的认知功能,与其他学者研究结果一致[19-23]。
最新研究表明,异戊二烯化过程和APP/Aβ 代谢之间的联系存在相互性。异戊二烯化修饰蛋白在AD 的发病机制中发挥重要的作用,调节蛋白异戊二烯化水平能影响APP/Aβ 代谢[28]、tau 蛋白磷酸化[29]、神经炎症[30]、氧化应激[31]以及突触认知功能[32]等方面。 AD 患者脑内异戊二烯化修饰蛋白含量明显升高,而且蛋白法尼基化水平影响APP 的加工以及Aβ 的产生和分泌[33]。 同时,AD 病理产物Aβ 和其他APP 裂解产物(如AICD)能直接调节甲羟戊酸途径相关酶的活性,导致类异戊二烯化合物水平的改变影响异戊二烯化过程[6]。 最新研究表明,AD 患者脑内类异戊二烯中间产物FPP 水平显著升高,提示AD 患者脑内整体法尼基修饰水平已发生改变[34]。本课题组前期研究结果表明,AD 模型小鼠中FT 的基因杂合缺失,可以减轻其神经病理损害和改善其空间学习与记忆功能[9]。 本实验应用FT 特异性抑制剂干预,也能改善APP/PS1 小鼠的学习记忆功能和降低海马区域Aβ 水平,与前期结果一致。同时,DSS干预能降低APP/PS1 模型小鼠海马组织FT 的基因表达水平,提示DSS 可能通过影响蛋白法尼基修饰水平,降低Aβ 生成,改善认知功能。
综上所述,DSS 能改善APP/PS1 模型小鼠的认知功能和减轻其病理损伤,可能与调节蛋白FPP 修饰水平有关,但其具体作用机制尚需进一步研究。

