手性螺环配体及催化剂在不对称催化反应中的应用研究进展
许 聪,胡文浩
(广东省手性分子与药物发现重点实验室,广东省手性药物工程实验室,中山大学药学院,广州510006)
近年来,不对称合成反应一直是有机化学领域的研究热点,其中,金属参与的不对称催化反应是目前最高效的合成手性化合物的方法[1~3].利用极少量的金属和手性配体作为催化剂,诱导底物产生新的手性元素,从而获得大量的手性产品.在不对称催化反应中,手性配体的选择至关重要.手性配体不仅能调控中心金属的反应活性,促进反应的顺利进行,也能控制产物的空间构型,从而获得高纯度的光学活性化合物,因而在不对称催化反应中起到关键作用[4~7].设计合成结构新颖、高效通用的手性配体成为手性研究的前沿和重点,为新型手性催化剂的设计提供新思路,为不断挑战不对称催化新反应提供助力,极大地推动了不对称催化反应的发展.自1968年Knowles等[8]在Wilkinson催化剂中引入手性单膦配体并成功应用于催化氢化反应后,几千种新型结构的手性配体已经被设计合成出来,包括手性双膦配体、单膦配体、双氮配体和膦-氮配体等一系列单齿及多齿配体[9~13](图1),共同组成了手性催化的配体库,实现了许多不对称催化的新反应.在众多的手性配体中,具有C2-对称的手性螺环配体具有突出的优势和广泛的应用[14~19],已经发展成为不对称催化领域公认的“优势配体”,并广泛应用于手性药物和天然产物的合成中.
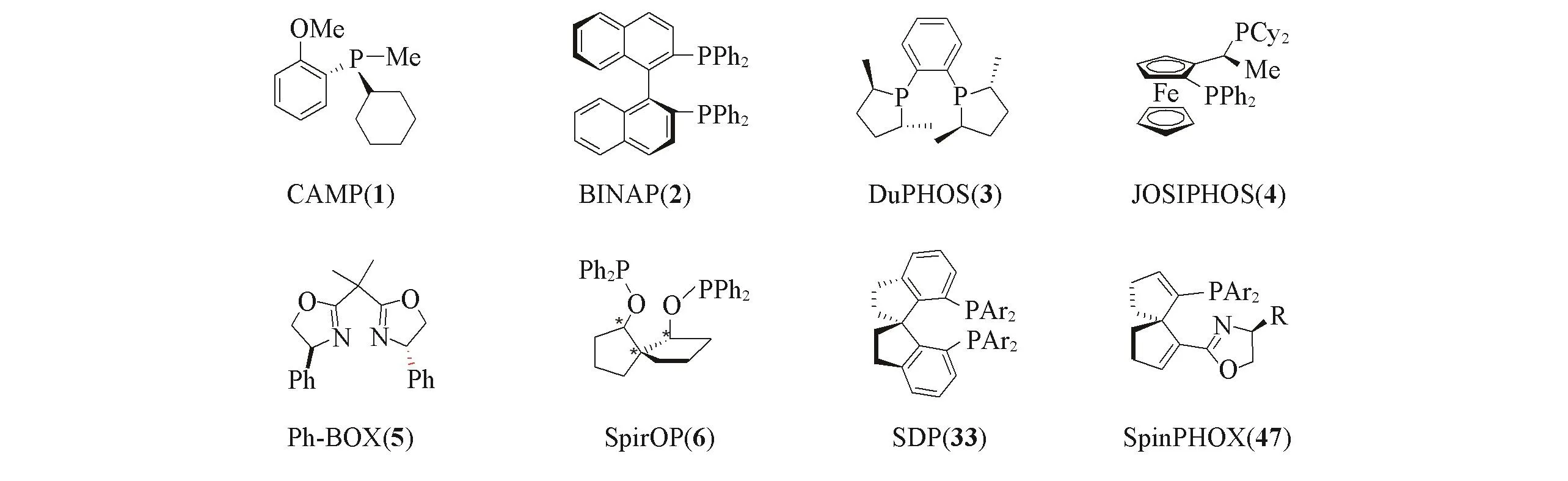
Fig.1 Representative examples of chiral ligands
1 手性螺环配体的前期发现
简单的螺[4.4]壬烷没有手性,如果在其1,6-位引入配位原子就能获得兼具有中心手性和轴手性的化合物分子(图2).由于这种螺环骨架分子包含1个季碳中心,不易发生消旋而具有良好的刚性,进而减少生成其它活性物种的可能性,产生更好的手性诱导效果[17].从20世纪90年代末开始,有机化学家对螺环手性配体的设计与合成产生了极大的兴趣.

Fig.2 Ligand design of spiro skeleton
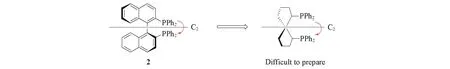
1992年,Kumar等[20]将cis,cis-螺[4.4]壬烷-1,6-二醇作为手性辅基协助四氢铝锂还原剂,实现了简单醇的不对称合成,但他们并未进一步将该螺环骨架分子发展成手性配体.1995年,Chan等[21]在克拉姆操作[22]基础上,详细地研究了螺[4.4]壬烷-1,6-二醇的3个立体异构体的合成与分离,利用均相和非均相的还原剂还原螺[4.4]壬烷-1,6-二酮,以92%的产率和82%的立体选择性得到了cis,trans-螺[4.4]壬烷-1,6-二醇(Scheme 1),为多个手性中心的螺环配体的制备开辟了一条比较高效的途径.与此同时,化学家普遍认为具有C2-对称的轴手性联二萘双膦配体(BINAP)由于存在2个高度扭曲的萘环,能够在不对称催化反应中产生优异的面选择性[23](Scheme 2).考虑到螺[4.4]壬烷骨架具有类似的C2-对称轴,有研究者尝试在螺[4.4]壬烷的1,6-位上引入二芳基膦,但由于空间位阻等原因,未能制备出含螺[4.4]壬烷骨架的双膦配体.

Scheme 1 Synthesis of spiro[4.4]nonane-1,6-diol
Scheme 2 Comparison of axial chirality and spiro center chirality
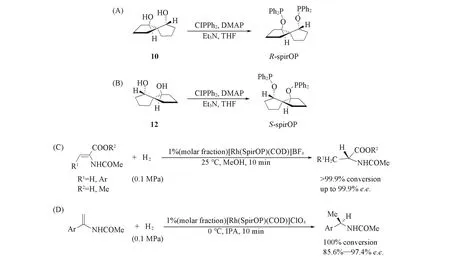
为了缓解芳基膦直接与螺[4.4]壬烷键合造成的空间障碍,1997年,Chan等[24]以螺[4.4]壬烷-1,6-二醇为原料,设计合成了首例螺环次亚膦酸酯配体[Scheme 3(A)和(B)],并将该双氧膦配体(R)-SpirOP与离子型铑络合物配位,催化脱氢氨基酸酯衍生物的不对称氢化反应[Scheme 3(C)],该反应获得了99.9%的转化率和高达99.9%的对映选择性(e.e.).研究表明,该氧膦配体在质子性溶剂中十分稳定,柔性的C—O—P键和刚性的螺环骨架互相弥补,有效地提高了产物的对映选择性.研究还发现,与双芳基轴手性配体BINAPO和BINAP相比,SpirOP在催化脱氢氨基酸酯及其衍生物的不对称氢化反应中表现出更加优异的立体控制效果.1999年,Chan等[25]又将SpirOP应用于简单的α-取代烯酰胺的不对称催化氢化反应中,以[Rh(R-spirOP)(COD)]ClO4为手性催化剂,产物的e.e.值高达97.4%[Scheme 3(D)].受手性螺环双氧膦配体的启发,2006年,Chen等[26]在双氧膦配体SpirOP的基础上引入苯环结构,设计合成了螺环双氧膦配体15(SpiroBIP,Scheme 4).研究发现,SpiroBIP在铑催化脱氢氨基酸及其衍生物的不对称氢化反应中所得产物的对映选择性低于SpirOP,说明在螺[4.4]壬烷的2,3位上引入苯环不能明显提高配体的立体控制效果.
Scheme 3 Spiro phosphinite ligands and their applications

Scheme 4 SpiroBIP ligands and their applications
1998年,Jiang等[27]在螺[4.4]壬烷骨架的基础上开发了螺环手性亚磷酸酯配体.他们利用光学纯的cis,trans-螺[4.4]壬烷-1,6-二醇与氯化亚磷酸盐反应一步生成双氧膦配体17[Scheme 5(A)],并应用于铑催化芳基烯烃的不对称氢甲酰化反应[Scheme 5(B)],获得了产率高达98%及e.e.值为69%的支链苯乙醛衍生物.1999年,Jiang等[28]尝试改变螺[4.4]壬烷骨架上亚磷酸酯的结构,一方面在螺环配体上引入大位阻的亚磷酸酯基团[Scheme 5(C)];另一方面设计了C1-对称的手性螺环亚磷酸酯配体[Scheme 5(D)],同样将该配体应用于芳基烯烃的不对称氢甲酰化反应中.研究结果表明,该反应产物的区域选择性和对映选择性无明显提升,反而稍有下降[Scheme 5(E)].
2004年,Chan等[29]将SpirOP中的氧原子替换为氮原子,设计合成了手性螺[4.4]壬烷骨架的次亚磷酰胺配体25[SpiroNP,Scheme 6(A)].研究表明,SpiroNP在铑催化脱氢氨基酸酯的不对称氢化反应中,表现出与SpirOP同样优异的立体控制效果[Scheme 6(B)].随后,将SpiroNP应用于衣康酸和其它α,β-不饱和羧酸的不对称催化氢化中,产物的e.e.值高达97%[Scheme 6(C)和(D)].

Scheme 5 Spiro diphosphite ligands and their applications
Chan等[21,24,29]和Jiang等[27,28]首次将螺环结构引入到手性配体中,设计和发展了基于螺[4.4]壬烷骨架的双氧膦配体SpirOP和双次亚磷酰胺配体SpiroNP等系列手性螺环配体,并成功地应用于不对称催化反应.研究发现,该螺环配体的螺碳结构赋予了手性配体独特的刚性和稳定性,氧膦结构又成功地给予了配体一定的柔性,使其在不对称氢化中显示出十分优异的活性和选择性.在不对称氢甲酰化反应中也表现出良好的反应性能.Chan等建立了手性配体设计的“刚性”理论,为手性配体的合成提供了新思路、新方法,从而推动了手性催化发展的进程.自此,发展结构可调、高效通用的手性螺环配体成为了21世纪不对称催化领域的研究热点.
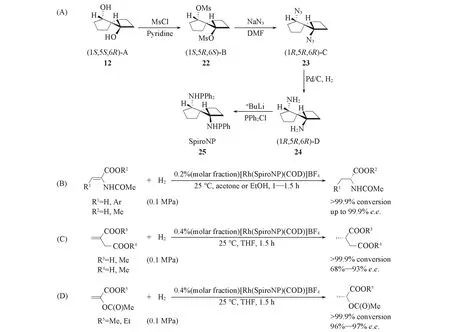
Scheme 6 Spiro bisphosphinamidite ligands and their applications
2 手性螺环配体的发展
尽管螺[4.4]壬烷骨架的手性双氧膦配体在不对称催化氢化和不对称氢甲酰化反应中取得了一定的研究进展,但在实际应用中该配体仍然存在如下需要解决的问题:(1)合成和修饰相对困难,主要是因为1,6-二取代螺[4.4]壬烷骨架分子存在多个立体异构体,导致分离纯化难度大;(2)螺[4.4]壬烷本身刚性过大,不利于产物的手性控制.因此,研究人员在螺[4.4]壬烷骨架的改造及结构优化上展开了系统的研究[9,16,18,30],取得了一定的成果(图3).
1997年,Zhang等[31]在螺[4.4]壬烷的2个环戊烷之间增加1个碳碳单键,合成了一类新颖结构的手性双膦配体28(BICP).尽管该配体不属于手性螺环配体,但在一定程度上解决了螺[4.4]壬烷骨架刚性过大的问题(Scheme 7).
Sasai等[32,33]在螺[4.4]壬烷骨架上引入双异噁唑啉环结构,首次将氮杂环引入到螺环配体的设计中[Scheme 8(A)],开发了手性螺环双氮配体29(SPRIXs)等,并将其应用于钯催化的1,6-烯炔的不对称氧化环化反应中[Scheme 8(B)],产物的e.e.值高达80%~95%. 此外,Sasai等[34,35]发展了手性螺环双噁唑啉配体和手性螺环双吡唑配体.这类手性配体在钯催化不对称Wacker类型的环化反应及铜催化的Henry反应中取得了较好的产率和对映选择性.
1999年,Birman等[36]首次报道了具有螺双二氢茚骨架的手性双酚SBINOL的合成与拆分,但他们并未将该结构发展为手性配体应用于不对称催化反应 .Zhou 等[5,9,14~16,18]敏锐地发现该螺环结构在不对称催化中的应用价值,并由此发展了一系列基于螺双二氢茚骨架的手性螺环配体(图4).

Fig.3 Development of chiral spiro ligands

Scheme 7 Synthesis of BICP ligand
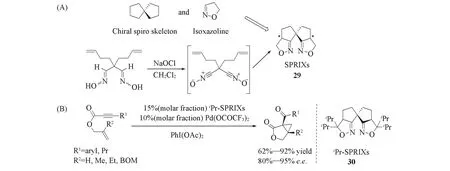
Scheme 8 SPRIXs ligands and their applications
基于C2-对称的螺双二氢茚骨架,Zhou等[37~39]设计合成了一类结构稳定,容易修饰的手性螺环亚磷酰胺酯配体31(SIPHOS).配体31a被成功地应用于铑催化烯酰胺和脱氢氨基酸酯的不对称氢化反应中[Scheme 9(A)和(B)],产物的对映选择性分别高达99.3%和99.5%.此外,手性螺环亚磷酰胺酯配体31b也被应用于铱催化的分子内烯胺的不对称氢化反应[40],产物的e.e.值高达97%[Scheme 9(C)].利用该方法,还制备出天然生物碱Crispine A[Scheme 9(D)].Zhou等[41,42]进一步将手性螺环亚磷酰胺酯配体31c和31d应用于镍催化的共轭双烯或炔烃与醛的不对称还原偶联反应,取得了优异的区域选择性和对映选择性[Scheme 9(E)和(F)].2018年,Zhou等[43]进一步将手性螺环亚磷酰胺配体31e应用于镍催化的1,6-二烯的分子内氢烯基化反应,获得了高达98%的产率和99%的对映选择性[Scheme 9(G)].与螺[4.4]壬烷骨架相比,螺双二氢茚骨架有效地减少了手性中心个数,同时缓解了膦原子键合螺环碳原子的立体障碍.
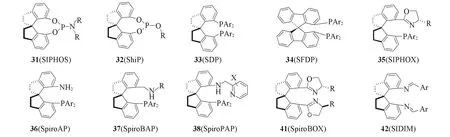
Fig.4 Chiral ligands with spirobiindane skeletons
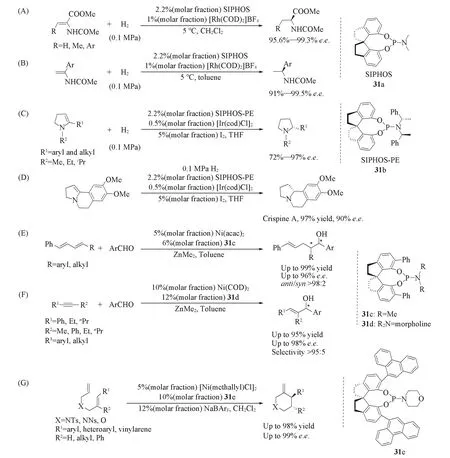
Scheme 9 SIPHOS ligands and their applications
Zhou等[44]在手性螺环亚磷酰胺酯配体的基础上,将P—N结构改为P—O结构,发展了手性螺环单齿亚磷酸酯配体32(ShiP),并将该配体应用于铑催化的芳基硼酸对α-酮酸酯的不对称加成反应,得到一系列具有重要生物活性的药物中间体α-羟基双芳基乙酸酯,获得了70%~93%的对映选择性[Scheme 10(A)].此外,该配体还被应用于芳基醛[45]或醛亚胺[46]与芳基硼酸的不对称亲核加成反应,高效构筑了多种多样的手性醇和手性胺类化合物[Scheme 10(B)和(C)].

Scheme 10 ShiP ligands and their applications
2003年,Zhou等[47]开发了基于螺双二氢茚骨架的手性双膦配体33(SDP),将该配体与金属钌配位生成手性钌双膦双胺催化剂,实现了简单酮的高效不对称氢化,其转化数(TON)值高达105,产物获得了96%~99.5%的对映选择性[Scheme 11(A)].研究还发现,手性螺环双膦双胺钌催化剂在不对称催化氢化反应中,对消旋的α-取代醛[48]和酮[49~58]具有非常明显的动态动力学拆分效果.在消旋的α-氨基取代的环状酮的不对称氢化反应中[50],手性螺环双膦配体与1,2-二苯基乙二胺组合的双膦双胺钌催化剂能实现其动态动力学拆分,并给出最好的催化结果,顺反异构体比例(cis/anti)值高达99:1,TON值可达3×104[Scheme 11(B)].对于消旋的非环状α-氨基取代的脂肪酮[52],其动态动力学拆分产物的对映选择性高达99.9%,顺反异构体比例也高达99∶1,TON值达104[Scheme 11(C)],该方法极大提高了天然产物(+)-γ-lycorane的全合成产率.
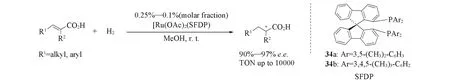
2005年,Zhou等[59]合成了一类具有更大二面角及更强刚性的螺二芴骨架的双膦配体34(SFDP),该配体在醋酸钌催化的α,β-不饱和羧酸的不对称氢化反应中取得了高达97%的对映选择性和高达104的TON值,显示出良好的应用前景(Scheme 12).
2006年,Zhou等[60]在螺双二氢茚骨架上同时引入芳基膦和噁唑啉环,获得手性螺环膦-噁唑啉配体35(SIPHOX),其在铱催化的亚胺的不对称氢化反应中表现出很高的催化活性和对映选择性[Scheme 13(A)].该手性螺环配体具有较强的刚性,很好地解决了经典的手性膦-噁唑啉配体(PHOX)在铱催化氢化过程中催化剂二聚失活的问题.2015年,Zhou等[61]利用该配体35d实现了铱催化的吡啶基取代的环内亚胺的不对称氢化反应[Scheme 13(B)],合成了生物碱尼古丁及其衍生物,取得了高达98%的产率和高于99%的对映选择性,值得注意的是,该反应体系中需要加入催化量的单质碘.此外,Ir/SIPHOX催化剂对不饱和羧酸的不对称氢化反应也表现出优异的催化结果.在铱催化的巴豆酸和肉桂酸的反应中,获得 83%~99.8% 的对映选择性和高达 104的 TON 值[62~64][Scheme 13(C)].Zhou等[65~68]还对手性N,P配体上的氮原子进行了改造,通过引入芳基胺和苄基胺,制备了36(SpiroAP)和37(SpiroBAP)等结构多样化的手性螺环配体,并取得了很好的应用价值(Scheme 13).

Scheme 11 SDP ligands and their applications
Scheme 12 SFDP ligand and their applications

Scheme 13 SIPHOX or other PN ligands and their applications
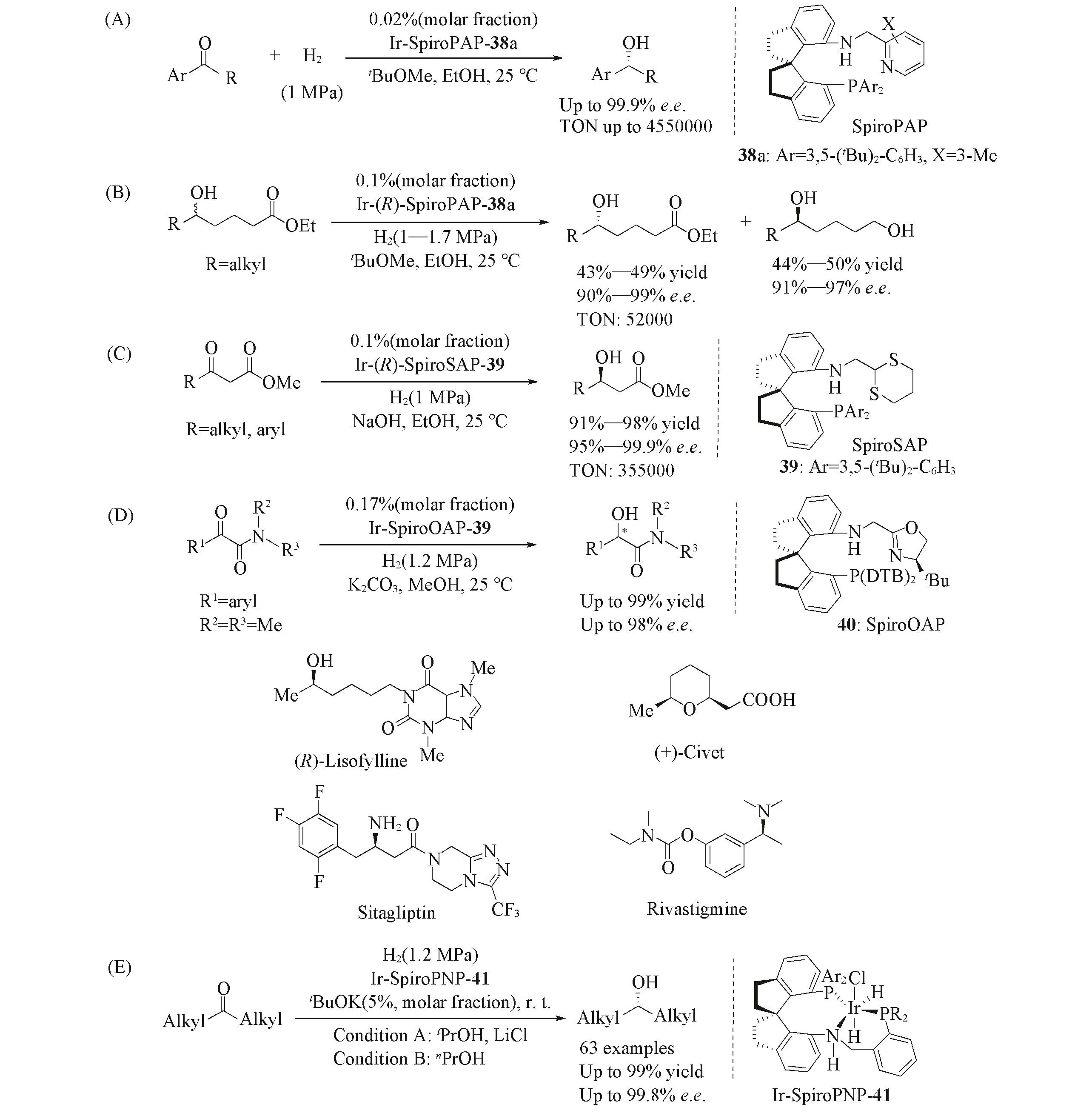
Zhou等[69~78]合成了氨基上连有吡啶环的手性螺环三齿P,N,N配体38(SpiroPAP,Scheme 14). 研究结果表明,该三齿配体在铱催化苯乙酮的不对称氢化反应中表现出优异的催化活性和选择性[69],获得高达4.55×106的转化数和超过99.9%的对映选择性[Scheme 14(A)].2014年,Zhou等[72]以Ir-SpiroPAP为催化剂,在脂肪醇的侧链上引入一个远程的酯基,并通过酯基的氢化来实现消旋脂肪醇的动力学拆分,产物的对映选择性达99%,TON达到5.2×104[Scheme 14(B)].他们利用该方法合成了手性药物(R)-Lisofylline和天然产物(+)-Civet.该催化剂也已经被用于治疗阿尔茨海默症的药物Rivastigmine的工业合成中[79].2015年,Zhou等[73]进一步开发了手性螺环三齿P,N,S配体39(SpiroSAP),并且实现了铱催化的β-烷基-β-酮酸酯的不对称氢化反应[Scheme 14(C)],获得了95%~99.9%的对映选择性,其TON值高达3.55×105;并利用该方法制备了治疗糖尿病类药物Sitagliptin.2019年,Zhou等[74]在设计手性螺环三齿配体时,将噁唑啉环替换吡啶环,生成一类新型结构的螺环膦-氨基-噁唑啉三齿配体40(SpiroOAP)[Scheme 14(D)].研究结果表明,该配体在铱催化的α-羰基酰胺的不对称氢化反应中能取得较优异的产率和立体选择性.值得一提的是,SpiroPAP被认为是不对称氢化反应中效率最高的分子催化剂.2020年,Zhou等[80]设计并合成了具有拥挤且狭窄手性口袋的手性螺环三齿膦-胺-膦配体41(SpiroPNP).研究表明,SpiroPNP/Ir催化剂对于挑战性的二烷基酮的不对称氢化具有优异的催化效果,在烷基甲基酮及脂肪族环状酮等底物的不对称氢化反应中,获得了最高可达99.8%的对映选择性[Scheme 14(E)].
Scheme 14 Spiro tridentate ligands and their applications
2006年,Zhou等[81]设计合成了含螺双二氢茚骨架的双噁唑啉配体42(SpiroBOX),该配体在过渡金属催化重氮酸酯与N—H或O—H的不对称插入反应中显示出优异的反应活性和对映选择性.Zhou等[82,83]还利用铜为中心金属结合噁唑啉环上带有苯基取代的螺环配体42a(SpiroBOX),实现了芳基胺与烷基重氮酯的不对称插入反应,获得了高达98%的对映选择性[Scheme 15(A)].2016年,Zhou等[84]将42a(SpiroBOX)应用于金属铜催化的分子内N—H与烷基重氮酯的插入反应中,高效地制备了一类2-酯基取代的手性四氢喹啉化合物,获得了76%~96%的对映选择性[Scheme 15(B)].随后,他们[85]利用手性螺环双噁唑啉配体42b参与铁催化的脂肪醇与芳基重氮酯的插入反应,取得了88%~99%的对映选择性和比较优异的反应收率[Scheme 15(C)].此外,Zhou等[86]也探索了其它碳-杂原子键的形成反应,通过对配体和催化剂的结构优化,开发了手性螺双二氢茚双亚胺配体43(SIDIM).该配体可以实现铜催化的α-芳基重氮酯与硅烷Si—H键的插入反应[Scheme 15(D)].

Scheme 15 SpiroBOX and SIDIM ligands and their applications
Zhou等通过对螺环结构的巧妙设计和改造,发展了一系列高效的手性螺环配体和催化剂库,推动了不对称催化领域的快速发展,使手性螺环配体成为配体当中“优势结构”的代表性分子,并在手性药物的合成及工业化生产中取得了极大的突破.
2009年,Ding等[87]将螺[4.4]壬烷骨架改造成为螺[4.4]-1,6-壬二烯结构,设计合成了只含有1个轴手性且刚性较强的螺环膦-噁唑啉配体47(SpinPHOX),首次报道了螺壬二烯骨架的手性配体[Scheme 16(A)和(B)].将该手性配体47a的铱催化剂应用于亚胺的不对称氢化反应中,制备的手性胺类化合物获得了最高可达98%的对映选择性[Scheme 16(C)].同时,该配体也被应用于合成治疗抑郁症的畅销药物舍曲林Zoloft[Scheme 16(D)].2012年,Ding等[88]将SpinPHOX应用于铱催化的α,β-不饱和酰胺化合物的不对称氢化反应中,获得了65%~97%的对映选择性[Scheme 16(E)].Ding等[89~91]进一步拓展了螺[4.4]-1,6-壬二烯骨架的手性配体,开发了基于螺[4.4]-1,6-壬二烯骨架的手性双膦配体49和手性螺环双噁唑啉配体48及膦氮配体50等,它们在金属铑和铜催化的脱氢氨基酸和简单酮的不对称氢化反应中,表现出较高的催化活性和较好的对映选择性.

Scheme 16 SpinPHOX or other spiro[4,4]nonadiene ligands and their applications
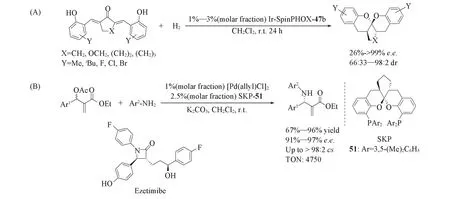
2012年,Ding等[92]在研究SpinPHOX参与的铱催化的α,α′-二-(2-羟基芳亚甲基)环酮的不对称氢化反应中发现,该催化剂可以选择性氢化碳碳双键而保留羰基,随后其氢化产物发生缩酮化,生成一类结构新颖的手性螺缩酮化合物[Scheme 17(A)]. 受到van Leeuwen等[93,94]发展的具有螺二色烷结构的双膦配体的启发,Ding等[95~97]将这类手性螺缩酮化合物衍生为具有螺二色烷结构的手性双膦配体51(SKP),并将其应用于钯催化的芳基胺与烯丙基醋酸酯的不对称丙基胺化反应,获得了高达96%的产率和97%的对映选择性以及大于98∶2的化学选择性,反应的TON值也高达4750[Scheme 17(B)].应用这一策略,他们完成了降胆固醇药物Ezetimibe的手性合成.
Scheme 17 Synthesis of SKP and their applications
2011年以来,Ding[98,99]和van Leeuwen等[100]均开发了螺二色烷骨架的手性双噁唑啉配体52(SPAN-box).Ding等发现,SPANbox在铜或锌催化的β-酮酸酯的α-位不对称羟基化或者氯化反应中,均能取得优异的催化活性和对映选择性[Scheme 18(A)和(B)].

Scheme 18 SPANbox ligand and their applications
2018年,Ding等[101]受到SKP螺缩酮骨架配体不对称催化合成策略的启发,设计合成了光学活性环己烷稠合螺双二氢茚骨架手性螺环配体.以α,α′-二(亚芳基)酮为原料,通过SpinPHOX/Ir催化的不对称氢化和Lewis酸TiCl4促进的双重Friedel-Crafts反应,以较高的收率和高达99%的对映选择性获得一系列手性环己烷稠合螺双二氢茚骨架的二酚化合物,并制备成手性三齿配体53[Scheme 19(A)].值得一提的是,在手性螺环P,N,N三齿配体/Ir催化的苯乙酮氢化的反应中,TON值可达106,显示出良好的应用前景[Scheme 19(B)].
2018年,Zhang等[102]对螺双二氢茚骨架进行改造,用氧原子取代螺环上碳原子,开发了独特结构的氧杂-螺环二酚化合物56(O-SPINOL),并衍生为手性螺环氨基膦吡啶三齿配体57[Scheme 20(A)],并将其应用于铱催化的桥联二芳基内酯(Bringmann’s内酯)的直接不对称氢化[Scheme 20(B)],以优异的收率和对映选择性得到高价值的轴手性化合物,获得了高达99%的收率和高于99%的对映选择性.研究表明,该氧杂-螺环手性二酚56(O-SPINOL)具有合成简单,无需柱层析分离等优势,在一定程度上解决了SPINOL合成相对困难的问题.

Scheme 19 Synthesis of chf-SpiroPAP ligand and their applications

Scheme 20 Synthesis of O-SpiroPAP ligand and their applications
2018年,Sun等[103]在手性螺双二氢茚双膦配体33(SDP)的基础上,开发了手性螺缩酮双膦配体60,成功应用于脱氢氨基酸酯的不对称氢化反应中,其产物的对映选择性高达99.5%(Schem e 21).
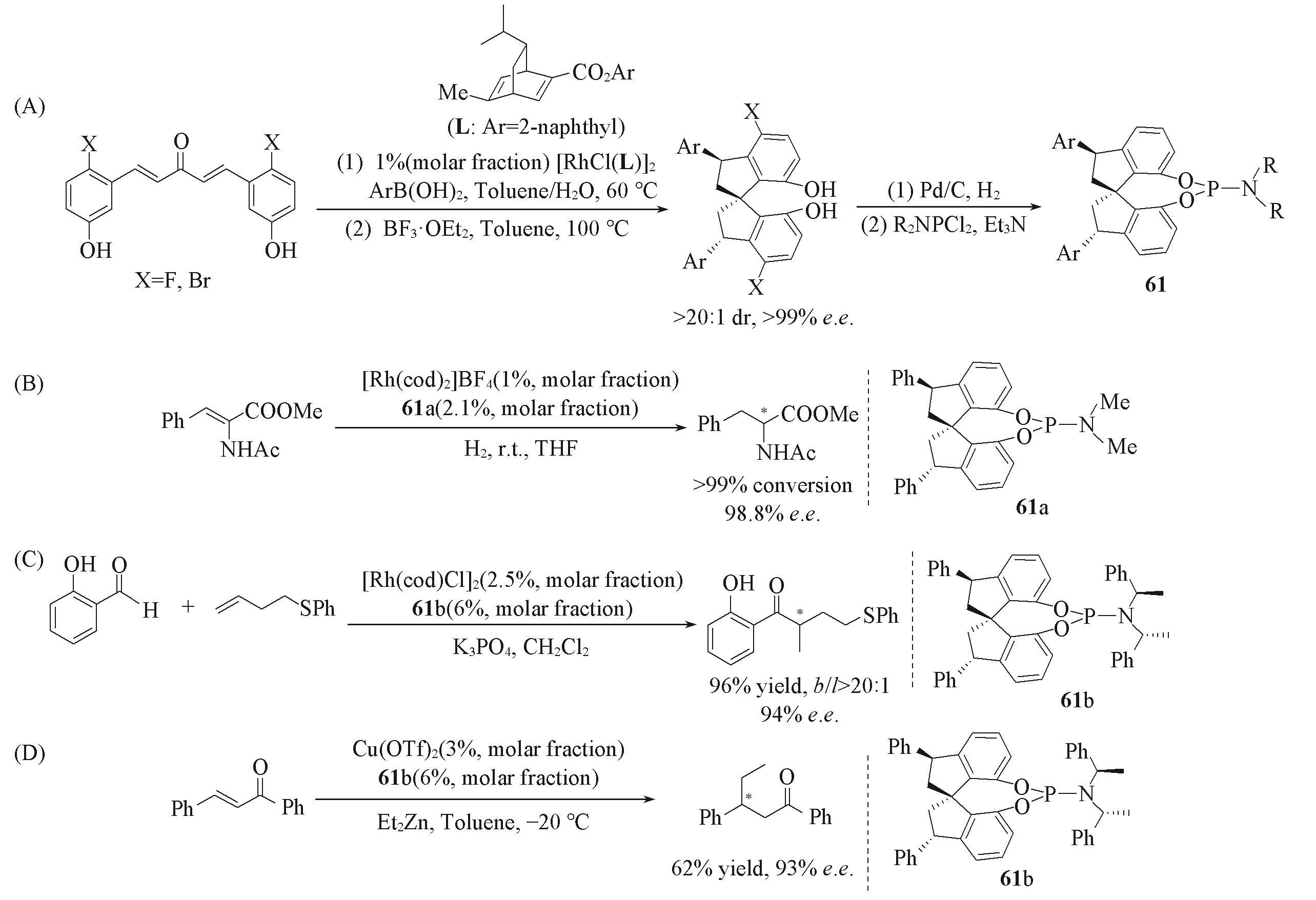
2019年,Dou等[104]通过铑催化二重不对称共轭芳基化加成反应-三氟化硼促进的分子内螺环环化反应,高效高选择性地合成出一系列3,3′-二芳基取代的手性螺环二酚类化合物及手性螺环亚磷酰胺酯配体61[Scheme 22(A)].该配体被应用于铑催化的脱氢氨基酸酯的不对称氢化[Scheme 22(B)]、铑催化烯烃的不对称氢酰基化[Scheme 22(C)]及铜催化烯酮的不对称共轭加成反应[Scheme 22(D)],均取得了良好的催化结果.2020年,Dou等[105]利用类似的策略构筑了4,4-二芳基取代的手性螺二色满双膦配体63(Scheme 23).

Scheme 21 Synthesis of spiroketal bisphosphine and their applications
Scheme 22 Synthesis of spiro 3,3′-diarylated phosphoramidite ligands and their applications
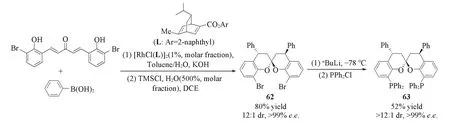
Scheme 23 Synthesis of 4,4′-disubstituted 2,2′-spirobichromans and bisphosphine ligand
3 手性螺环小分子催化剂的发展
螺环结构的化合物分子作为手性配体被广泛应用于金属催化的不对称合成反应中,取得了巨大的进展.近年来,螺环结构也发展成为手性小分子催化剂的重要骨架[106],成功实现了一系列重要的不对称催化反应.
2009年,Fu等[107]发展了一类富电子的手性螺环单膦配体64(SITCP),研究发现,该配体可以作为亲核性的有机小分子催化剂,催化分子内羟基与炔酯的不对称加成反应,合成手性2-取代四氢呋喃环或吡喃环,获得了高达90%的产率和最高94%的对映选择性.利用该方法,他们[108]实现了2-取代的手性吡咯环和二氢吲哚的合成,同样获得了高达94%的对映选择性(Scheme 24).
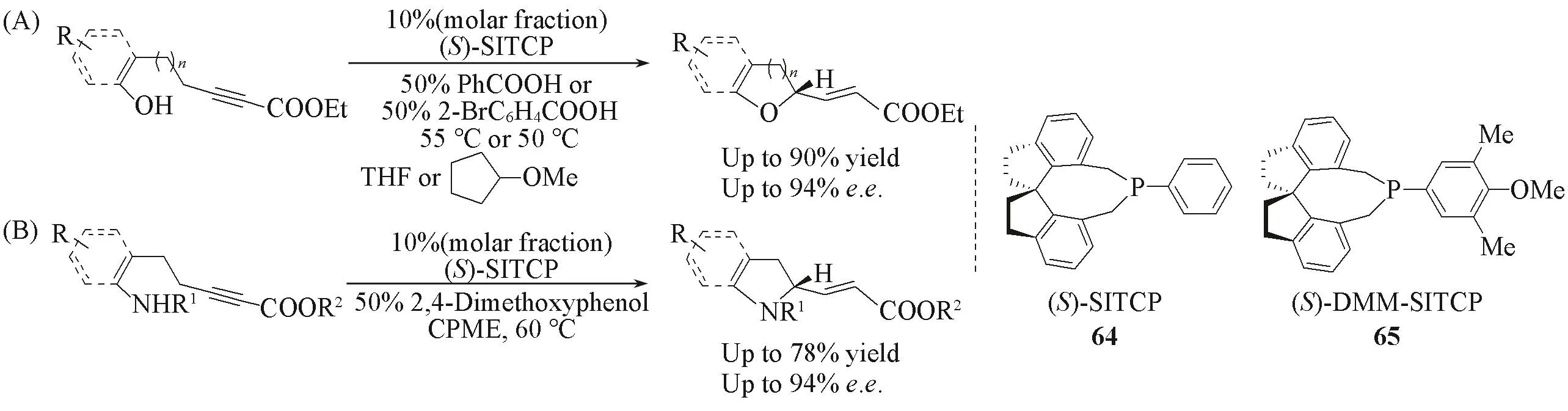
Scheme 24 Application of SITCP as organocatalyst
2015年,Zhou等[109]利用手性螺环单膦配体64(SITCP)催化苯并呋喃酮与联烯基酯的不对称[3+2]环加成反应,合成了一系列手性螺环化合物,产率高达99%,区域选择性大于99%,对映选择性达到99%[Scheme 25(A)].2010年,Zhou等[110]利用螺双二氢茚骨架的单膦65(DMM-SITCP)作为小分子催化剂,催化不对称分子内串联反应,得到苯并双环[4.3.0]化合物,获得了>95%的化学选择性和>99%的对映选择性[Scheme 25(B)].2015年,Sasai等[111]采用手性螺环单膦64作为路易斯碱催化剂,参与联烯基酯对前手性二烯基酮的去对称化反应,以优异的对映选择性获得手性苯并呋喃酮化合物[Scheme 25(C)].2016年,Kumar等[112]将手性单膦64(SITCP)应用到α-取代联烯与靛红衍生的酮亚胺发生不对称[3+2]环加成反应,以最高可达99.9%的对映选择性获得目标化合物[Scheme 25(D)].

Scheme 25 Application of SITCP as organocatalyst

Scheme 26 Application of SPA as organocatalyst
2010年,List等[113]在螺双二氢茚骨架基础上引入磷酸,开发了结构新颖的手性螺环磷酸催化剂66b,并实现了缩醛仲醇化合物和缩醛叔醇化合物的动力学拆分[Scheme 26(A)],获得一系列手性环状缩醛化合物和非环缩醛醇类化合物,产物的对映选择性高达98%,剩余原料获得了高达97%的对映选择性.2010年,Wang等[114]报道了螺双二氢茚骨架的手性磷酸催化剂66a(SPA)催化的不对称Friedel-Crafts反应,取得了大于97%的产率和大于99%的对映选择性[Scheme 26(B)].Lin等[115]研究发现,该手性螺环磷酸催化剂66a在不对称Pictet-Spengler反应当中也能取得高达98%的对映选择性和高达99%的产率[Scheme 26(C)].2019年,该课题组[116]将手性螺环磷酸66b应用于钯催化的联芳基化合物的C—H烯基化反应,制备了一系列轴手性双芳基化合物[Scheme 26(D)],取得了高达98%的对映选择性.2011年,Zhou等[117]也将该手性螺环磷酸催化剂66a应用到芳基重氮酯对N—H的不对称插入反应中,产物的对映选择性高达95%[Scheme 26(E)].2011年,Hu等[118]报道了螺双二氢茚骨架的手性磷酸催化66a的吲哚与醛亚胺的亲核加成反应,以最高99%的产率和99.5%的对映选择性获得目标化合物[Scheme 26(F)].2019年,Zhou等[119]设计合成了螺环手性磷酰胺67,该催化剂在硫醇对环外共轭烯酮的迈克尔加成反应中具有非常优异的催化活性和对映选择性[Scheme 26(G)],其底物的适用范围也比较广泛.
2015年,Tu等[120]在螺[4.4]壬烷骨架基础上,将其中1个环戊烷替换成吡咯烷,开发出新型手性螺氨醇硅醚催化剂68,并将其应用于催化不对称Michael加成反应中,取得了最高>99%的对映选择性,高效地构筑了具有挑战性的全碳季碳结构单元(Scheme 27).研究结果表明,与传统的脯氨醇硅醚类催化剂作对比,1-氮杂螺[4.4]壬烷骨架的有机催化剂68具有更好的立体控制效果.

Scheme 27 Application of spiro-pyrrolidine as organocatalyst
2019年,Du等[121]利用具有手性螺环骨架的双烯化合物与HB(C6F5)2发生氢化反应,原位合成手性硼烷路易斯酸69,并组合三叔丁基膦化合物,获得了手性FLPs.该催化剂被应用于简单酮的不对称硅氢化反应中,其产物的对映选择性最高可达90%(Scheme 28).

Scheme 28 Application of spiro dienes derived boranesas organocatalyst
4 总结与展望
不对称催化反应的重大突破总是与新型手性配体的出现密切相关,手性配体的设计与合成已经成为不对称催化领域的关键问题.在数以千计的手性配体当中,手性螺环配体作为一类刚柔并济、结构可调的“明星分子”,在近30年来经历了从发现起步到快速发展的过程,已经被广泛应用于不对称催化氢化、不对称C—C和C—X键形成等有机反应中.中国化学家在推动手性螺环配体的设计合成与应用上做出了十分重要的贡献.不仅如此,手性螺环配体也由螺碳中心骨架向螺硅中心骨架发展,近期也取得了一定的进展[122].未来,手性螺环配体的设计将会朝着简单、高效且通用的方向发展,越来越多的手性螺环配体将被应用于手性天然产物、手性药物和手性材料的工业应用中.