多肉植物大苍角殿再生体系的建立
吴 霞,上官小霞
(山西农业大学棉花研究所,山西运城044000)
近年来,多肉植物因种类繁多、体态清雅、形状奇特、色彩丰富等特点,逐渐成为盆栽品种,越来越受到消费者的喜爱[1]。随着多肉市场的繁荣发展,普通的中低端产品已经不能满足多肉植物爱好者的需求,所以对中高端多肉植物品种的引种、扩繁及市场化培育成为国内多肉植物产业发展的趋势[2-3]。
大苍角殿(Bowiea volubilis)是百合科苍角殿属植物,原产于南部非洲的干旱地区,是多年生草本多肉植物[4]。其特点是有一个绿色的大鳞茎,鳞茎顶端簇生细长绿色枝条,叶退化成线形,茎蔓分枝性佳,沿着支架缠绕攀爬,可依据个人喜好搭建不同观赏造型,是目前国际上最流行的茎干状多肉植物的代表种之一。但其繁殖速度较慢、繁殖成本较高,效率低,而且成年株开花较迟、结籽能力非常低,不易收获种子;目前,国内市场的大苍角殿种子多为进口,发芽率较低,这些因素严重制约了该品种的市场发展。植物组织培养技术因其培养周期短、繁殖率高、不受自然地理环境和季节限制等优点,在良种快繁、无病毒苗的培养、种质资源保存、次生代谢物生产等方面都得到了广泛的应用[5-10]。利用植物组织培养技术,可摆脱大苍角殿自身特性的禁锢,起到快速繁殖、丰富品种的作用,有利于推动多肉植物市场繁荣,满足多肉植物爱好者的需求。
目前,国内对多种多肉植物的组织培养及再生体系已有较多研究报道,而且景天科、芦荟科、仙人掌科、阿福花科、百合科等多个品种的组培再生体系已经建立[11-14]。而对百合科多肉植物的组培再生研究主要集中在十二卷属的品种[15-19],对苍角殿属植物的组织培养及快速繁殖的研究还未见报道。
本研究通过组织培养的方法,探索了不同激素组合对多肉植物大苍角殿幼嫩枝条外植体初代丛生芽诱导、丛生芽继代培养以及芽苗生根的影响,旨在建立大苍角殿无菌快速繁殖体系,对其种质资源保存及推广应用具有重要的理论和实践意义。
1 材料和方法
1.1 材料
以多年生大苍角殿的当年生幼嫩枝条为外植体。
1.2 方法
1.2.1 取材与消毒 小心剪取大苍角殿当年生幼嫩枝条,放入烧杯中用自来水冲洗干净,转入超净工作台进行消毒处理,即用70%的酒精浸泡30 s,用无菌水冲洗2~3次;然后用0.1%的HgCl2溶液浸泡8~10 min,期间可轻轻晃动,倒去HgCl2溶液,用无菌水冲洗4~5次;将材料用滤纸吸干水分,切成1 cm左右的小段,备用。
1.2.2 培养条件 外植体的初代丛生芽诱导、丛生芽继代增殖培养、芽苗生根培养均在组织培养室内进行。培养室温度为(26±2)℃,光照条件为1 500 lx左右、16 h/d。
1.2.3 培养方法 试验以MS为基本培养基,添加不同的激素进行丛生侧芽诱导及生根培养。培养基pH值均为5.8~6.2。MS培养基粉末购至美国PhytoTechnologyLaboratories公司;6-苄氨基腺嘌呤(6-Benzylaminopurine,6-BA)为细胞分裂素;1-萘乙酸(1-Naphthaleneacetic acid,NAA)和吲哚-3-乙酸(indol-yl-3-acetic acid,IAA)为生长素。
将配制好的培养基及时用高压灭菌器进行灭菌,灭菌条件为121℃灭菌15 min。其中,A1~A6培养基(A1.MS+6-BA1.0 mg/L+NAA0.1 mg/L+3%蔗糖+0.7%琼脂;A2.MS+6-BA 1.0 mg/L+NAA 0.2 mg/L+3%蔗糖+0.7%琼脂;A3.MS+6-BA 2.0 mg/L+NAA0.1 mg/L+3%蔗糖+0.7%琼脂;A4.MS+6-BA 2.0 mg/L+NAA 0.2 mg/L+3%蔗糖+0.7%琼脂;A5.MS+6-BA3.0 mg/L+NAA0.1 mg/L+3%蔗糖+0.7%琼脂;A6.MS+6-BA 3.0 mg/L+NAA0.2 mg/L+3%蔗糖+0.7%琼脂)用于丛生芽诱导试验;B1~B8培养基(B1.MS+3%蔗糖+0.7%琼脂;B2.MS+IAA 0.05 mg/L+3%蔗糖+0.7%琼脂;B3.MS+IAA 0.1 mg/L+3%蔗糖+0.7%琼脂;B4.MS+IAA 0.2 mg/L+3%蔗糖+0.7%琼脂;B5.1/2 MS+3%蔗糖+0.7%琼脂;B6.1/2 MS+IAA 0.05 mg/L+3%蔗糖+0.7%琼脂;B7.1/2 MS+IAA 0.1 mg/L+3%蔗糖+0.7%琼脂;B8.1/2 MS+IAA 0.2 mg/L+3%蔗糖+0.7%琼脂)用于生根培养试验。
在无菌条件下,将经过消毒处理、切成1 cm左右的茎段分别接入A1~A6培养基,进行初代侧芽的诱导培养;待诱导出的丛生侧芽长到约1 cm大小时,用手术刀片将其分割,移入A3~A6培养基中进行丛生侧芽的继代繁殖;待新长出的侧芽约1.5 cm大小时,选取生长一致的侧芽接入B1~B8生根培养基中进行生根培养。
1.2.4 炼苗与移栽 待植株长到8~10 cm大小、且根系生长旺盛时,打开培养瓶盖进行炼苗,3 d后移栽。移栽基质火山岩∶赤玉土∶绿沸石∶泥炭体积比为1∶1∶1∶2,基质混匀后经高压灭菌器灭菌,备用。
1.3 数据分析
采用Excel软件进行数据整理及图表绘制。
2 结果与分析
2.1 不同培养基对大仓角殿外植体丛生芽诱导的影响
将消毒好的外植体切段接入到A1~A6培养基进行初代丛生侧芽的诱导,培养15 d左右,可观察到切段两端逐渐膨大;30 d左后可观察到部分切段两端诱导出丛生芽,另有一些未诱导出丛生芽的切段两端有白色不定根生成。40 d后不同培养基诱导外植体分化的结果如表1所示,细胞分裂素6-BA 质量浓度为 1.0、2.0 mg/L(A1~A4)时,外植体分化率较低,而不定根的发生率则相对较高;当6-BA 质量浓度为 3.0 mg/L(A5、A6)时,外植体分化出从生侧芽的比率明显升高,同时不定根的发生率则明显降低(表1、图1)。
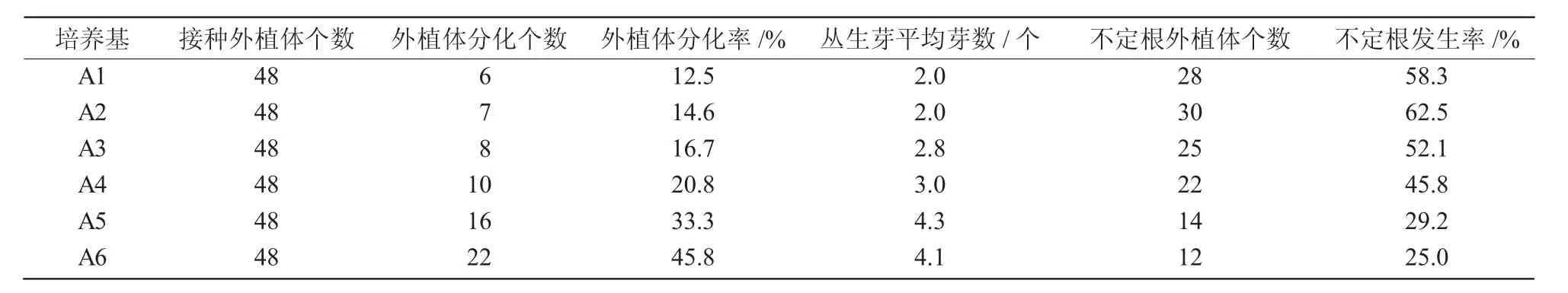
表1 不同培养基对大苍角殿外植体丛生芽诱导的影响
由此可见,高浓度的细胞分裂素有利于诱导大苍角殿外植体丛生芽的分化,利用A6培养基,初代丛生芽诱导率可达45.8%,丛生芽平均芽数达4个以上。
2.2 不同培养基对丛生芽增殖培养的影响
当诱导出的初代丛生芽长至1 cm大小时,用手术刀片将丛生芽切开,接入不同的培养基中进行继代培养,进一步诱导更多的丛生芽。与外植体诱导丛生芽相比,初代芽再分化出新芽的时间较短,一般21~28 d即可诱导出大量的丛生芽。从表2可以看出,A3~A5培养基诱导不定芽进一步分化率无明显的差异(培养28 d),皆为50%左右;A6培养基诱导分化率相对较高,达61.5%,且芽长势速率较快,长势旺盛。考虑到后期需要多次进行继代培养,扩繁丛生芽,长期高浓度的激素培养会影响植物体内的激素平衡,有可能导致后期丛生芽生长变异,所以,在丛生芽继代培养过程中,推荐使用A3培养基进行继代繁殖及无菌种质资源保存。

表2 不同培养基对丛生芽增殖培养的影响
2.3 不同培养基对芽苗生根的影响
继代培养的丛生芽长到1.5 cm以上时,用手术刀片将其分割为单个个体,移入不同的生根培养基进行生根培养,15 d左右即可观察到部分芽苗已经有新根长出;30 d左右,部分幼苗根系可达3 cm以上,幼苗生长旺盛、长势良好的植株株高可达8 cm以上。从表3可以看出,不同培养基配方对幼苗生根影响较大,1/2 MS培养基(B5~B8)生根情况优于MS培养基(B1~B4),可见,降低矿物元素的含量有利于根的形成及生长。另外,添加不同浓度的生长素可以提高幼苗的生根率,其中,B8培养基诱导生根率达最高,为86.7%,且根系生长良好。
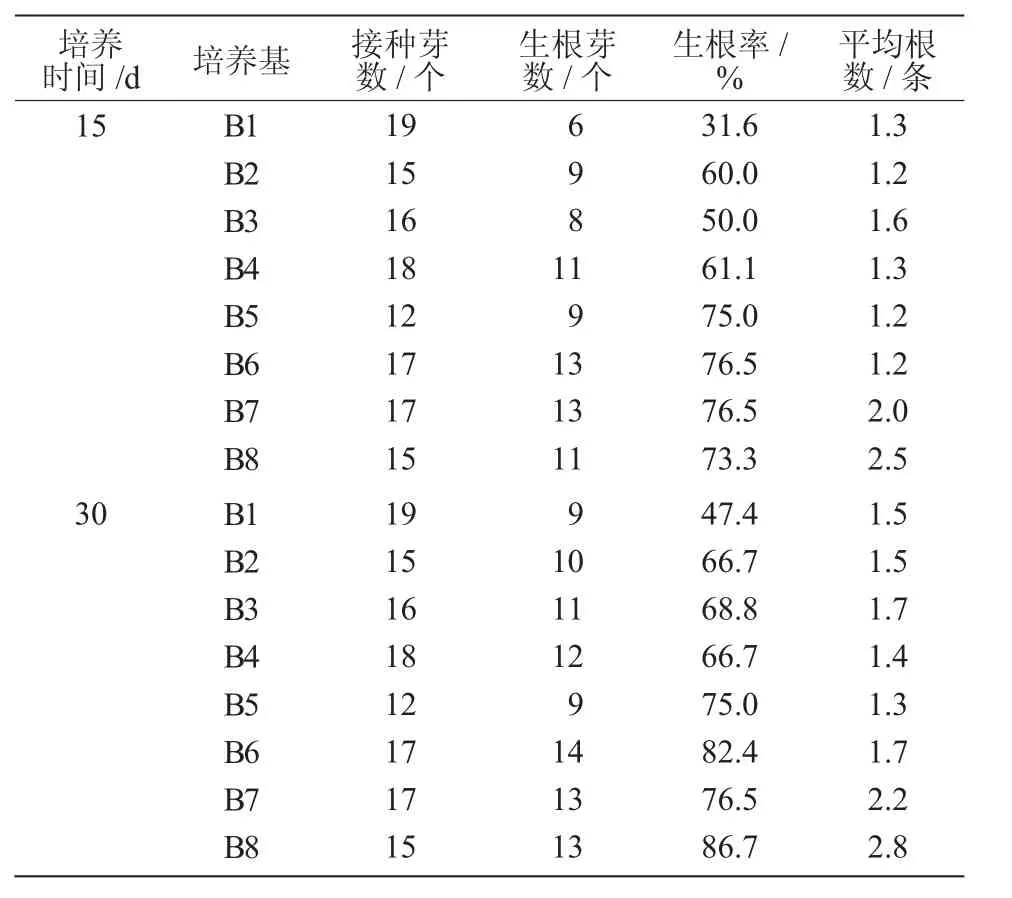
表3 不同生根培养基对芽苗生根的影响
2.4 移栽结果分析
在生根培养基中培养30 d以后,挑选根系生长良好、且幼苗植株生长健壮、株高7~8 cm的植株,揭开瓶盖,炼苗3 d左右;然后用镊子将瓶苗取出(操作过程中要小心,以免折断根系)用自来水冲干净根部培养基,然后插入移栽基质中(图2)。组培苗移栽初期,低温高湿环境生长,14 d后可移到自然条件下生长。
3 结论与讨论
本研究选用大苍角殿当年新生枝条为外植体,以MS为基本培养基进行丛生芽诱导和增殖培养,结果表明,适宜丛生芽诱导的培养基为MS+6-BA 3.0 mg/L+NAA 0.2 mg/L+3%蔗糖+0.7%琼脂;适宜丛生芽继代培养的培养基为MS+6-BA2.0mg/L+NAA0.1 mg/L+3%蔗糖+0.7%琼脂;最适生根培养以1/2 MS为基本培养基,添加0.2 mg/L IAA,该培养基中培养30 d生根率可达86.7%。
大苍角殿幼嫩枝条外植体消毒及初代丛生芽的诱导是成功建立其组培再生体系的关键环节。以当年生的幼嫩枝条切段作为外植体,在消毒过程中,要注意掌握HgCl2的消毒时间,消毒时间过短(5 min),外植体消毒不彻底,容易造成污染;消毒时间过长(15 mim以上),虽然可明显降低外植体污染率,但外植体会受到伤害,容易褐化,死亡率增加。因此,要兼顾消毒效果以及对外植体的伤害程度,不同植物激素添加比例会影响外植体器官发生的方向,细胞分裂素和生长素比值较高时,可促进芽的发生[20-21]。大苍角殿外植体在初代丛生芽的诱导过程中,生长素含量一定时,低浓度的细胞分裂素可诱导外植体产生不定根,从而抑制丛生芽的分化,在此阶段,需要采用高浓度的细胞分裂素。本试验使用的细胞分裂素质量浓度最高为3.0 mg/L,丛生芽发生率小于50%。在以后的试验过程中,可以适当再增加细胞分裂素浓度,以摸索最适外植体诱导丛生芽分化的最佳激素配比,提高初代丛生芽分化比例。
不定芽的继代培养过程中,虽然较高浓度的细胞分裂素可以诱导出更多的不定芽,且芽生长较快,但容易诱导出畸形芽,所以,在继代培养过程中,适当降低细胞分裂素浓度,有利于长期的组培及继代培养丛生芽。长期使用激素诱导对植物从生芽生长状态的影响以及最适宜的大苍角殿组培快繁激素配比还需要进一步研究。

